CT读片低密度篇:缺血性脑卒中图文解析:
2023-06-17 神经病学医学网 神经病学医学网 发表于上海
阅片需要注意的内容包括:脑梗死的CT改变、ASPECTS(指导治疗)、供血区,MCA供血区梗死约占75%,其他供血区梗死、急性期or慢性期,演变过程、并发症。
头CT读片,常见的在头CT上显示为低密度的病灶包括:
-
脑梗死
-
肿瘤
-
炎症、脓肿和其他少见病灶
今天说下脑梗死。
阅片需要注意的内容包括:
-
脑梗死的CT改变
-
ASPECTS(指导治疗)
-
供血区,MCA供血区梗死约占75%,其他供血区梗死
-
急性期or慢性期,演变过程
-
并发症
1. 脑梗死早期CT改变
-
早期可为阴性(<6小时内)
- 60-70%敏感性
- 深部灰质(基底节区)改变可在1小时出现
-
血管高密度征(+/-)
-
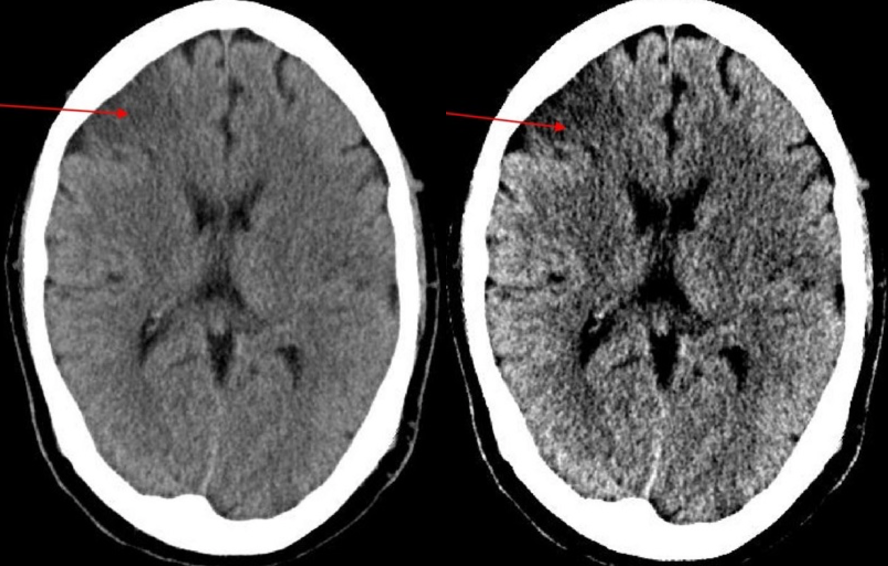
灰白质分界模糊(loss of GWM)*
-
低密度*
-
占位效应*
-早期局灶性:脑沟变浅/消失(effacement)
*均由于细胞毒性水肿所致,3-7天达高峰
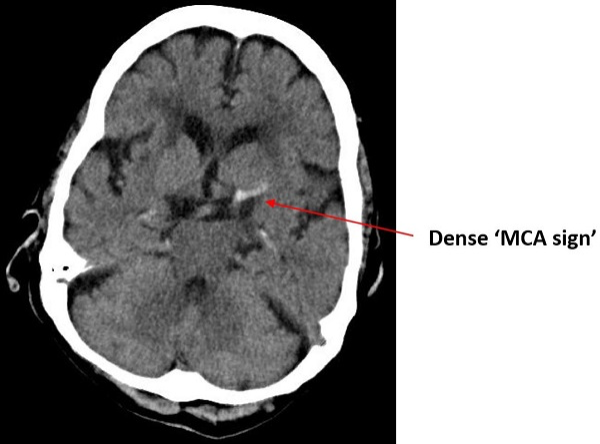
血管高密度征:提示急性血栓影;非对称
需注意鉴别血管钙化、高HCT、年轻患者(与其他血管对比)
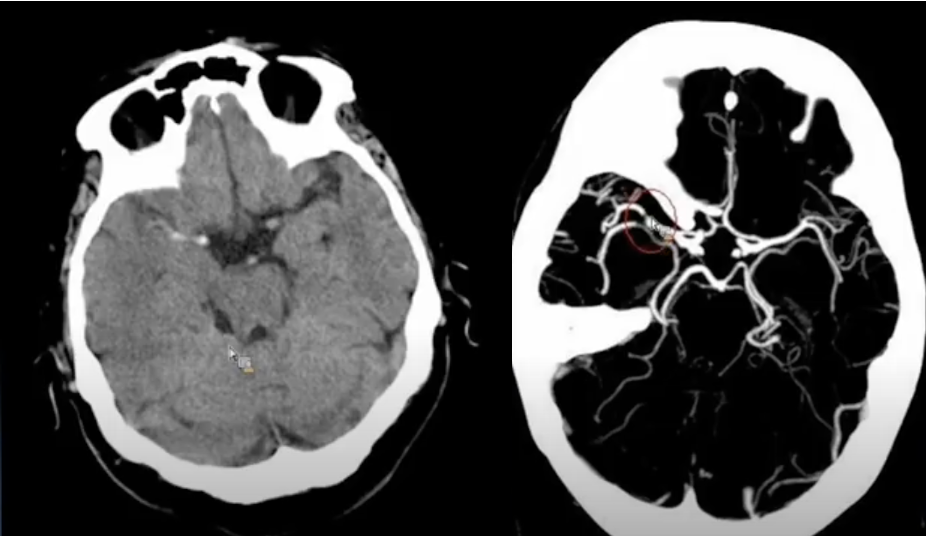
岛带征:头CT平扫基底节层面,见脑岛侧面灰质-白质界限不清
(脑岛侧面由大脑中动脉供血,为前、后循环侧支末端,对于缺血极为敏感)


深部(基底节区)灰白质界限消失
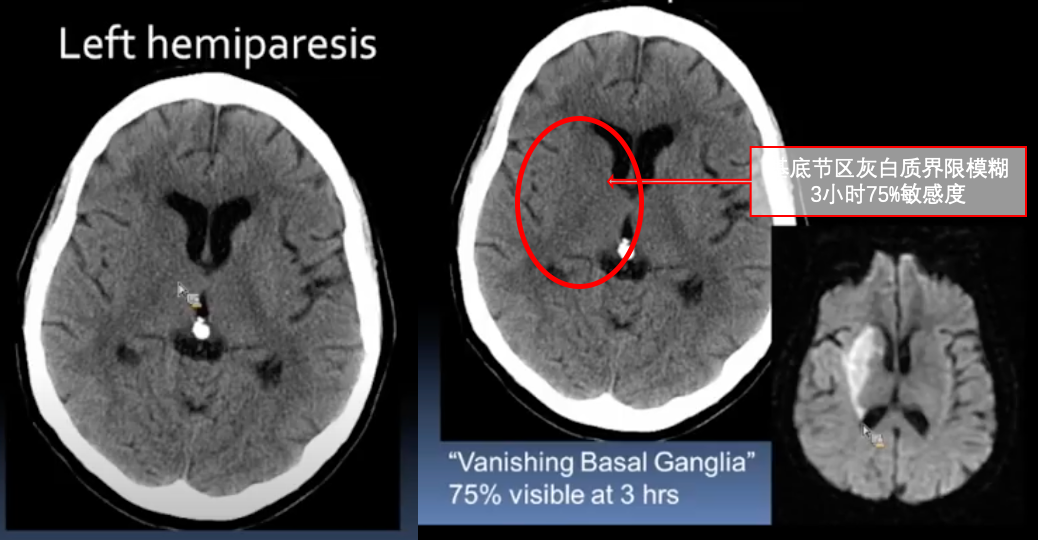
可使用卒中窄窗阅片:窗位30(30-40),窗宽30(20-40)
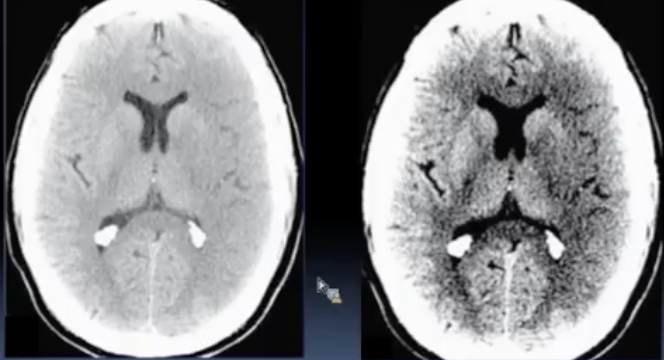
灰白质界限消失
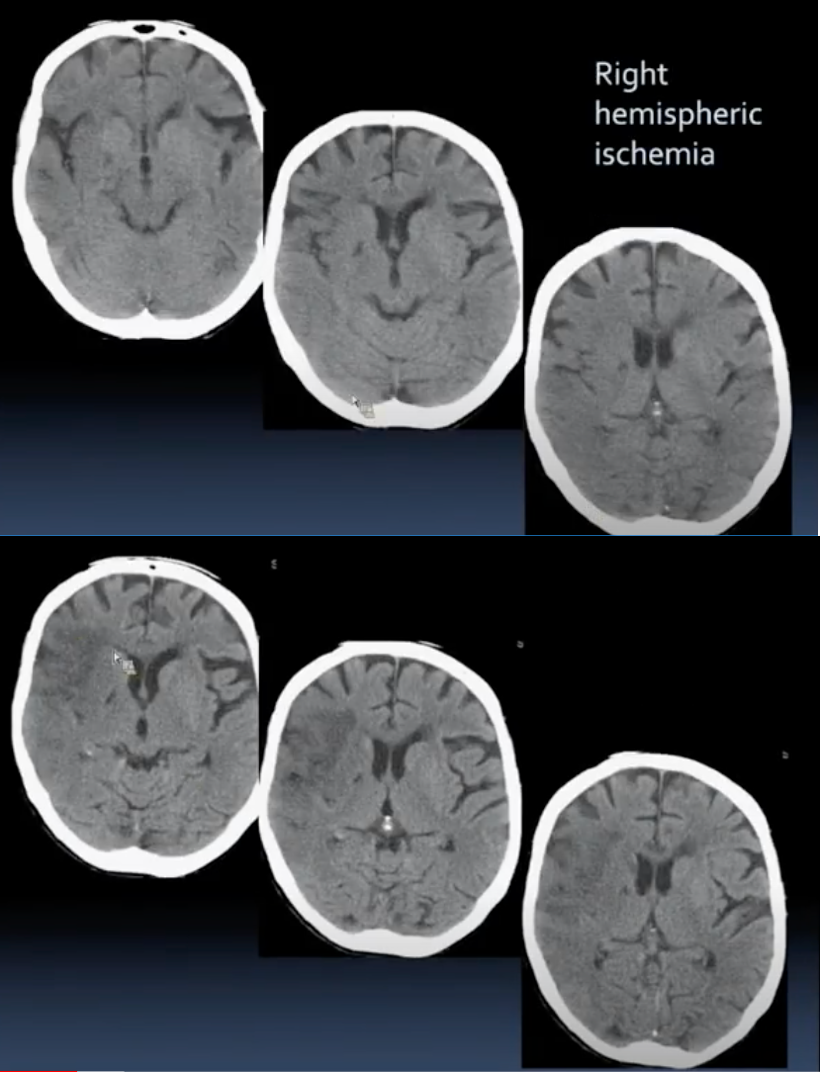
(右侧皮层脑沟变浅、基底节区、岛叶界限模糊,逐渐出现低密度影)
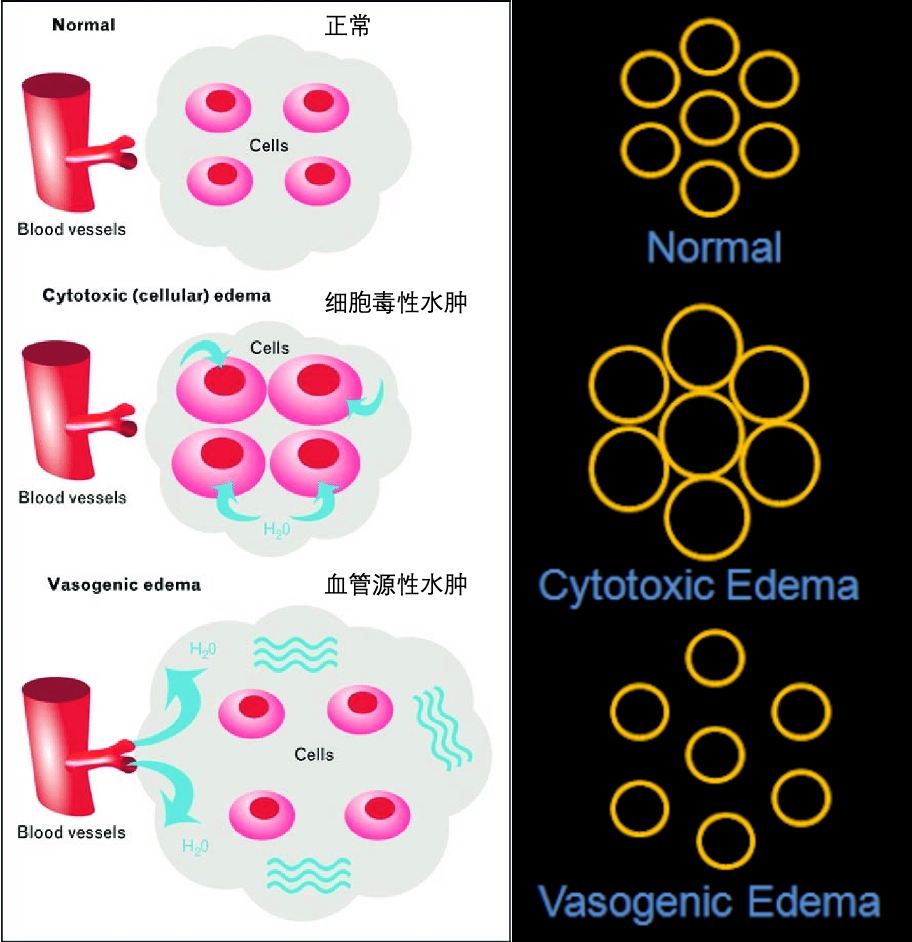
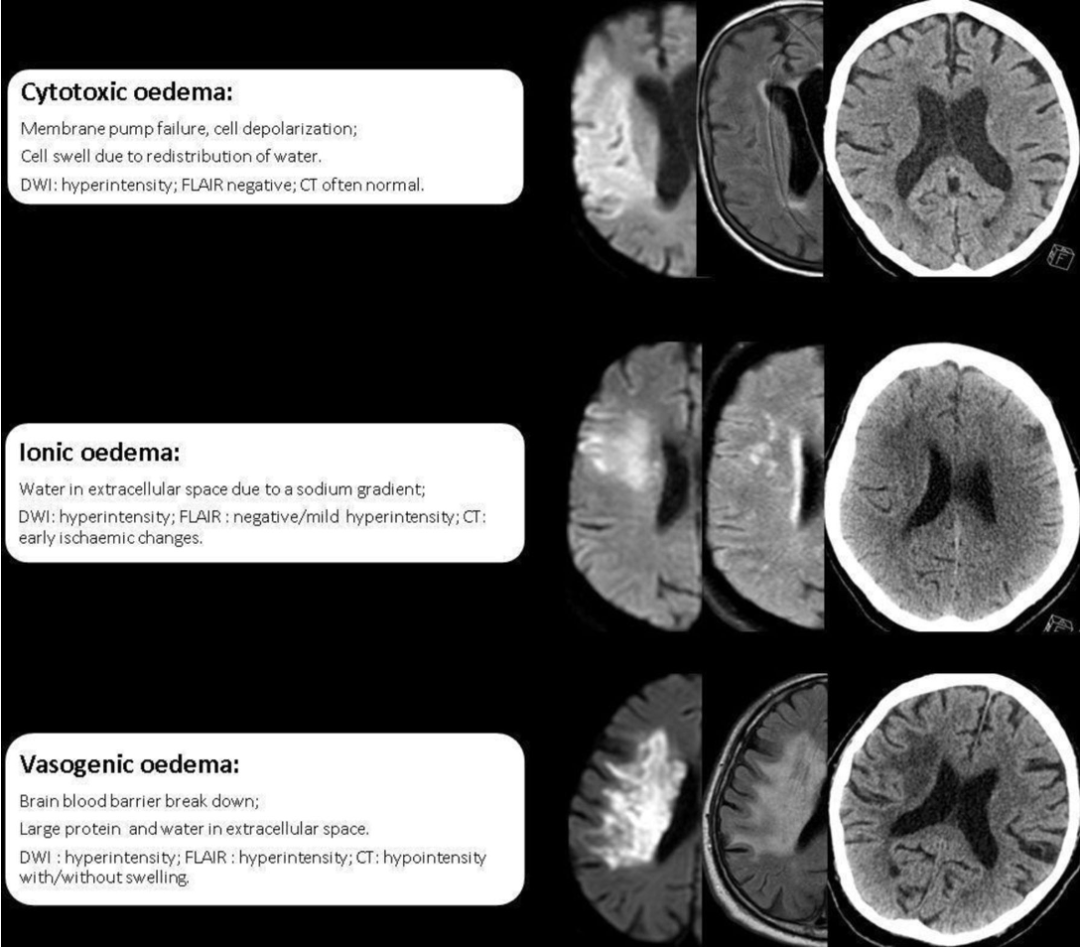
2. 细胞毒性水肿vs血管源性水肿
| 细胞毒性水肿(cytotoxic) | 血管源性水肿(vasogenic) |
|
细胞内水肿(ICF); Na/K泵障碍; BBB一般尚完整 |
细胞外水肿(ECF); 内皮损伤、毛细血管外渗增加; BBB破坏 |
| 原因:缺血/缺氧 | 原因:肿瘤、脓肿等 |
| 累及灰质+白质 | 一般首先累及白质,灰质保留 |
|
常见于:脑梗死; DWI 弥散受限 |
常见于:肿瘤、外伤、脓肿/炎症、脑梗死后期;DWI弥散不受限 |

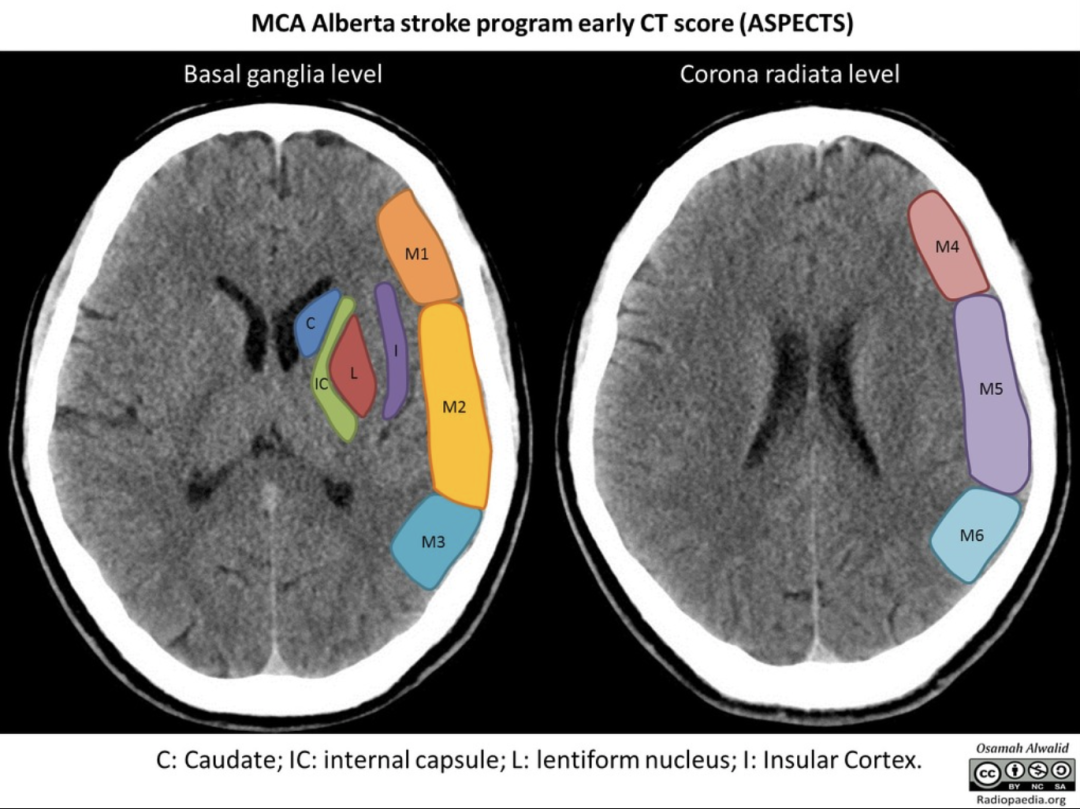
3. ASPECT 评分
阿尔伯塔脑卒中计划早期诊断评分(Alberta Stroke Program Early CT Score,ASPECT),主要针对CT平扫,初衷是对静脉溶栓患者疗效进行评估。评分方法是:选择两个CT层面,给不同供血区域赋予分值,每个区域为1分,如该区域出现病灶,则减1分。
总分共计10份。其中,皮层下结构包括3分,包括尾状核、豆状核及内囊;MCA区结构包括7分,包括岛带、M1~M6区域(见下图)。
MCA-Alberta stroke program early CT score

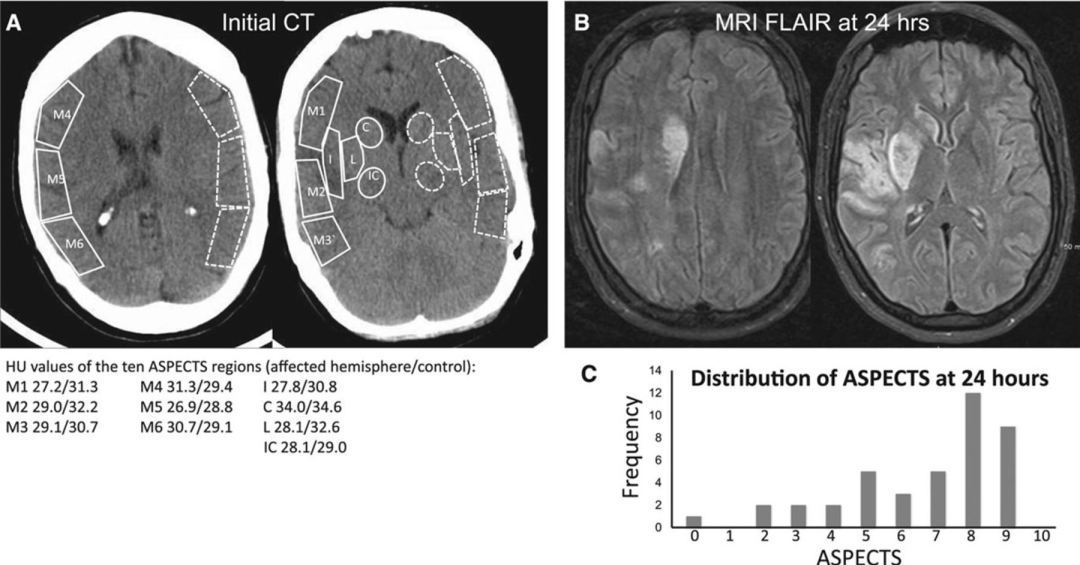
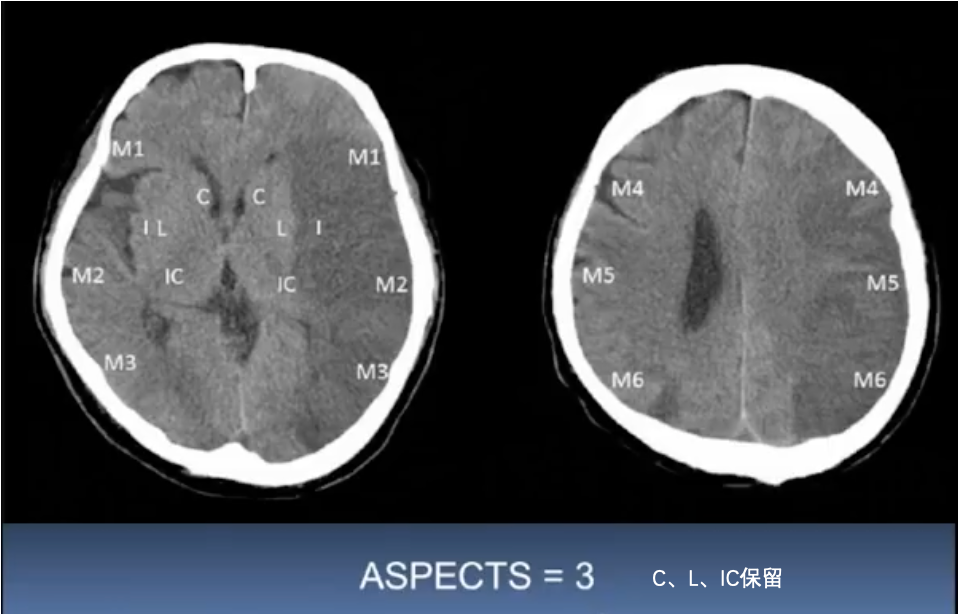
ASPECT与预后:
8-10提示梗死核心区较小,6-7中等,0-5提示大面积梗死。ASPECT评分与临床预后具有良好相关性,ASPECT评分为7分或更低提示预后不良。

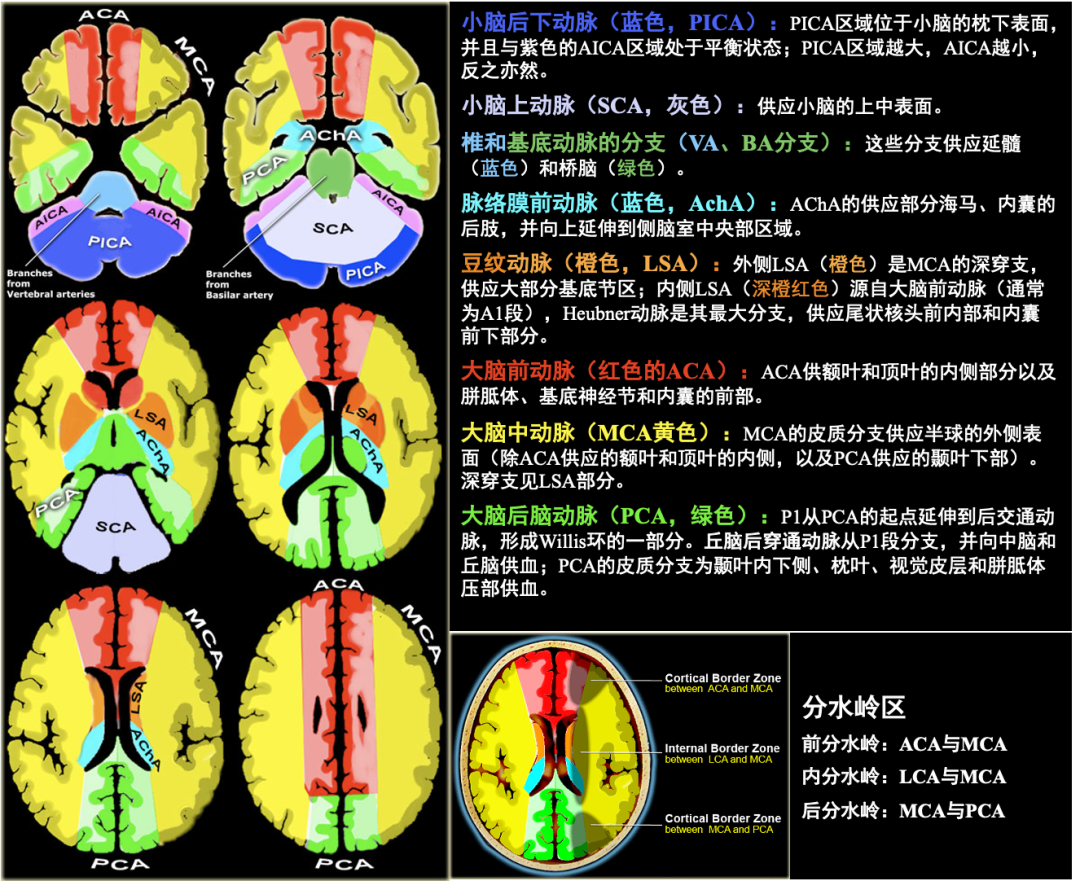
4. 供血区域
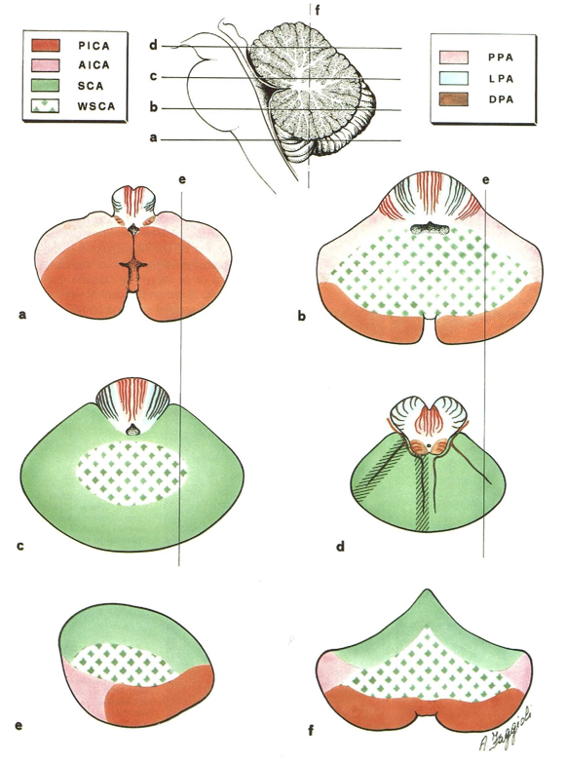
小脑后下动脉(蓝色,PICA):起自椎动脉。PICA 内侧支分布至下蚓部,外侧支供应小脑半球下面的中后部。与位于外侧面的小脑前下动脉(紫色,AICA)供血区域(一般起自基底动脉,供应桥臂、腹侧小脑)处于平衡状态。PICA区域越大,AICA越小,反之亦然。
小脑上动脉(SCA,灰色):常从基底动脉顶端发出,供应小脑的上部和小脑幕表面区域,包括小脑半球上表面、同侧的上蚓部、齿状核大部、小脑中脚上部、小脑上脚及桥脑被盖外侧。
椎和基底动脉的分支(VA、BA分支,蓝色绿色):这些分支供应延髓(蓝色)和桥脑(绿色)。
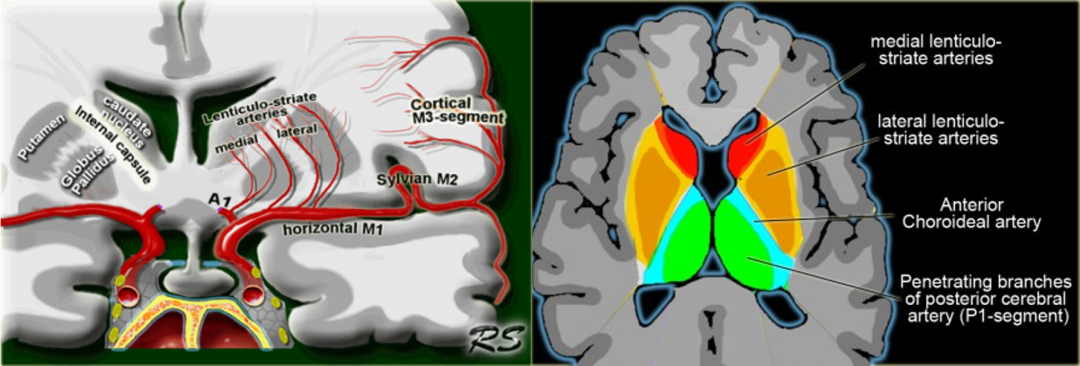
脉络膜前动脉(AchA,亮蓝色):AChA一般起源于ICA、极少起自MCA,供应部分海马、内囊后肢,并向上延伸到侧脑室中央部外侧区域。
近端供应视交叉下面、视束后2/3、灰结节、乳头体、大脑脚中1/3,远端供应海马、海马旁回、钩、杏仁核、齿状回前部、尾状核尾。
豆纹动脉(LSA,橙色):外侧LSA(橙色)是MCA的深穿支,供应大部分基底神经节;内侧LSA(深橙红色)源自大脑前动脉(通常为A1段),Heubner动脉是内侧豆纹动脉中最大分支,供应尾状核头前内部和内囊前下部分。
从大脑中动脉起始处算起,10mm以内称为内侧豆纹动脉,10-20mm范围内发出称为外侧豆纹动脉,供应尾状核头及体(前下部除外)、壳的大部、苍白球外侧部、内囊上3/5、临近的辐射冠及前联合的外侧部。
大脑前动脉(ACA,红色):ACA供额叶和顶叶的内侧部分以及胼胝体、基底神经节和内囊的前部。
交通前段:分出中央支,供应尾状核前部、内囊前肢、纹状体前下部、下丘脑视上区、胼胝体膝、透明隔、穹窿柱等部,另外可代偿部分豆纹动脉.。交通后段:供应额、顶、枕叶的内侧面,以及胼胝体。
大脑中动脉(MCA,黄色):MCA的皮质分支供应半球的外侧表面(除ACA供应的额叶和顶叶内侧,以及PCA供应的颞叶下部)。深穿支见LSA部分。
大脑后脑动脉(PCA,绿色):由基底动脉末端发出,P1从PCA的起点延伸到后交通动脉,形成Willis环的一部分。丘脑后穿通动脉从P1段分支,并向中脑和丘脑供血;PCA的皮质分支供应颞叶、枕叶内侧底面,视觉皮层和胼胝体压部。
模式图
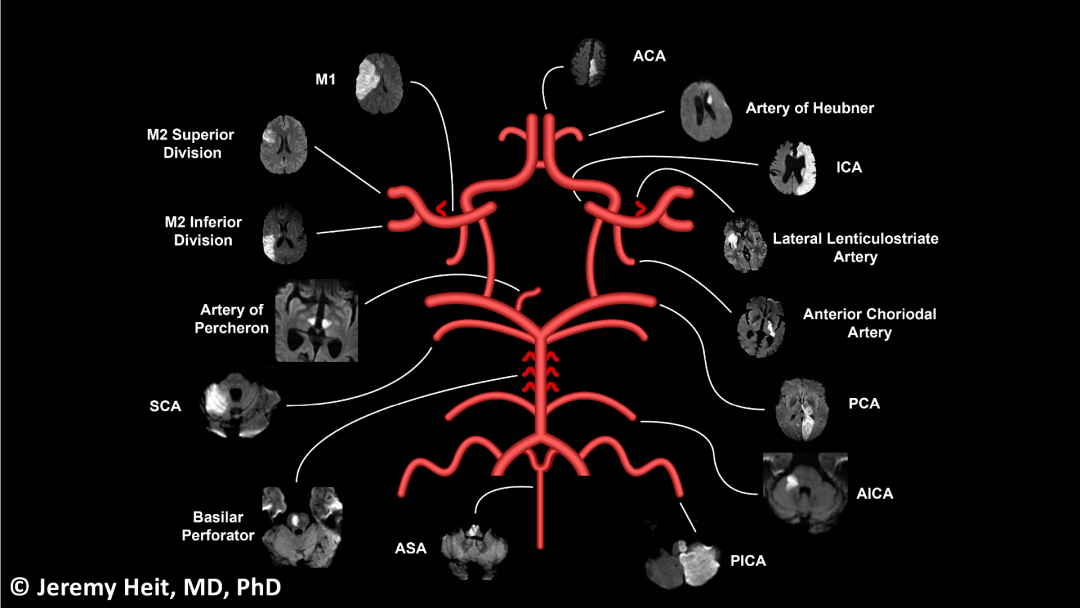
CT图供血区

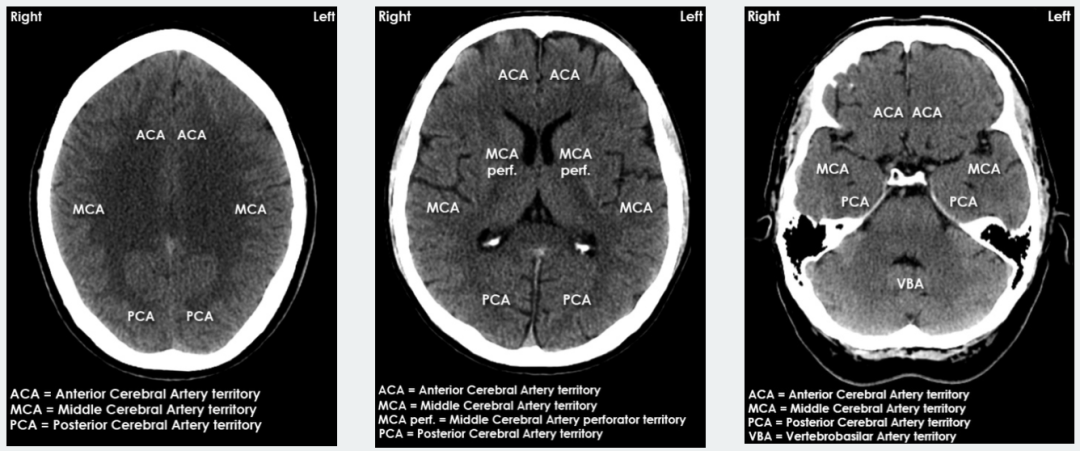
MCA区域梗死:最常见,约占75%。
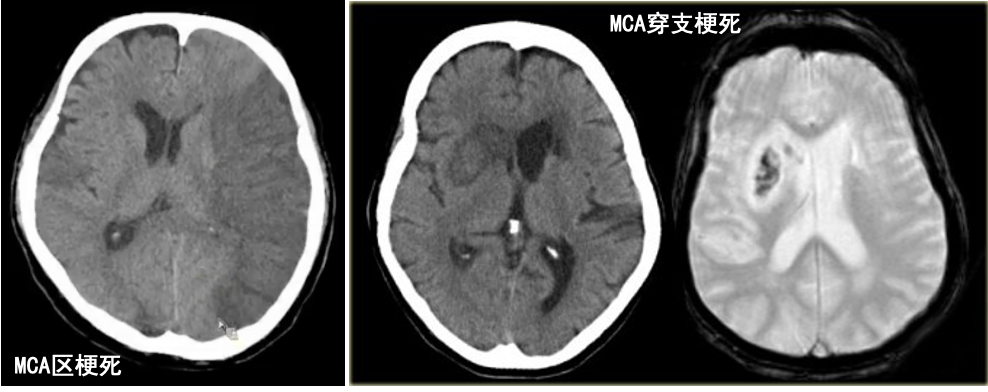
ACA区域梗死:

PCA区域梗死:
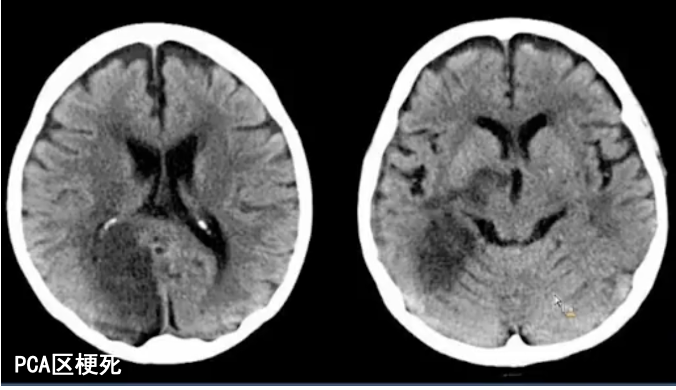
分水岭区域(watershed)梗死:

后循环梗死:

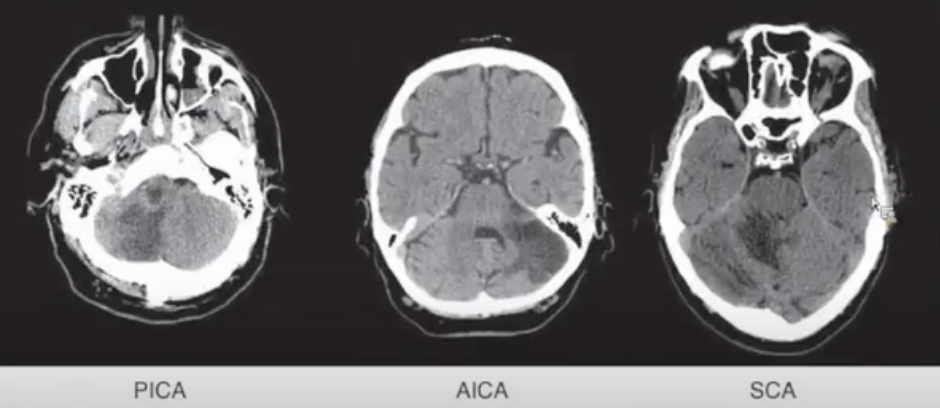
根据累及的供血区域来判断病因:
-
单侧,前循环:常见于颈动脉、ICA斑块。
-
单侧,前后循环同时受累:ICA和胚胎大脑后,10%左右。
-
双侧,前后循环同时受累:心源性。
-
分水岭区:低灌注(血管狭窄)、栓塞。
5. 脑梗死的演变
| 超早期 |
可有脑动脉致密征(MCA、BA),一般在发病30分钟内即可显示,是急性血栓的早期表现,通常提示大面积梗死。 此时,供血区脑组织CT尚未出现明显低密度改变,可有典型的临床症状,如偏瘫、失语等。核磁DWI在缺血数分钟后即可出现信号增高。 CT灌注,脑血流<10ml/(100g*min) 发生不可逆损害。 |
| 发病6h以后 |
脑组织因持续缺血缺氧,导致细胞膜离子泵衰竭而产生细胞毒性脑水肿。此时复查示可发现典型的动脉致密征,同时伴有灰白质界限模糊,表现为“岛带征”、“脑沟裂消失”等。 |
| 1-7天 |
血脑屏障出现破坏,吞噬细胞增多,髓鞘脱失,CT表现为梗死区更低密度,可出现占位效应,甚至出现脑疝。因血脑屏障破坏,此时做增强扫描(不建议),在低密度区内有脑回状或斑片状或团块状强化影。 水肿一般高峰期在3-7天。 |
| 2-3周 | 病灶中心出现坏死,血脑屏障渗透性增加,水肿消退,CT表现为等、低密度混杂,脑回增强,占位减弱。 |
| 4周以后 | 梗死病灶逐渐形成软化灶,呈等于或稍高于脑脊液密度(“中风囊”),脑组织可有萎缩。 |




头核磁的演变:
超急性期和急性期(0-6h,6-24h):
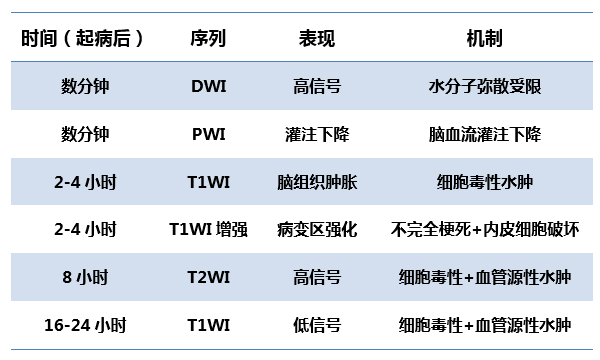
亚急性期(1-7天):水肿继续发展,可有占位效应。T1、T2信号异常越来越明显(T1低、T2高),DWI依旧亮。增强可有强化,皮质梗死强化可以呈脑回状。
7-21天:水肿逐渐减轻,T1(低)、T2(高)信号异常,DWI逐渐恢复(起病7-14天后),增强仍有强化。
慢性期(>1月):梗死区信号接近脑脊液(T1低,T2高,DWI低),可形成囊腔,伴周围的脑室、脑沟、脑池扩大。增强最长可持续3-4个月。
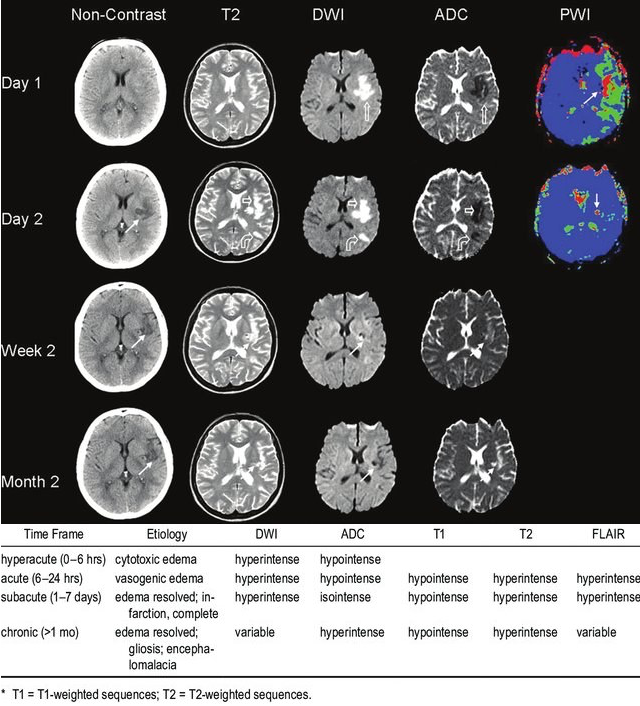
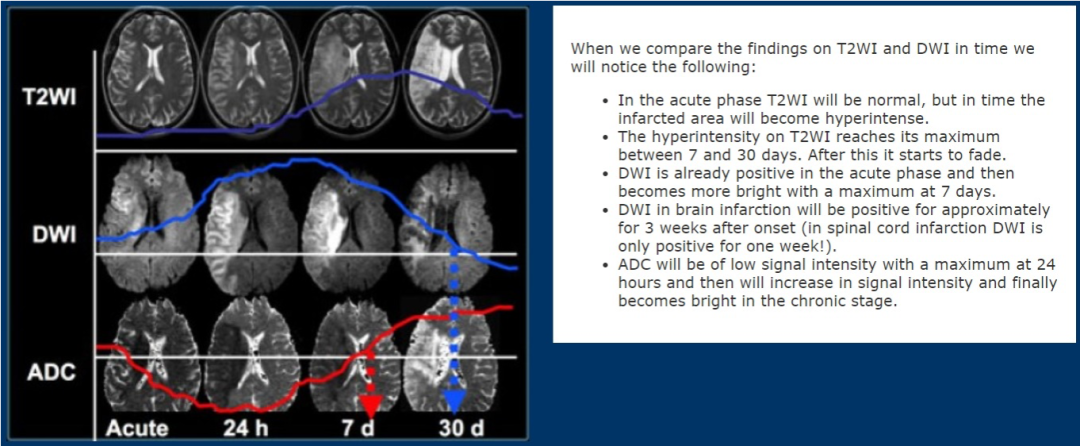
模糊效应(“Fogging Effect”):头CT上病灶表现为等密度,无法显示缺血性卒中病灶,出现假阴性,通常发生在卒中后约10天(2-3周)。
可能的原因为水肿逐渐消退、蛋白及红细胞外渗、新生毛细血管、胶质增生、巨噬细胞吞噬等,导致梗死区域密度增高。

6. 脑梗死的并发症
一、出血转化
出血转化定义为脑梗死后首次头颅CT/MRI未发现出血,再次头颅CT/MRI检查发现颅内出血,或根据首次头颅CT/MRI可以确定的出血性梗死。
-
通常1周内出现(2-14天),4天内多见,6小时内罕见
-
50%概率出现,自发性出血转化发生率为7%~29%;90%点状或点片状(不影响治疗)、10%形成血肿(发生于5%的脑梗死中,按照脑出血治疗)
-
症状性出血(常采用NIHSS增加≥4分)少见(0.3%-3%),tPA治疗者可达6%
-
多见于:心源性、大面积梗死、高龄、tPA溶栓/血管再通或抗凝后、高血糖
-
可能的机制:再灌注损伤(再通、侧枝)、BBB破坏
-
溶栓后出血转化的危险因素:NIHSS>14分、MCA近段闭塞、梗死面积>1/3 MCA供血区、晚期再通(发病后>6h)、侧枝代偿差;通常发生于溶栓后的24小时内
-
鉴别造影剂外渗:造影剂渗出患者病情不加重,无明显水肿及占位效应。4-6h后密度逐渐变淡,19-24h复查CT逐渐恢复脑组织密度。
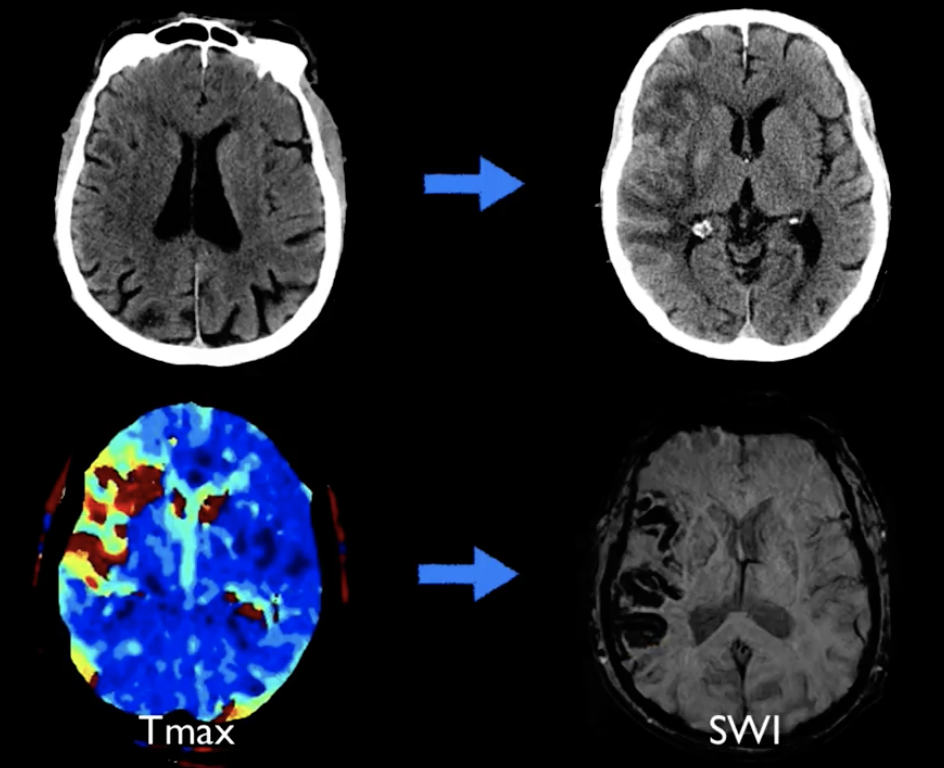

出血转化的诊断流程

症状性ICH(sICH)目前主要有3种定义:
-
SITS-MOST标准:PH导致NIHSS评分增加≥4分或死亡。
-
ECASS标准:脑内任何出血导致NIHSS增加≥4分或死亡。
-
NINDS标准:CT证实颅内出血且与患者临床症状恶化存在时间联系。
影像学分型可采用ECASS分型或Heidelberg分型方法:
-
HI型、无症状性出血转化一般恢复良好,无特殊干预。
-
症状性出血转化及PH2型与不良结局 (残疾和死亡) 相关。

治疗:
-
无症状HI型出血转化一般恢复良好,一般无特殊干预。
-
无症状的血肿型出血转化(PH型),特别是有凝血障碍的患者可以考虑予以纠正凝血障碍的药物治疗。
-
对于HI-1型及HI-2型患者可继续给予抗血小板药物,对于PH-1型(有争议)及 PH-2型患者应停用抗血小板药物。
-
症状性出血转化首先应停用抗栓或溶栓等致出血药物,同时遵循脑出血一般处理原则。溶栓后症状性出血转化必要时可考虑辅助使用逆转凝血功能紊乱的药物,包括冷沉淀、纤维蛋白原、抗纤维蛋白溶解剂(凝血酸或ε-氨基己酸)。抗栓相关症状性出血参考中国脑出血诊治指南关于口服抗凝药物相关脑出血和急性缺血性脑卒中诊治指南的推荐。
-
症状性出血转化及PH2型与不良结局(残疾和死亡)相关。
-
对于症状性出血转化的患者,应评估患者临床情况并权衡利弊,待病情稳定后10 d至数周后开始抗栓治疗。
二、水肿/占位效应
1. 早期为细胞毒性脑水肿(cytotoix cerebral edema)(ATP缺乏、Na+/K+泵障碍导致细胞内Na+升高,Cl-和水分子从细胞外向胞内空间的移动,从而造成细胞肿胀)。单纯细胞毒性水肿则CT无法显示;MRI上的DWI高信号和ADC低信号,T2和Flair不变。
2. 通常合并或快速出现离子性脑水肿(ionic cerebral edema),即因为Na+的浓度梯度,Na+从毛细血管进入脑实质细胞外空间,同时带出Cl-(沿电化学梯度)和水(沿渗透梯度);不同于血管源性水肿,此时BBB尚且完整。此时,离子性水肿患者CT上脑灰白质交界处变得模糊、出现岛带征,脑组织可出现均匀低密度(灰质白质同时受累);MRI上,因为合并细胞毒性水肿,DWI和ADC同细胞毒性水肿,T2和Flair显示为高信号。
3. 血管源性脑水肿(vasogenic cerebral edema)是由于血脑屏障破坏、血浆蛋白质渗漏到细胞外空间,积存于血管周围及细胞间质的结果。静水压和渗透压梯度引起组织水含量增加,从而可能导致严重的脑组织肿胀,最终可引起脑疝。
区分不同的水肿类型
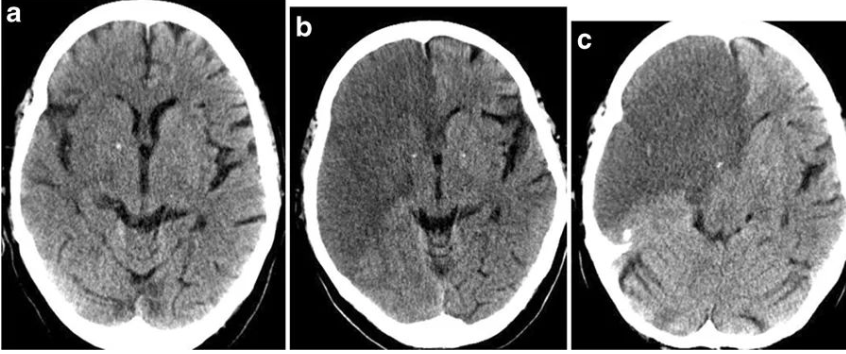
水肿3-7天高峰,水肿严重者常见于大面积脑梗死(恶性大脑中动脉梗死)。

恶性大脑中动脉梗死:大面积梗死定义为CT或DWI影像的ASPECTS评分<6分或梗死体积≥70 ml或梗死面积>1/3大脑中动脉供血区。在卒中发病的6小时内,CT仅显示额叶、岛叶皮质、颞叶、尾状核和豆状核的轻度密度减低(a);12小时后,可见大脑中动脉和大脑前动脉供血区域边界清晰的梗死区域(b),但没有占位效应;24小时后,病灶出现占位效应,中线移位(c)。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言