中国药物临床试验发展面临的机遇与挑战及政策建议
2013-12-08 杨钊,黄 蓝,武志昂 中国新药杂志
药物临床试验是指在志愿者身上( 患者或者健康人) 开展的系统性研究工作,用以证实或揭示试验药物的作用和不良反应,以及吸收、分布、代谢、排泄等过程,评价其安全性和有效性,是新药研发最重要的环节之一。任何一种新药的上市,不管已经过多少体外和动物试验,最终仍需要在人体进行临床试验才能最终确定药物的疗效和安全性。临床试验往往需要经历很长的周期,耗费巨额成本,而成功率缺很低。美国马萨诸塞州特夫兹大学(
药物临床试验是指在志愿者身上( 患者或者健康人) 开展的系统性研究工作,用以证实或揭示试验药物的作用和不良反应,以及吸收、分布、代谢、排泄等过程,评价其安全性和有效性,是新药研发最重要的环节之一。任何一种新药的上市,不管已经过多少体外和动物试验,最终仍需要在人体进行临床试验才能最终确定药物的疗效和安全性。临床试验往往需要经历很长的周期,耗费巨额成本,而成功率缺很低。美国马萨诸塞州特夫兹大学( Tufts University) 药物研究开发中心随机选取 1979 - 1991 年间全球 10 家制药企业 68 种新药研发成本数据进行分析,研究结果显示新药的平均研发费用为 8.02 亿美元( 以 2000 年美元价值计算) ,其中 4.67 亿 ( 以2000 年美元价值计算) 用于临床试验。事实上,进行临床前试验的 5 000 种化合物中只有 5 种能进入到后续的临床试验,而仅其中的 1 种化合物可以得到最终的上市批准。表 1 是 8 家全球排名前20 的跨国制药企业 1997 - 2011 年产品研发投入统计,从中可以看出,每种成功上市的药品平均的研发费用达到了数 10 亿美元,而其中临床试验环节的费用占到约 60%。
近十几年来,从药物发现、研究到获得管理当局批准上市的时间不断延长,投入的资金量不断增加。为了提高药物研发的质量和效率,跨国公司纷纷开始研究药物研发的新策略,力求从时间和资金上减少投入。其中,采用药物的全球性同步开发是提高药物研发效率的重要方式之一。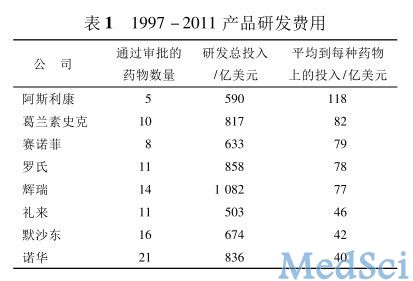
1. 行业发展趋势
随着全球化趋势的发展以及欧美临床试验费用的不断攀升加之发展中国家日益庞大的药品消费市场,跨国制药巨头们纷纷将目光瞄准新兴的发展中国家。根据 2005 - 2011 年间 Clinical Trials 数据库新增的注册临床试验数量( 表 2) 计算得出各地区临床试验平均年增长率( 表 3) ,从中可以看出亚洲特别是中国的增长趋势远远超过其他地区。
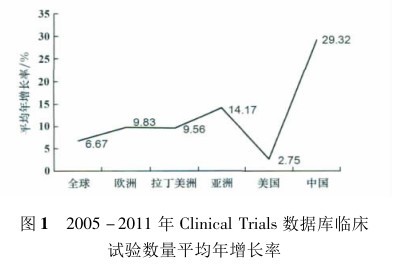
事实上,作为发展中国家的佼佼者,中国确实具有其他国家无可比拟的优势。
① 庞大的人口基数。中国拥有全球 1 /5 的人口,这就意味着拥有充足的受试者来源和广阔的疾病谱。② 优秀的研究者。截至2012 年 1 月份,全国举办医学门类专业的普通高等本科院校有 280 余所,高等职业院校 350 余所,仅 2010 年全国就有5762 名医学博士和 29820 名医学硕士毕业。③廉价的研究成本。无论从研究者的观察劳务费、受试者补偿还是检查治疗费用,中国的试验成本都远远低于西方国家甚至某些亚洲国家。有数据显示: 中国Ⅰ期临床试验的成本约为西方国家的15% ,Ⅱ期临床试验的成本约为西方国家的20%; 检查费用方面,在中国的成本仅为西方国家的 10% ~ 30%。
2009 年 A.T.Kearney( 科尔尼咨询管理) 公司根据病源、成本效益、监管体系、研究者素质、基础设施建设及社会环境 6 个因素综合评价各国临床试验选址的吸引指数,如图 2 所示,我国的综合得分是6.10,仅次于美国的 6.88。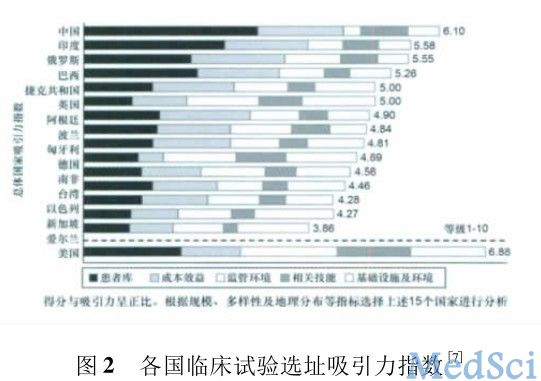
基于以上因素,中国正逐渐成为全球最重要的临床试验基地。来自药品审评中心( CDE) 的数据显示( 图 3) ,2005 年之前,制药外企在选择中国开展国际多中心临床试验方面,基本处于尝试阶段,2005 - 2011 年中国开展的临床研究数量较之前呈显著上升趋势。表 3 是制药外企在华的研发投资情况,从中亦可见制药外企正逐步将研发的重心转向中国。

2. 我国面临的机遇和挑战
全球医药行业研发,特别是临床试验环节的重心正逐步向亚洲发展中国家转移。变革将带来机遇也将带来挑战,作为全球人口数量最多的第二大经济体,我国怎样抓住机遇,应对挑战,对整个医药行业的发展至关重要。
2.1 机遇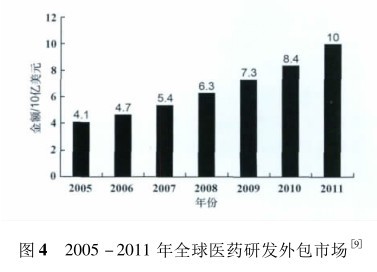
2003-2012 年,全球已有包括立普妥( 阿托伐他汀) 在内的 187 种药品专利到期,未来的 5 年内( 2013-2017 年) ,全球还将有 94 种药品专利到期。由此带来的销售损失将达上千亿美元。迫于销售收入减少和研发成本攀升的双重压力,将研发环节外包至成本低廉的发展中国家已成为众多制药巨头的重要战略。
如图 4 所示,我国面对的是一个价值上百亿美元的庞大市场。由此带来的效益对参与其中的各方具有积极的促进作用。
首先是制药行业。制药外企在中国开展国际多中心试验( MCT) 所获得的中国人的数据能更科学、准确地评价药品对于中国人的安全性和有效性,从而加快药品在中国的上市时间。据不完全统计,在现行法规环境下,利用国际多中心Ⅲ期临床试验中的中国人的数据进行注册,与 3.1 类传统注册策略相比,至少可以使药品在中国上市的时间提前 3 ~ 4年,能有效减少研发资源的浪费。
目前国内制药业已经涌现出许多具有强大发展潜力的创新型企业,这些企业和研究机构在数年内有能力研制出真正意义上的全新化合物。但在目前情况下,这样的研发成果却需要到欧美进行临床试验,相关数据和研究资料才能被国际承认和接受。这意味着对国内企业而言,不得不进行两次临床试验,其成本和时间代价将使得中国的创新药物严重缺乏竞争力。
其次是科研单位。开展国际多中心项目能够开阔研究者的视野,了解国际医药研究的前沿和最新的研究成果,加强医疗领域的国际合作,在提高本机构的研究能力的同时也提高了学科在国内外的地位和影响力。让更多的患者尽早进入临床试验,参与到每个临床试验阶段,由此收集到的数据代表着全球人口的特征,非常具有科学价值。
总而言之,活跃的高水平的临床试验产业将给一国带来新的药品、新技术、新治疗方法,不仅是可见的硬件设施改善,对医疗水平的提高、资金的流入、人才的培养等等,都是无形的财富和资产。
第三是国民。制药外企在中国开展国际多中心项目有助于加快新药在中国的上市进程,从而使中国的患者和国外患者一样,尽早享受到最先进的治疗。
第四是监管部门。在中国发展高水平的临床研究体系,对于国内药品监管大有裨益,国家食品药品监督管理局( SFDA) 在审评和管理国际多中心试验过程中将接触规范化、全球一体化的监管理念,了解制药企业的诉求,更快推动中国药物临床试验与国际规则顺利对接并互相承认,将使得中国企业在中国的临床试验数据就能被国际通行接受。
2.2 挑战
我国的临床试验事业仍处在起步阶段,和欧美等发达国家相比,无论是数量还是质量上,均存在较大的差距。根据表 2 数据计算,我国从 2005 - 2011年在 Clinical Trials 网站上注册的临床试验平均数量仅为全球注册数量的 2. 38% ; 来自 CMR 的 GlobalClinical Trial update 的统计数据显示,2000 - 2006年,从全球患者的贡献程度来看,在全球开展的所有临床试验中,美国占绝对优势,达到 41% ,德国 7% ,法国 4% ,英国 4% ,印度不足 0. 5% ,中国占的比例不足 1% ,全球排名大概在 25 或 26 位。未来,我国临床试验发展所面临的挑战将主要集中在以下几方面。
2.2.1 临床试验审批制度
我国临床试验监管制度的适用性是广泛争议的焦点之一,目前我国对临床试验则实行严格的批准制,即要求申请者必须经SFDA 批准,获得《药物临床试验批件》后方可开展临床试验。整个审批流程涉及省级药品监管部门、省( 自治区、直辖市) 药品检验所、CDE、中国药品生物制品检定所、SFDA 等多个部门( 如图 5 所示) 。而包括美国在内的许多国家对 IND 实行较为宽松的审批制度———备案制,例如美国食品药品监督管理局( FDA) 收到临床研究申请( IND) 之日起 30 个自然日内,申报者如未收到 FDA 异议通知,即可开展新药试验。据统计,我国新药临床研究申请( IND) 的审批时间平均达 6 ~ 9 个月,远超其他国家( 如表 4 所示) 。
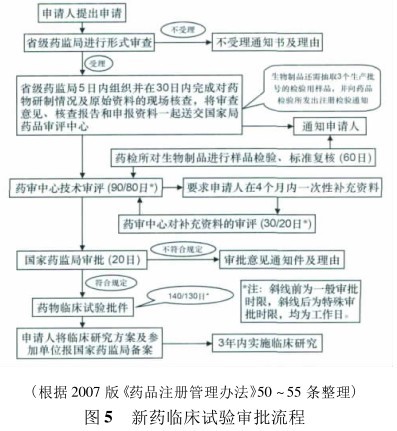
除了审批时限,在 IND 申请资料方面我国也与国外普遍做法有所差异。例如,我国要求药学研究资料(chemistry,manufacturing,control,CMC) 必须在Ⅰ期临床前全部提交,并要求在 4 个月内一次性补齐。这与国外 CMC 资料随着研究计划的开展、研究范围的扩大以及可获得信息量的增加而逐步提交的通行做法存在较大差异,例如,FDA 要求 IND所提交的数据取决于试验的阶段、药物的新颖性、风险的掌控程度以及已有研究的程度,对 CMC 资料审查侧重于是否会给受试者带来不 合 理 的 潜 在 风险。此外,在沟通互动方面,我国要求由申请者提出的沟通会议申请需参照“特殊审批程序沟通交流”相关要求,提交拟讨论问题和相应研究资料,并由 CDE 审核是否同意召开会议和会议拟讨论问题、双方参加会议人员需求等; FDA 则鼓励申请者尽早针对用于支持人体临床试验的 临 床 前 数 据 与CDER 审评专家进行沟通,例如:FDA 按照紧急性和重要性来划分将沟通会议划分为 A,B,C 三类: A 类要求在 30 d 内解决,B 类要求在 60 d 内解决,C 类要求在 75 d 内解决; 其中 B 类会议包括临床前讨论会( pre-IND meeting) ,Ⅰ期试验结束时的讨论会,Ⅱ期结束Ⅲ开始前的讨论会,及新药上市前的讨论会。申办方会前列出需要 FDA 回答的问题,CDER 会审阅问题的水平与质量与申请资料的完备性,如果问题质量较高,申请资料完备,会在会议之前有对所有问题进行书面答复,会上只讨论有争议的问题,总而言之,在沟通互动方面,我国 SFDA 完全处于主导地位,而美国 FDA 与申办方处于较为平等的地位。另外,专业审评人员的不足也是阻碍 IND 审批的一大原因,据统计,目前我国 CDE 共有在编人员110 名左右,其中审评人员 55 名; 截至 2012 年,FDA 共有员工 13 496 名,其中药品评价与研究中心( CDER) 共有在编人员 3 281 名,其中核心审评人员( key officials) 就高达 500 多名。
2.2.2 亚洲其他国家、地区的竞争
除了国内监管制度的制约,我国还要面对亚洲其他国家、地区的强有力竞争,比如日本、韩国、新加坡和台湾地区,这些国家和地区凭借雄厚的科研实力以及较为开放的政策,已经在国际临床试验领域占得先机( 如表 5 所示) ; 而其他一些发展中国家也同样在临床试验领域快速崛起,比如印度,同样拥有可观病源和低廉成本优势,同时正在不断完善监管制度,日趋与国际接轨,就是其中最有力的竞争者之一。
印度在 2006 年底开始简化审批流程,将申请的临床试验划分为 A,B 两类审批通道,前者接受来自美国、英国、瑞士、澳大利亚、加拿大、德国、南非、日本及 EMA 中任何一个机构批准的临床研究申请,可在 4 周内获得批准; 而后者接受全球其他国家申请的临床试验,需 16 周。另外,印度的官方语言为英语,有利于研究者、监管者与申办方进行沟通及数据资料的申报。
3. 建议
3.1对审评指导思想的建议
我国制药产业由于历史发展原因,长期以仿制药为主,然而随着国际药物研发产业的转移及自身行业发展的转型,未来将有更多的创新药物在我国开展临床研究。对不同类型的药物采取不同的审批制度应是以后的指导思想。
在仿制药领域: 由于目前审评力量较为短缺,无法在海量临床试验的全程监管中集中足够的政府力量,需要明确继承 SFDA 之前一贯的“严进严出”监管原则,同时进一步明确参与临床试验各方的责任和义务,细化仿制药临床试验审评量化细则。这也是 FDA 和 EMA 在仿制药领域监管的有效办法。在创新药领域: 应尝试逐步建立类似于 FDA 和EMA 的监管和沟通体系,在注重临床试验安全性和过程监管的同时,将审评机构与申办方和研究者的充分沟通前置,提倡管制机构审评人员的早期介入,在安全监管体系下鼓励政企互动。根据创新的类别和级别制定适宜的沟通机制,同时明确、细化各方责任和风险控制计划。
3.2 对 CDE 建设的建议
从产业需求和现有资源来看,我国的药品审评资源仍处在匮乏状态,目前的审批人员数量有限,但审批申请过多,据统计,截至 2012 年 4 月,CDE 共有审评员资格人员 55 名,而 2011 年受理药品新注册申请达 3 620 件,药物临床试验申请达 1 456 件,审批人员有限的精力被很多无效的申请虚耗了。重视 CDE 的建设和发展,按照中长期发展需要,扩大CDE 专业审评队伍的编制,增加相关预算应是未来药品监管的一大任务。建议发挥经济杠杆作用,参考 FDA《处方药申报者付费法案》( PDUFA) ,增加评审费用,专款专用,用于扩编审批人员队伍。在扩增审评力量的同时,应根据申报类型将仿制药和创新药、IND 和 NDA 的审评队伍及审评流程分离,以达到“术业有专攻”的目的。
3.3 关于审批政策的建议
目前我国采用严格的审批制,整体审批时间远超其他国家,有必要对此制度是否符合我国国情及未来制药行业发展做出科学的评价,以期缩短审批时间; 此外,我国仅允许已在境外注册的药品或者已进入 II 期或 III 期临床试验的药物,在一定程度上不利于临床试验研究者培养积累 I 期临床试验的经验,这不利于中国药物创新能力的全面培养; 另外,针对 IND 资料,建议将临床试验申请( IND) 和新药上市申请( NDA) 资料要求区别对待,设立不同标准。IND 只提供关于毒理药理、药学和生产工艺的综述性资料,减少详细技术资料的要求。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#政策#
49
#药物临床试验#
36