JCI帕金森病新靶点:钾通道调节神经炎症和神经退行性病变
2023-02-20 brainnew神内神外 brainnew神内神外 发表于安徽省
PD是一种复杂的神经退行性疾病,其主要特征是大脑黑质致密部(SNpc)区域中的多巴胺能神经元丧失。PD的主要病理标志之一是α-突触核蛋白聚集(αSynAgg)。

2020年6月,美国爱荷华州艾姆斯市爱荷华州立大学生物医学系帕金森病研究实验室Anumantha G. Kanthasamy团队在The Journal of Clinical Investigation发表论文Kv1.3 modulates neuroinflammation andneurodegeneration in Parkinson's disease,发现Kv1.3通道在帕金森病(PD)的神经炎症反应中起着不可或缺的作用,可能是PD的潜在治疗靶点。
1研究背景
PD是一种复杂的神经退行性疾病,其主要特征是大脑黑质致密部(SNpc)区域中的多巴胺能神经元丧失。PD的主要病理标志之一是α-突触核蛋白聚集(αSynAgg)。
Kv1.3广泛表达于T细胞、B细胞、巨噬细胞、视网膜神经节细胞、小胶质细胞和神经元中。最近的研究显示,Kv1.3在小胶质细胞介导的神经元细胞死亡和炎症因子的产生起到重要作用。Kv1.3包含多个富含脯氨酸的序列,可以与Src同源(SH)域结合。同时该课题组之前的研究发现Src激酶家族中的Fyn在PD模型以及人类PD患者的黑质组织表达上调,并在小胶质细胞炎症中起重要作用。因此,作者假设Fyn和Kv1.3相互作用以增强神经炎症反应,从而调节PD中的神经退行性变性。
2关键结果
作者发现在体外小胶质细胞中加入αSynAgg后Kv1.3的表达上调。全细胞膜片钳揭示,αSynAgg增加了Kv1.3通道活性。qRT-PCR分析表明,与其它钾通道(如KCa3.1,Kv1.1或Kv1.5)相比,αSynAgg最能诱导Kv1.3mRNA表达上升。同样,通过Western blot和免疫组化染色同样发现Kv1.3蛋白水平也有所提高。流式细胞分析表明,αSynAgg增加了初级小胶质细胞(PMC)中Kv1.3的表面表达。
随后,作者发现PD患者的B细胞以及用αSyn-Agg处理的离体脑切片中,Kv1.3的表达上调。由于PD是一种多因素疾病,迄今为止,没有体内模型能够重现PD的所有症状。因此,为了更好地了解Kv1.3的潜在作用,作者使用了三种不同的PD模型鼠进行试验。结果发现三种PD鼠中Kv1.3的表达均明显高于正常鼠。
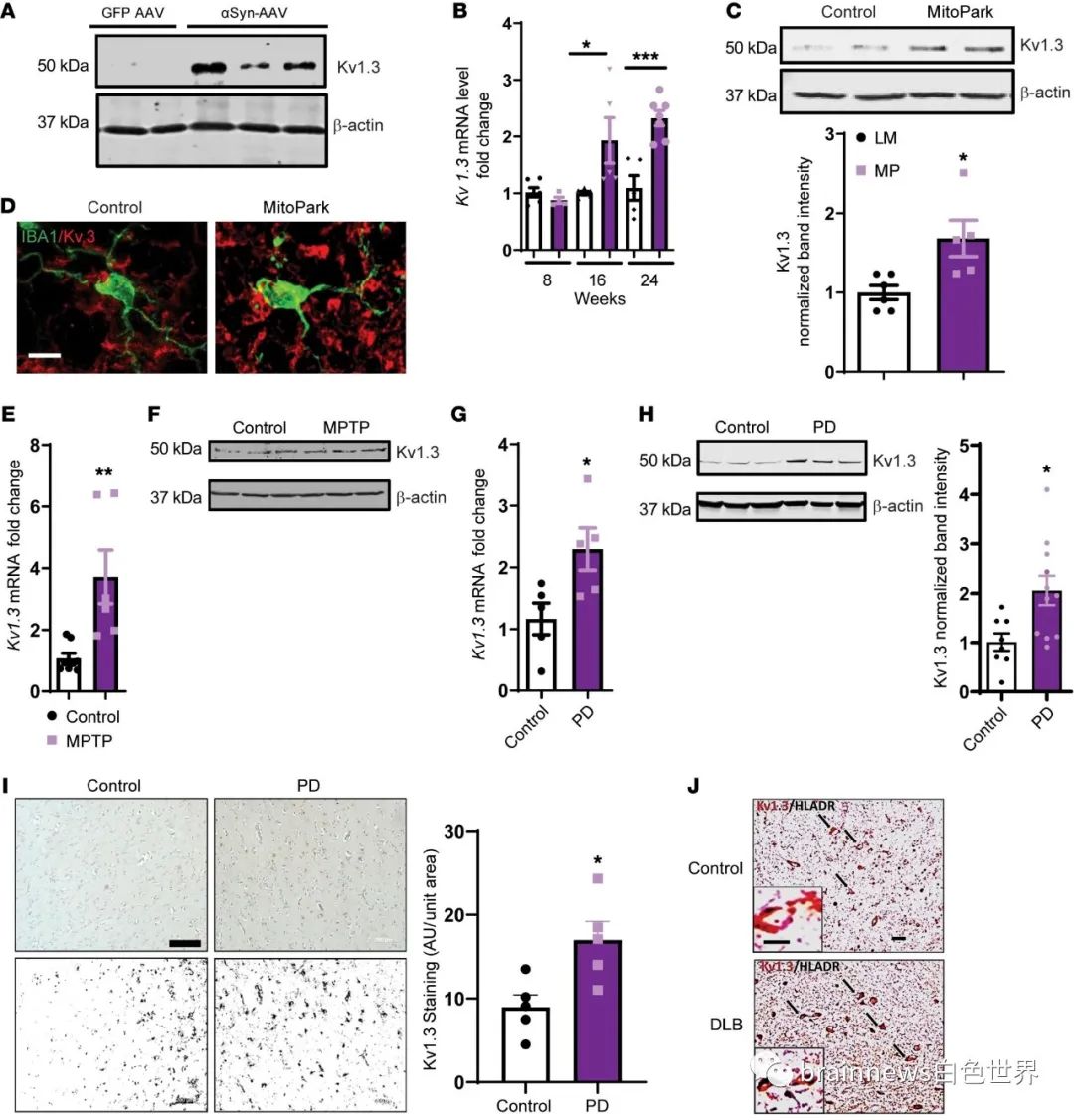 图1:Kv1.3在PD模型和死后PD患者大脑的小胶质细胞中特异性高表达
图1:Kv1.3在PD模型和死后PD患者大脑的小胶质细胞中特异性高表达
然后作者研究了Kv1.3基因转录上调背后的分子机制:Fyn通过Fyn /PKCδ激酶信号级联反应调节小胶质细胞中Kv1.3的转录调控。作者早前的研究发现炎症发生会激活Src家族激酶Fyn,Fyn调节小胶质细胞中的p38 MAPK和NF-κB通路,并且Fyn也可以通过磷酸化PKCδ调节小胶质细胞。在本研究中,作者证明了p38MAPK和经典的NF-κB通路均介导Kv1.3的转录调控。此外,Fyn/PKCδ炎症途径是Kv1.3转录和响应炎症刺激的主要调节因子。αSynAgg可以调节Kv1.3的磷酸化,并且Fyn激酶在此αSynAgg诱导的Kv1.3磷酸化中起重要作用。
随后作者通过膜细胞膜片钳技术和免疫共沉淀,发现了Fyn调节Kv1.3的翻译后修饰,Fyn直接将PD模型中Kv1.3 135位点的酪氨酸磷酸化。对PD患者和年龄匹配的对照大脑的Western blot分析也显示Kv1.3的磷酸化水平增加。 Fyn和Kv1.3的免疫沉淀显示在αSynAgg处理后Fyn与Kv1.3直接相互作用。Fyn WT和KO PMC的Western blot显示,Kv1.3在135位点的酪氨酸的磷酸化是由Fyn介导的,saracatinib对Fyn的药理抑制作用降低了Kv1.3磷酸化。

图2:Fyn通过Fyn/PKCδ激酶信号级联调节小胶质细胞Kv1.3的转录调控
进一步作者在离体的PD细胞模型中证实Kv1.3调节PD模型中的神经炎症。与野生型PMC相比,Kv1.3-KO小鼠的PMC分泌的TNF-α、IL-12和IL-1β少得多。qRT-PCR分析表明,Kv1.3过表达显着增加了αSynAgg诱导的Nos2,pro-IL-1β和Tnf-α的mRNA水平。在αSynAgg处理后,Kv1.3过表达显着诱导IL-6和IL-12的分泌。这些数据共同表明,Kv 1.3在αSynAgg诱导的小胶质细胞炎症中起重要作用。接下来作者用Kv1.3特异性抑制剂PAP-1作用小胶质细胞,发现PAP-1减少了PD的神经炎症和神经退行性变。
最后,作者通过αSynPFF小鼠模型进一步证明了Kv1.3作为PD潜在的治疗靶点。抑制Kv1.3可防止αSynPFF诱导的行为缺陷和多巴胺能神经元丢失。
3总结与展望
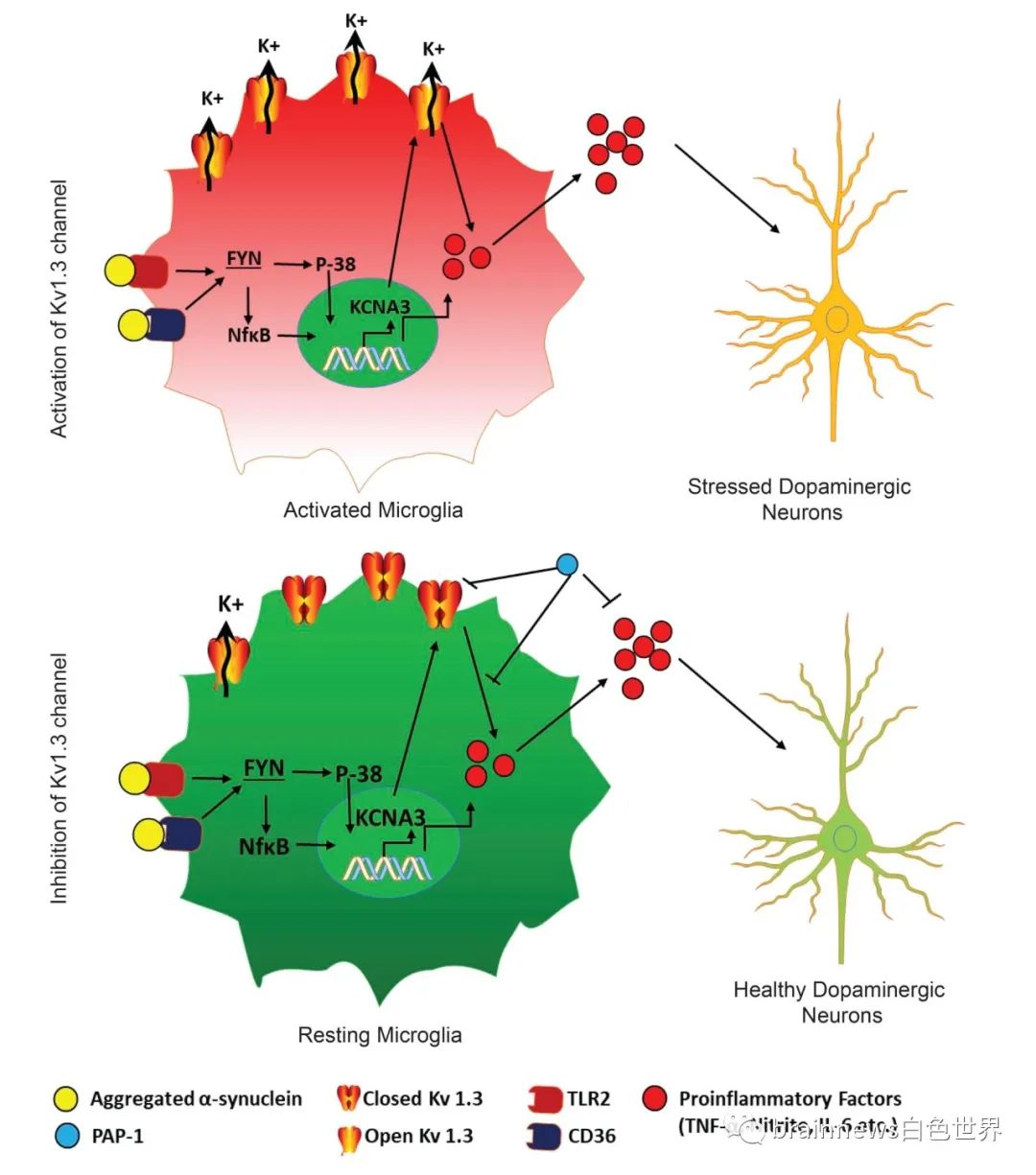 作者证明Kv1.3在PD型中被上调,并通过NF-κB和p38 MAPK途径受到Fyn /PKCδ激酶级联信号的近端控制。Fyn可以进一步磷酸化Kv1.3,从而调节Kv1.3通道的活性。PD模型中的Kv1.3上调在神经炎症介导的神经退行性变性中起主要作用。这些发现进一步证明了Kv1.3介导的信号级联反应可以调节帕金森病中的小胶质细胞炎症。作者在3种不同的PD动物模型(包括MitoPark转基因,MPTP和αSynPFF小鼠模型)中对Kv1.3阻滞剂PAP-1进行了全面的临床前评估,为Kv1.3调节剂在治疗PD药物开发提供重要的依据。
作者证明Kv1.3在PD型中被上调,并通过NF-κB和p38 MAPK途径受到Fyn /PKCδ激酶级联信号的近端控制。Fyn可以进一步磷酸化Kv1.3,从而调节Kv1.3通道的活性。PD模型中的Kv1.3上调在神经炎症介导的神经退行性变性中起主要作用。这些发现进一步证明了Kv1.3介导的信号级联反应可以调节帕金森病中的小胶质细胞炎症。作者在3种不同的PD动物模型(包括MitoPark转基因,MPTP和αSynPFF小鼠模型)中对Kv1.3阻滞剂PAP-1进行了全面的临床前评估,为Kv1.3调节剂在治疗PD药物开发提供重要的依据。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言