STM:先剪切,再粘贴,无需骨髓移植,CRISPR基因编辑为免疫系统遗传病带来全新疗法
2022-10-29 nagashi “生物世界”公众号
研究利用CRISPR-Cas系统的“剪切”和“粘贴”功能,针对CTLA-4功能不全的患者来源细胞系和小鼠模型进行缺陷基因修复,使其T细胞中的CTLA-4恢复到正常水平。
长久以来,遗传疾病的治疗一直是困扰人类的难题。无论是生活中较为常见的红绿色盲,还是困扰欧洲皇室几个世纪的血友病,这些因遗传缺陷而导致的疾病不仅对患者的生活造成影响,还严重威胁着患者的生命安全。
基因组学的兴起使人类得知遗传病的本质——源于基因本身的突变。因此,如果我们能够修正这些基因突变,使其还原为成正确的形式,就可以从根本上彻底治愈人类遗传病。近年来,CRISPR基因编技术的出现和快速发展,为治愈人类遗传病带来了前所未有的工具。
2022年10月26日,伦敦大学学院的研究人员在 Science 子刊 Science Translational Medicine 上发表了题为:Therapeutic gene editing of T cells to correct CTLA-4 insufficiency 的研究论文。
该研究利用CRISPR-Cas系统的“剪切”和“粘贴”功能,针对CTLA-4功能不全的患者来源细胞系和小鼠模型进行缺陷基因修复,使其T细胞中的CTLA-4恢复到正常水平,为天生患有免疫遗传病的人带来新的希望。

CTLA-4是T细胞产生的一种重要的负性免疫调节因子,有助于控制免疫系统的活性。正常人体内携带两个CTLA-4的有效基因拷贝,而那些只有一个功能拷贝的人产生的这种蛋白质太少,不足以充分调节免疫系统,导致复发感染、严重的自身免疫疾病,甚至是淋巴瘤。
目前,CTLA-4功能不全的标准治疗方法是骨髓移植,但移植是有风险的,不但需要大剂量的化疗和长时间住院,而且可能发生移植物衰竭和免疫排斥等。此外,CTLA-4功能不全的老年患者通常不能耐受移植手术,因此需要开发更安全的治疗方法。
在这项最新研究中,研究团队利用CRISPR/Cas9基因编辑技术来定位并“剪切”有缺陷的CTLA-4基因。然后,研究人员使用腺相关病毒载体(AAV6)递送修正过的CTLA-4 的cDNA序列,通过同源重组修复(HDR)的细胞DNA修复机制将其“粘贴”到特定位置。

用CRISPR-Cas9靶向CTLA-4突变位点并将其修复
这使得研究人员能够保存CTLA-4基因中的重要序列,即内含子,使其仅在需要时被细胞打开或关闭。值得一提的是,在控制免疫反应中起关键作用的基因并不是一直处于激活状态,而是受到非常严格的调控。研究团队使用的技术不仅保留了控制基因表达的内源性机制的完整性,同时也纠正基因本身的错误。
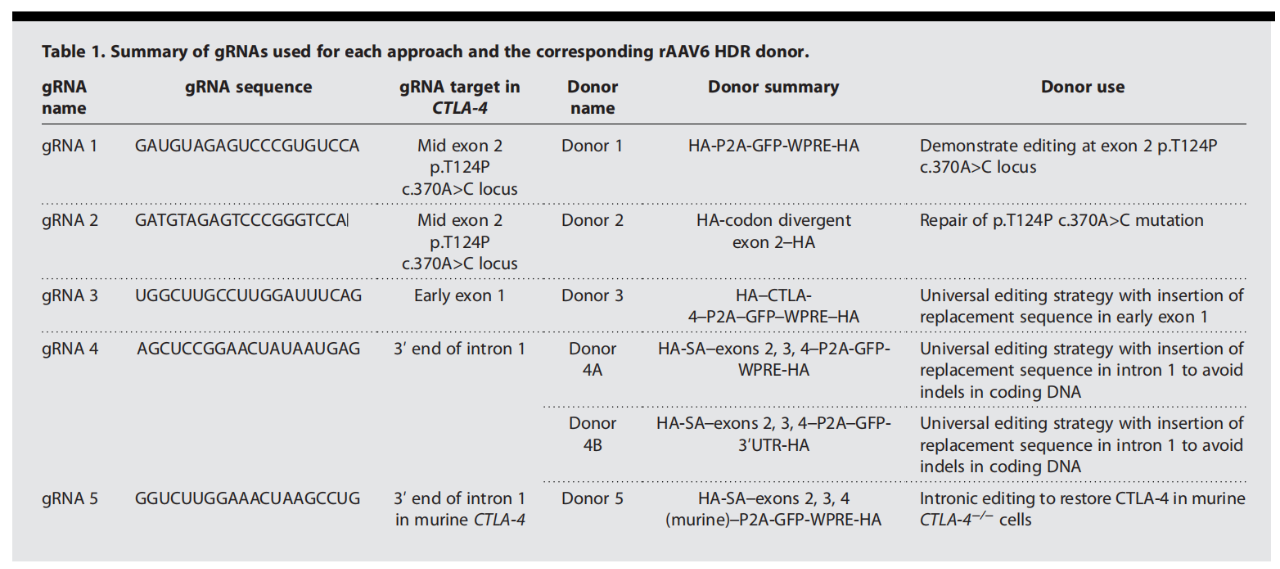
每种方法中使用的gRNAs和相应的rAAV6 HDR供体的总结
令人兴奋的是,这种治疗方案成功修复了从三名CTLA-4功能不全患者分离的T细胞的基因突变,恢复了CD4+ T细胞表面CTLA-4的表达和功能,并挽救了体外CD80和CD86的转内吞作用。

基因编辑恢复CTLA-4功能不全患者CD4+ T细胞表面CTLA-4的表达和功能
不仅如此,在CTLA-4基因敲除小鼠模型中,CTLA-4功能不全的临床症状在治疗后也得到了明显的改善,实现细胞的定植和预防淋巴细胞增殖。这些结果证明了使用T细胞基因疗法治疗CTLA-4功能不全的可行性。

通过CTLA-4基因敲除小鼠模型评估T细胞基因疗法治疗CTLA-4功能不全的可行性
该研究的通讯作者 Claire Booth 教授表示:该治疗技术通过直接纠正患者的T细胞,可以改善CTLA-4功能不全的许多临床症状,同时也比骨髓移植的毒性小且更简单。此外,这种纠正基因突变的方法也可以适用于其他遗传疾病。
总而言之,这项研究报道了一种可以广泛应用于人类遗传病治疗的基因编辑技术,并成功在患者来源细胞系和小鼠模型中纠正CTLA-4功能不全导致的免疫缺陷,为免疫遗传病乃至其他人类遗传病的治疗开辟了新的道路。
原始出处:
Therapeutic gene editing of T cells to correct CTLA-4 insufficiency. Science Translational Medicine, 2022.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













