100%编辑效率!张锋创立的Editas 体内基因编辑疗法公布临床前数据
2022-10-17 网络 网络
2022年10月13日,Editas Medicine公布了其体内基因编辑疗法EDIT-103用于治疗视紫红质(RHO)介导的常染色体显性视网膜色素变性(RHO-adRP)的临床前数据。
2022年10月13日,Editas Medicine公布了其体内基因编辑疗法EDIT-103用于治疗视紫红质(RHO)介导的常染色体显性视网膜色素变性(RHO-adRP)的临床前数据。

RHO-adRP是一种罕见单基因孤儿病,其特征是进行性和严重的视力丧失导致失明。大约30%的adRP是由RHO基因突变引起的。研究已表明,RHO中超过150种突变会引起adRP,由于突变RHO能产生对感光细胞有害的蛋白质,因此研究人员已经确定最佳策略是消除突变蛋白。目前还没有获批疗法来治疗这种遗传性视网膜孤儿病。
EDIT-103是一种不依赖于突变的基于CRISPR/Cas9的基因编辑疗法,使用双AAV5载体递送来敲除和替换(KO&R)视紫红质基因中的突变以保持感光器功能,可通过视网膜下注射给药。该疗法有望解决150多种可导致RHO adRP病的RHO功能获得型的突变,而此次公布的数据证实了其在治愈RHO-adRP疾病的潜力。
数据显示,在人类视网膜体外移植物上,EDIT-103表现出了高度特异性的编辑效率,转导后没有观察到脱靶编辑;
在mRhohRHO/+小鼠模型中,EDIT-103实现了快速的基因编辑,在第6周时就达到最高水平并到研究结束(第13周)一直保持稳定的编辑水平;
此外,在非人类灵长动物中,EDIT-103显示出近100% 的敲除内源性RHO的能力。在视网膜下注射的治疗区域,其替代RHO基因产生的蛋白质水平达到正常RHO基因产生蛋白质的30%以上;并且与只注射KO(敲除)的对照组眼相比,在注射了EDIT-103药物 (敲除加修复)的眼睛中,在外段显示出恢复了RHO蛋白表达以及正常感光器结构和功能的保留。
值得一提的是,作为一家领先的基因组编辑公司,Editas的布局并不局限于体内编辑疗法的开发,其基于该公司CRISPR编辑平台已在体内基因编辑疗法、体外基因编辑疗法和细胞治疗建立了一系列的研发管线。
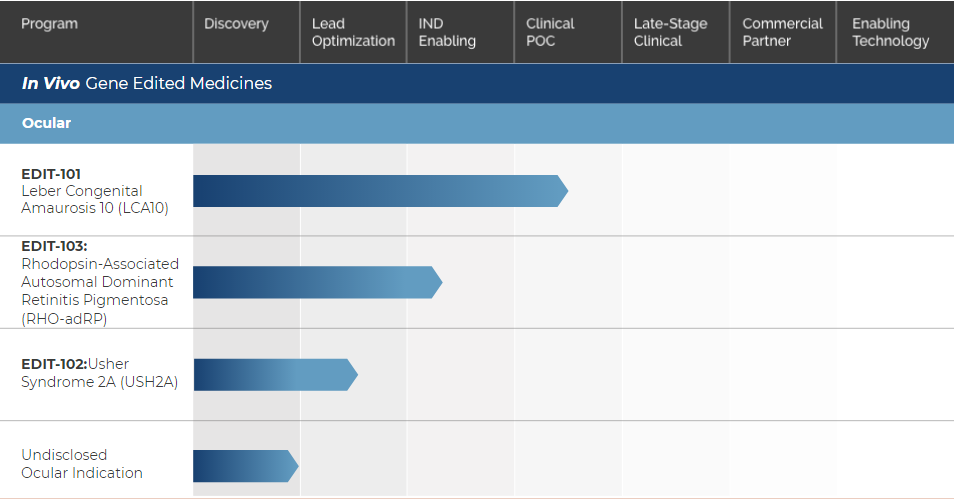 ▲ 研发管线 图片来源:Editas官网
▲ 研发管线 图片来源:Editas官网
体内基因编辑疗法主要针对眼科疾病的治疗,进展最快的是用于治疗先天性黑蒙10型(LCA10)的EDIT-101,其他几项尚处于临床前阶段。
EDIT-101是一种CRISPR/Cas9基因编辑药物,它将编码Cas9的基因和两个指导RNA(gRNA)装载进AAV5病毒载体,然后通过视网膜下注射直接注射到患者感光细胞附近,将基因编辑系统递送到感光细胞中。当感光细胞表达基因编辑系统时,gRNA指导的基因编辑可以消除或逆转CEP290基因上致病的IVS26突变,从而改善感光细胞功能,为患者带来临床益处。EDIT-101已获得美国FDA的罕见儿科疾病和孤儿药称号,以及欧洲药品管理局(EMA)的孤儿药称号。

EDIT-101 图片来源:Editas官网
而体外基因编辑疗法则开发了针对严重镰状细胞病(SCD)和β-地中海贫血(TDT)的EDIT-301疗法。该疗法已在今年7月底完成了SCD的首位患者给药。本次给药是Editas专有的CRISPR基因编辑的新型Cas酶AsCas12a首次在临床试验中用于编辑人体细胞,并且公司预计将在年底前宣布临床试验数据的顶线结果。此外,EDIT-301用于治疗另一适应症输血依赖型β-地中海贫血的临床I/II期试验(EDITHAL)也正在准备中,旨在检验EDIT-301的安全性、耐受性与初步疗效,并预计在今年进行第一位病患给药。
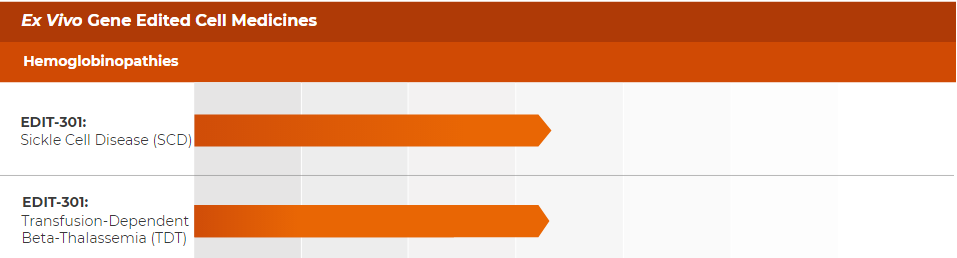 ▲ 研发管线 图片来源:Editas官网
▲ 研发管线 图片来源:Editas官网
此外,Editas在细胞疗法方面也建立了针对肿瘤的3条管线,包括EDIT-202、αβT细胞疗法、诱导多能干细胞(iPSC)衍生的NK疗法,目前均处在临床前阶段。
 ▲ 研发管线 图片来源:Editas官网
▲ 研发管线 图片来源:Editas官网
结语
自2012年CRISPR/Cas9 进入大众视野,到现在该技术的应用领域不断扩宽。其不仅可用于表达调控和基因功能的研究、细胞动物模型的构建、癌基因和药物靶点的筛选,在基因治疗中更是具有巨大的发展前景,为单基因遗传病、眼科疾病、艾滋病以及癌症等疾病提供了新的治疗方法。尤其是在不久的将来,我们或将迎来第一款CRISPR药物(CTX001)获批上市,这将是基因编辑领域的里程碑式进展。同时,这也将进一步推动该技术的临床转化和应用。
虽然CRISPR技术还存在脱靶毒性、DNA损伤毒性等方面的考量,但研究人员在不断推进技术革新以及优化递送技术,相信将来这些问题将会被逐击破,为患者带来更加安全、更加高效的疗法。
参考资料:
1.https://www.biospace.com/article/releases/editas-medicine-presents-preclinical-data-on-edit-103-for-rhodopsin-associated-autosomal-dominant-retinitis-pigmentosa-at-the-european-society-of-gene-and-cell-therapy-annual-meeting/
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











