Nature:挑战传统观点!疫苗能增强靶向胰腺肿瘤的T细胞
2023-05-15 BioMed科技 BioMed科技 发表于上海
研究描述了一种新抗原特异性T细胞可以被激活的方法-通过一种编码个体特异性新抗原的疫苗。他们的研究建立在先前的工作基础上,这些工作表明,胰腺癌的长期幸存者具有高质量的新抗原,可以刺激抗肿瘤T细胞。
一种使用免疫检查点抑制剂(ICIs)药物的免疫疗法的发展已经彻底改变了癌症治疗。ICIs的作用是帮助人体的免疫系统对抗仅由癌细胞表达的突变蛋白(称为新抗原)。新抗原的肽段很可能被免疫系统视为外来物,并且可以激活称为T细胞的免疫细胞(特别是那些被称为CD8 T细胞的细胞),这些细胞能够杀死癌细胞。胰腺癌通常对ICIs没有反应。这被认为部分是因为这些肿瘤比其他类型的肿瘤表达更低水平的新抗原,因此不太可能激活抗肿瘤T细胞的强烈免疫反应。

近日,Rojas等人在《Nature》杂志上撰文挑战了这一观点,并描述了一种新抗原特异性T细胞可以被激活的方法-通过一种编码个体特异性新抗原的疫苗。他们的研究建立在先前的工作基础上,这些工作表明,胰腺癌的长期幸存者具有高质量的新抗原,可以刺激抗肿瘤T细胞。Rojas及其同事为16例手术切除肿瘤的胰腺癌患者设计了与新抗原对应的信使RNA疫苗(图1)。接受这种手术的人通常有高达80%的复发率。
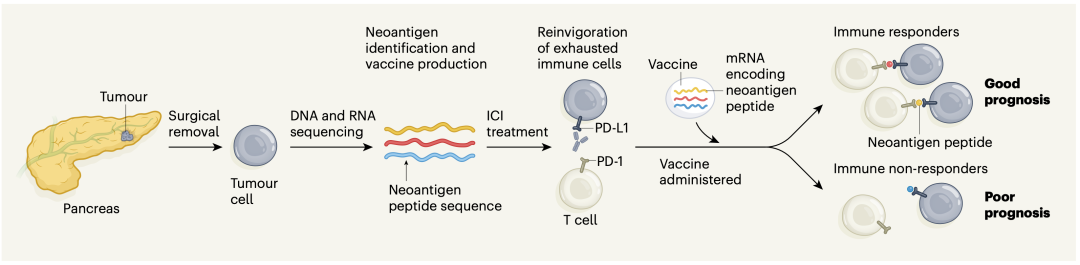
图1. 一种治疗胰腺癌的方法
mRNA疫苗编码每位患者最多20种新抗原,通过对患者手术切除肿瘤的DNA和RNA测序进行鉴定。手术后约9周静脉注射疫苗,计划在研究的下一阶段(II期临床试验)加快疫苗的生产和给药时间。这种快速的治疗时间强调了基于mRNA的癌症疫苗的益处,特别是对于高度侵袭性肿瘤。在试验中,一半的人接种疫苗后,血液中检测到识别与mRNA编码肽相对应的特定新抗原的T细胞,这些人被称为免疫应答者。在这些应答者中,一半对一种以上的新抗原产生T (多向应答),而另一半对单一的新抗原产生应答(单向应答)。值得注意的是,在所有免疫应答者中,在手术后18个月的中位随访时间中没有癌症复发的证据,而在无应答者中,癌症复发的中位时间为13.4个月。这些数据非常有希望,并将为计划中的进一步临床试验提供框架。
所有患者在接受mRNA疫苗之前还接受了一剂名为atezolizumab的ICI。Atezolizumab靶向肿瘤细胞上发现的蛋白质PD-L1,并通过重新激活由于PD-L1和免疫抑制受体PD-1之间的相互作用而进入功能失调,“耗尽”状态的预先存在的肿瘤反应性T细胞来起作用。这组作者分析了接受ICI治疗后的患者血液样本,并确定了增殖(扩大)的T细胞谱系-这是T细胞对新抗原识别反应激活的标志。作者通过对参与免疫反应的T细胞部分(T细胞受体β链)对应的DNA进行测序,确定了这些谱系。使用atezolizumab治疗后增殖的T细胞与mRNA疫苗接种后增殖的T细胞不同,这提供了疫苗激活新抗原特异性T细胞的证据。在最后一次mRNA疫苗接种4周后,患者接受化疗,化疗有时会抑制免疫细胞,但作者发现疫苗增强的T细胞没有被抑制。这表明序贯联合治疗策略对胰腺癌患者是可行的。
也许数据集中最引人注目的部分是免疫细胞在肝脏区域积累的证据,在接种疫苗后,一个应答者出现异常变化(称为病变)的迹象。虽然在这种病变中没有癌症的证据,但在免疫细胞的聚集中发现了所有疫苗诱导的T细胞谱系。有趣的是,在病变中检测到TP53基因的突变版本,并且与患者胰腺肿瘤中的TP53突变相匹配,这增加了一些癌细胞迁移到该部位的可能性。肝脏病变随后消失,这表明疫苗可以帮助消除已经扩散到远处部位的肿瘤细胞(微转移)。
Rojas及其同事使用两种基于血液的测试(ELISpot和T细胞受体测序方法)追踪T细胞谱系。这些方法有利于检测高强度的T细胞反应(那些有强烈T细胞激活迹象的细胞),但可能无法捕获低强度的反应。大约11%的接种过的新抗原明显引起了高强度的T细胞反应。在16个人中的4个人中,只有一种新抗原引起了免疫反应。因此,尽管一种高质量的新抗原可能足以触发T细胞介导的肿瘤杀伤,但理解为什么疫苗中其他新抗原没有检测到免疫反应是很重要的。此外,对于引起低强度T细胞反应的新抗原,可能有可能增强反应,例如,通过给予更多剂量的ICI,也可能防止T细胞衰竭。同样重要的是,考虑到应答者和无应答者之间的临床特征相似,调查为什么一半的个体对疫苗接种没有反应。基线免疫功能的标志,如对另一种mRNA疫苗(一种针对冠状病毒SARS-CoV-2)的反应和初始胰腺肿瘤中CD8 T细胞的积累(密度),在两组中相似。
相比之下,作者发现两组之间的差异在于免疫应答者的肿瘤比无应答者的肿瘤具有更少的突变多样性。这种较低的多样性可能反映了免疫系统对肿瘤早期反应的结果,表明免疫系统能够更好地识别免疫应答者的肿瘤。利用应答者的数据,比较每种新抗原的质量,根据其预测驱动T细胞反应的能力,揭示了预测的高质量新抗原驱动更强的抗原特异性T细胞反应,如先前报道的。
与一些个性化疫苗研究不同的是,Rojas及其同事的研究表明,新抗原特异性CD8 T细胞的激活是主要的,这被认为是直接杀死肿瘤细胞的关键因素。有趣的是,作者没有发现另一种新抗原特异性T细胞-CD4辅助性T细胞-即使疫苗中包含的新抗原被选择并优先激活这两种T细胞(尽管设计用于检测低强度T细胞反应的测试可能捕获疫苗诱导的CD4 T细胞反应)。CD4 T细胞被认为是辅助CD8 T细胞功能和控制肿瘤生长的关键伙伴。这就提出了一个问题,即如何产生mRNA疫苗以促进两种T细胞的最佳激活,包括优化免疫细胞的持久性,减少耗竭和免疫记忆的发展。优先选择CD4特异性新抗原仍然是一个挑战,而提高其识别的技术可能反过来引导CD4 T细胞产生高质量的应答。此外,mRNA疫苗本身的某些方面,如mRNA的设计和包裹疫苗的脂质纳米颗粒的组成,可能为优化T细胞特异性反应提供进一步的机会。
Rojas等人已经确定了使用基于mRNA的新抗原疫苗治疗胰腺癌的可行性,这种疾病以前被认为过于侵袭性,无法进行个性化治疗。这些数据还强调了胰腺癌新抗原的效力,给人们带来了希望,它们可能会导致这种难治性癌症的新治疗选择的发展。
原文链接:
https://www.nature.com/articles/d41586-023-01526-8#ref-CR1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言