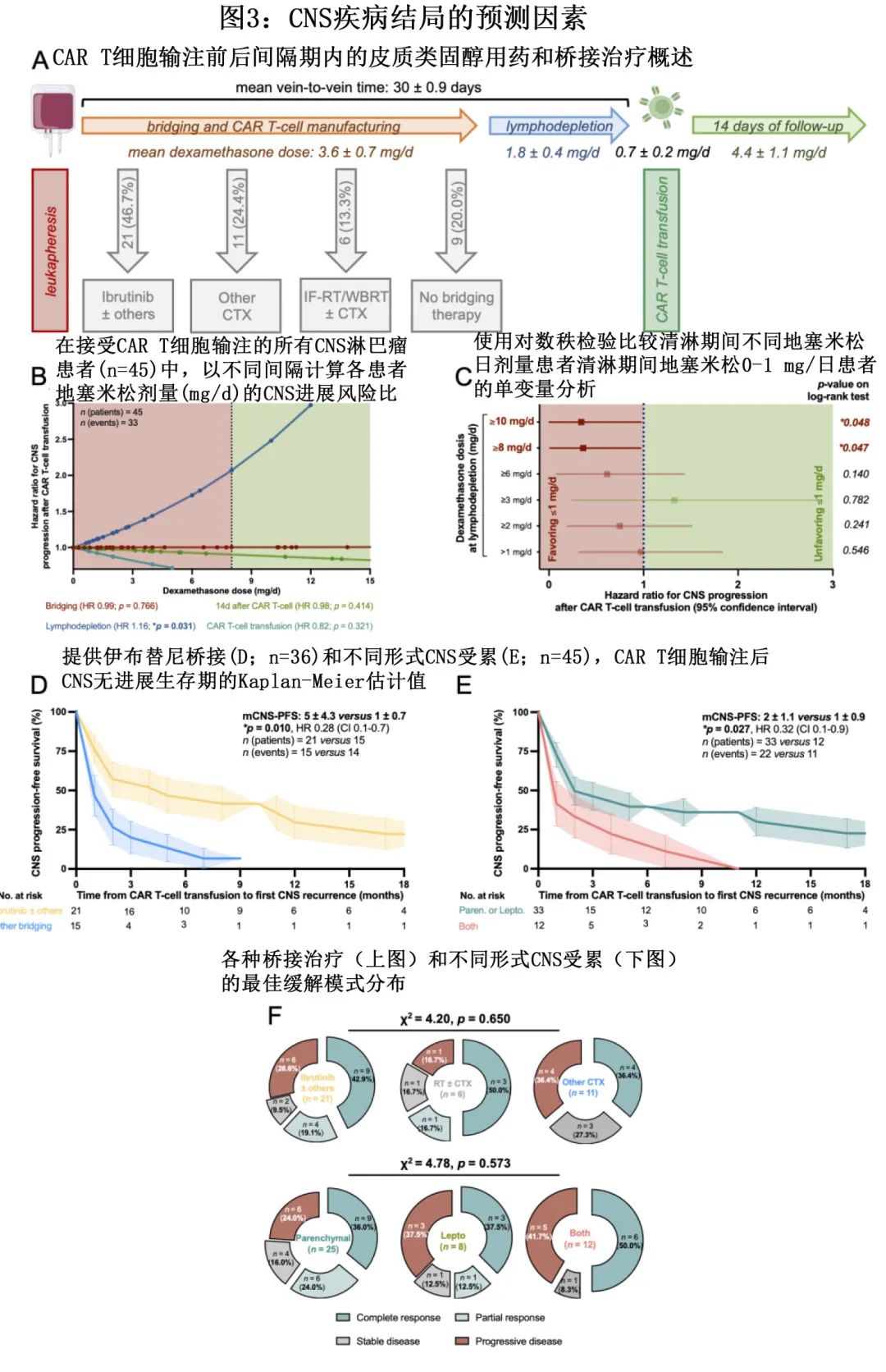
【Hemasphere】奥妥珠单抗对比利妥昔单抗治疗初治iNHL的GALLIUM研究8年随访结果
2023-07-24 聊聊血液 聊聊血液 发表于上海
研究旨在确定基于奥妥珠单抗与利妥昔单抗的免疫化疗的长期疗效和安全性,重点关注 FL 队列;还探索了诱导结束(EOI)时 PET 缓解状态与生存结局之间的相关性是否可通过延长随访得以维持。
GALLIUM研究8年随访
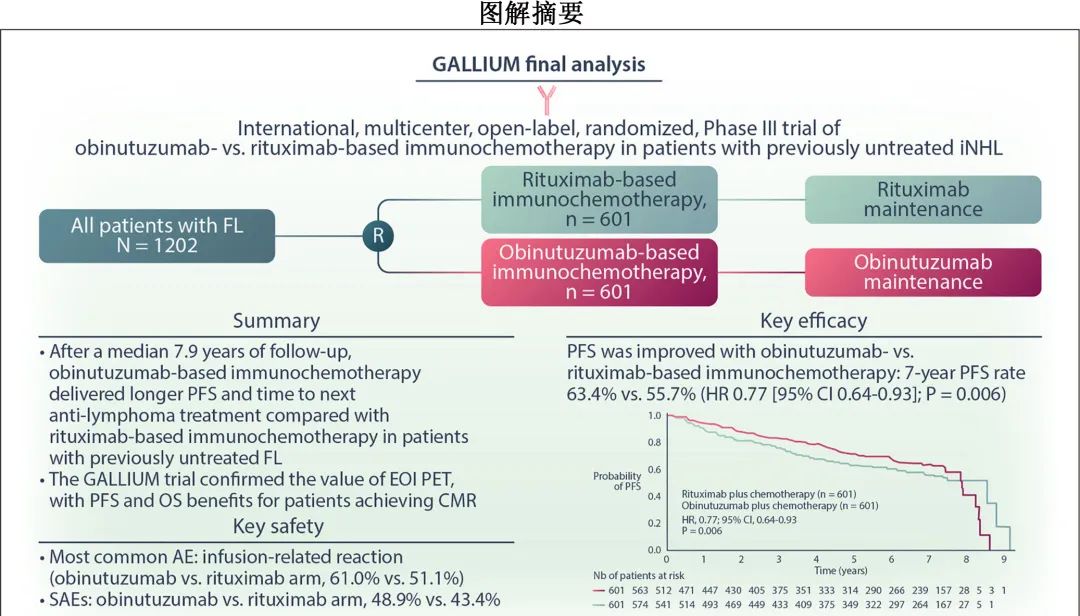
GALLIUM(NCT01332968) 是一项在既往未经治疗的晚期惰性非霍奇金淋巴瘤(iNHL)患者中对比奥妥珠单抗免疫化疗与利妥昔单抗免疫化疗的 III 期随机研究。中位随访34.5个月的最初报告中达到主要终点,证实了在FL人群中,与利妥昔单抗相比,奥妥珠单抗可改善无进展生存期 (PFS),风险比 (HR) =0.66;在随访5年后的后续分析中,该 PFS 获益得以维持 (HR=0.76)。
由于 iNHL 的自然史较长,在选择一线治疗方案时,长期结局也很重要。《Hemasphere》近日发表了GALLIUM研究7.9年随访最终结果,旨在确定基于奥妥珠单抗与利妥昔单抗的免疫化疗的长期疗效和安全性,重点关注 FL 队列;还探索了诱导结束(EOI)时 PET 缓解状态与生存结局之间的相关性是否可通过延长随访得以维持。
研究结果
GALLIUM是一项在既往未经治疗的晚期 iNHL 患者中比较奥妥珠单抗与利妥昔单抗免疫化疗的国际、多中心、开放性、随机、III期研究。纳入需要治疗的成人初治CD20+ iNHL(1–3a级FL或 MZL[脾脏、淋巴结或结外])且晚期疾病患者(III期或 IV 期,或 II 期伴大肿块≥7cm),1:1随机接受奥妥珠单抗或利妥昔单抗联合化疗。
患者分布和治疗
1401例患者入组并接受随机分组,其中1202例为FL(奥妥珠单抗组n=601;利妥昔单抗组n=601;图1),199例为MZL;MZL 队列195例患者纳入意向治疗人群(奥妥珠单抗组n=99;利妥昔单抗组n=96)。两组基线患者特征平衡良好。
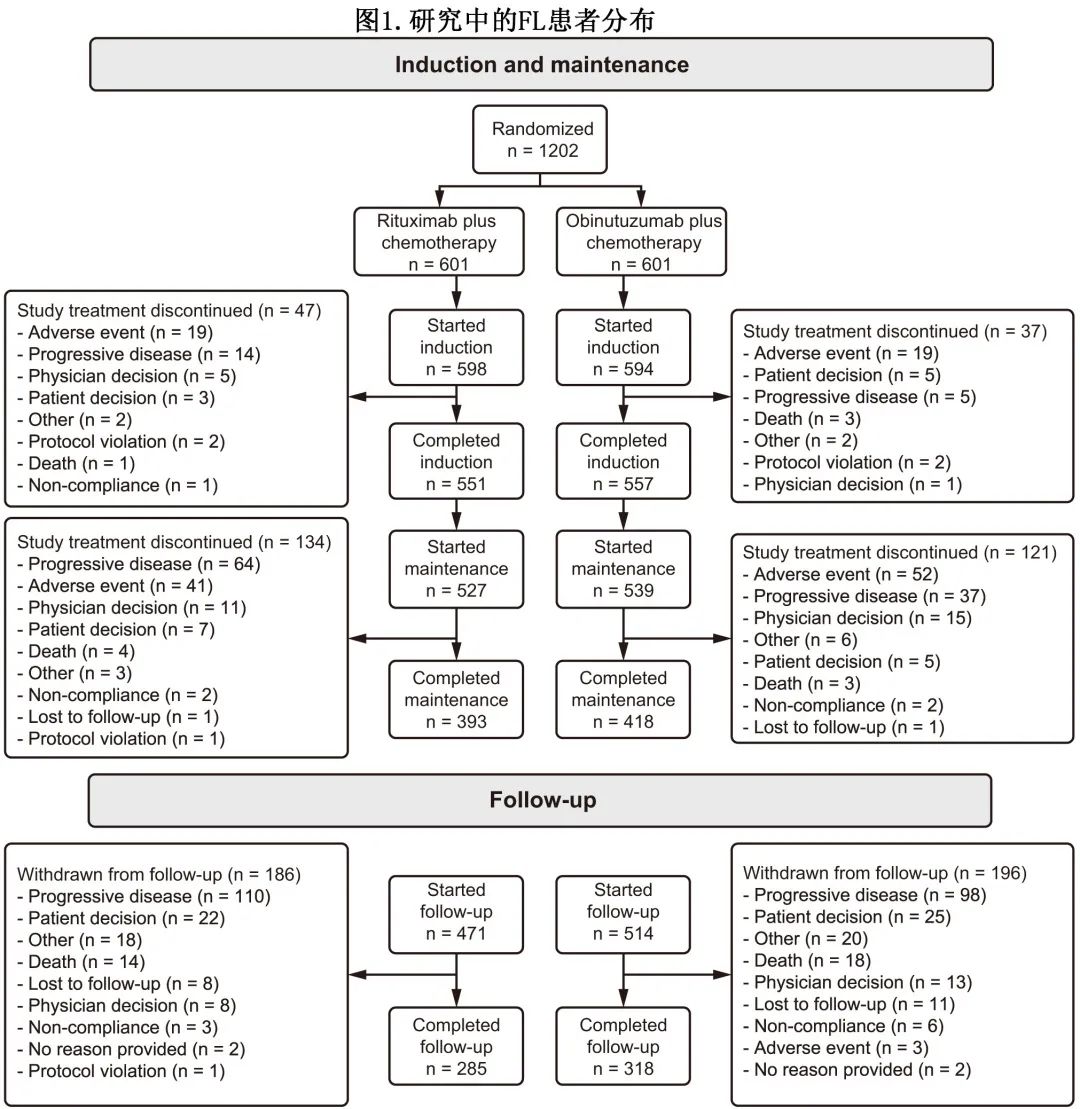
FL 人群中603例患者完成随访(图1;奥妥珠单抗组n=318;利妥昔单抗组n=285)。总体而言,奥妥珠单抗组和利妥昔单抗组分别有158例和181例患者退出研究治疗,其中121例和134例在维持治疗期退出,维持治疗期内退出的主要原因为AE(奥妥珠单抗组n=52,利妥昔单抗组n=41)、疾病进展(分别为n=37和n=64)和医生决定(分别为n=15和n=11)。
FL人群的中位随访时间为7.9年:奥妥珠单抗组为7.8年,利妥昔单抗组为7.9年;两组维持治疗的中位持续时间均为93.1周。MZL人群中位随访时间为7.9年:奥妥珠单抗组为7.8年,利妥昔单抗组为8.0年。
疗效
整体FL人群
随访8年后,奥妥珠单抗组 FL 患者中研究者评估的PFS仍优于利妥昔单抗组(7年 PFS 率分别为63.4%和55.7%;HR=0.77;P=0.006)(表1;图2A)。奥妥珠单抗组和利妥昔单抗组分别有168例和220例患者疾病进展。复发时不强制进行活检,仅69例患者的进展时活检数据可用,占所有疾病进展患者的18%。奥妥珠单抗组和利妥昔单抗组分别有25/601例 (4.2%) 和30/601例 (5.0%) 患者报告经活检证实转化为弥漫性大 B 细胞淋巴瘤 (DLBCL),分别代表25/168例 (14.9%) 和30/220例 (13.6%) 的进展事件。
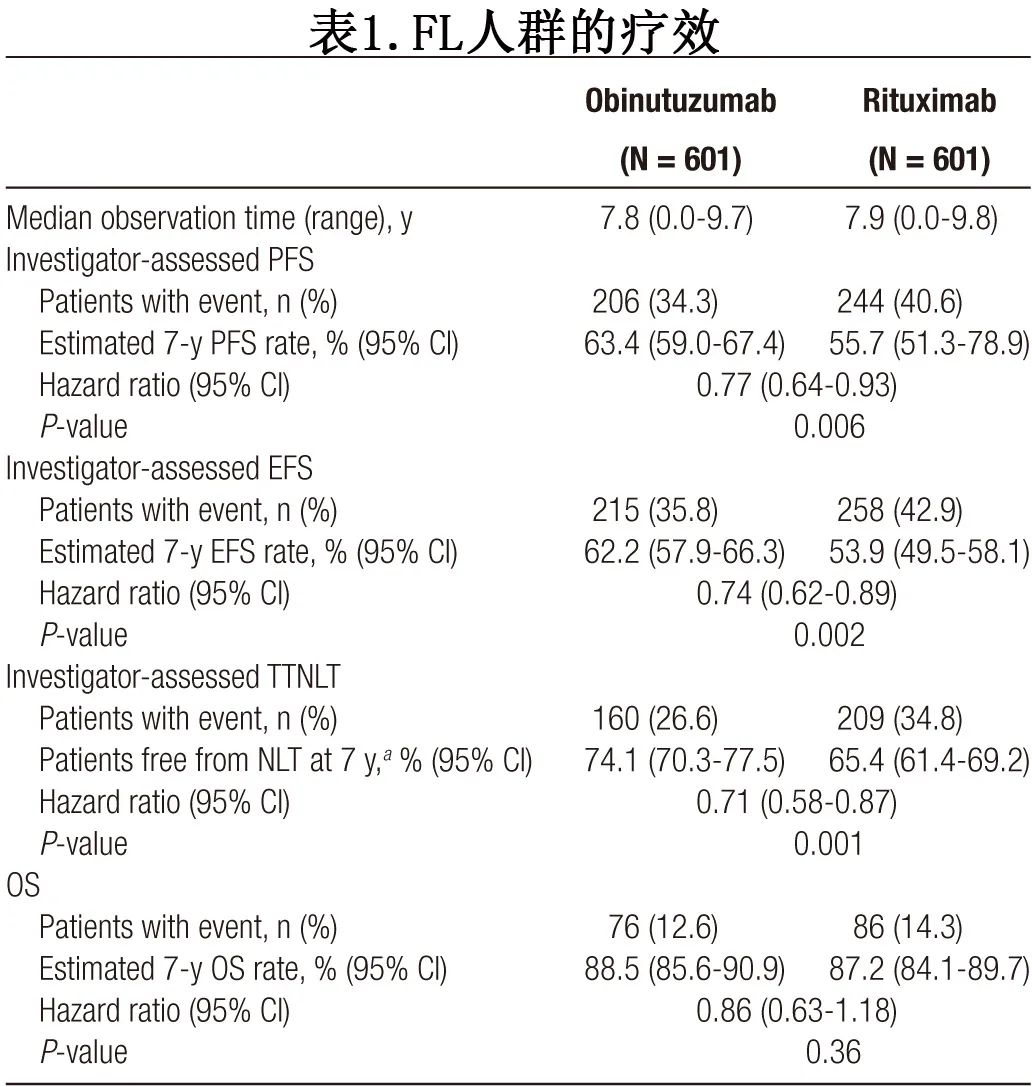
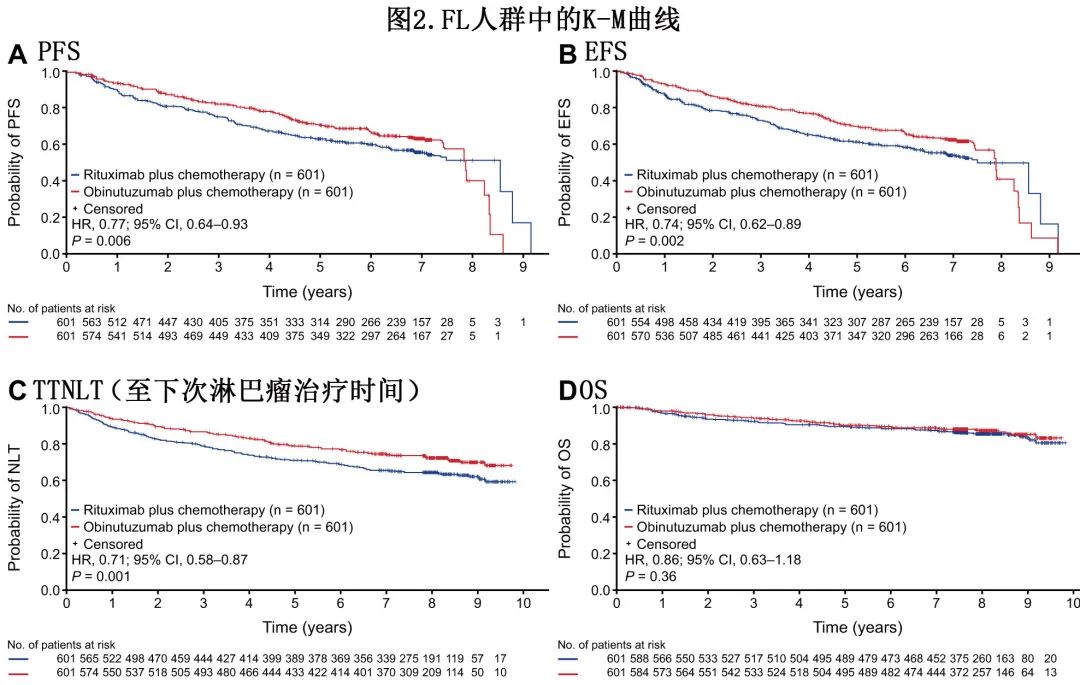
与利妥昔单抗组相比,奥妥珠单抗组研究者评估的7年 EFS 率也有所改善(62.2% vs 53.9%;HR=0.74;P=0.002;表1;图2B)。7年时,奥妥珠单抗组74.1%的患者和利妥昔单抗组65.4%的患者存活且未开始下次抗淋巴瘤治疗 (HR=0.71;P=0.001);369例患者开始了下次抗淋巴瘤治疗(奥妥珠单抗组160例,利妥昔单抗组209例;表1;图2C)。
162例患者死亡:奥妥珠单抗组76例,利妥昔单抗组86例。奥妥珠单抗组的7年 OS 率为88.5%,利妥昔单抗组为87.2%(HR=0.86;P=0.36)(表1;图2D)。奥妥珠单抗组和利妥昔单抗组分别有4.2%和6.0%患者的主要死亡原因是疾病进展,分别有4.4%和4.5%的患者死于AE。在按死亡原因进行的 OS 探索性分析中,治疗组之间 OS 的微小差异似乎是由于利妥昔单抗组因疾病进展死亡的人数多于奥妥珠单抗组所致。
PFS的亚组分析
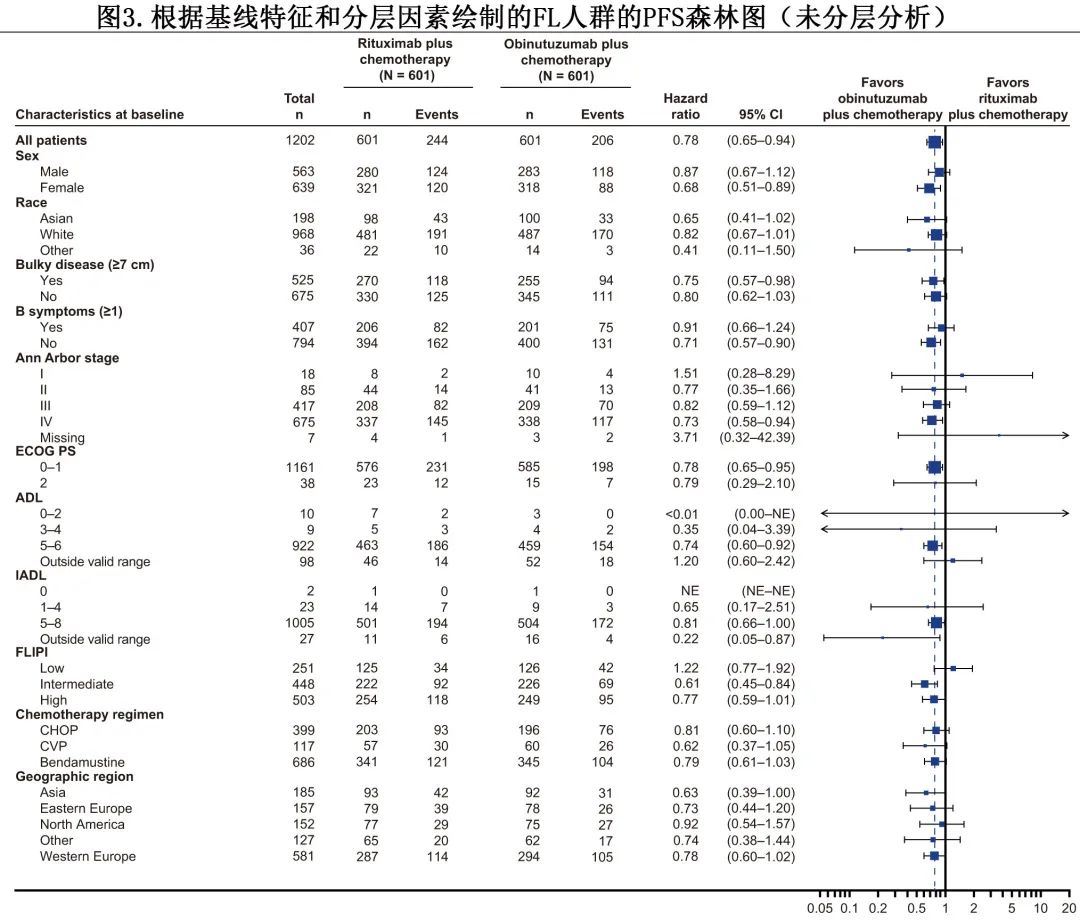
在根据基线特征和分层因素进行的PFS亚组分析中,大多数因素中未观察到治疗效应的显著异质性(图3)。然而,滤泡性淋巴瘤国际预后指数 (FLIPI) 评分似乎对 PFS 获益有影响:在 FLIPI 评分中至高 (2-5) 的患者 (n=951) 中,与利妥昔单抗组相比,奥妥珠单抗组观察到 PFS 获益,7年 PFS 率分别为62.9%和51.8% (HR=0.70;P<0.001),但在 FLIPI 评分较低 (0-1) 的患者中无获益(n=251;7年 PFS 分别为65.4%与70.1%;HR=1.20;P=0.45)。
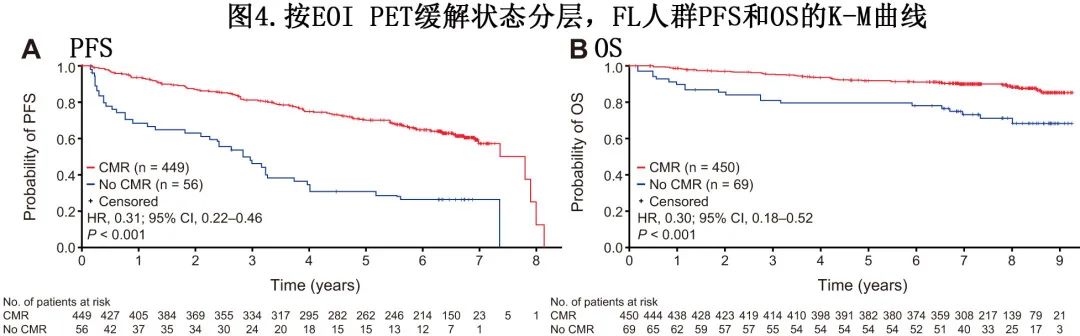
按完全代谢缓解(CMR)状态分层的生存率
在 FL 队列中,595例患者在维持治疗前 EOI 时进行了 PET 扫描,其中519例被纳入OS的里程碑分析人群,508例被纳入 PFS 的里程碑分析。奥妥珠单抗组和利妥昔单抗组分别有78.8%和72.5%的患者通过 PET 扫描达到CMR。不考虑接受的治疗,根据研究者评估,CMR患者 (n=449) 的 PFS 高于未CMR患者 (n=56)(HR=0.31;P<0.001)(图4A),EOI的7年 PFS 率分别为57.2%和26.5%。此外CMR 的患者 (n=450) 的 OS 也高于未CMR的患者 (n=69)(HR=0.30;P<0.001)(图4B);7年 OS 率分别为90.2%和73.2%。
值得注意的是,在达到 CMR 的患者 (n=449) 中,奥妥珠单抗组的 PFS 优于利妥昔单抗组 (HR=0.72;P=0.04)(图5A);7年 PFS 率分别为62.5%和51.4%。在未CMR的患者中(n=56[利妥昔单抗组n=31;奥妥珠单抗组n=25]),奥妥珠单抗组的7年 PFS 率为37.8%,利妥昔单抗组无法估计 (HR=0.53;P=0.09);分别有64.0%的和77.4%的患者发生进展事件(图5A)。
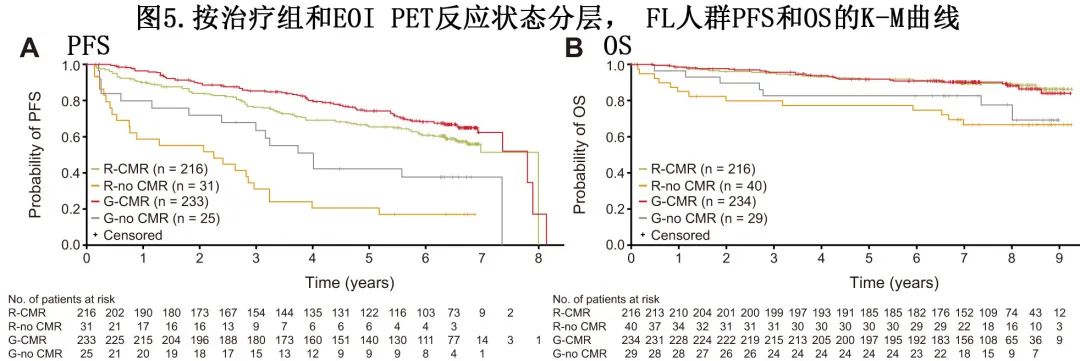
在 CMR 患者中,两组的7年 OS 率相似(奥妥珠单抗组为90.6%,利妥昔单抗组为89.8%;HR=1.09;P=0.77)(图5B)。在未CMR患者中,奥妥珠单抗组的7年 OS 率为82.8%,利妥昔单抗组为66.7%(HR=0.84;P=0.73)。
MZL人群
奥妥珠单抗组和利妥昔单抗组中, MZL 人群的7年 PFS 率分别为59.8%和52.2%(HR=0.77;P=0.26)。
安全性
FL 安全性人群包括奥妥珠单抗组595例和利妥昔单抗组597例患者。总体而言,随访7.9年后,最常见的 AE 为输液反应(奥妥珠单抗组vs.利妥昔单抗组,61.0% vs. 51.1%)、中性粒细胞减少症 (46.% vs. 51.3%) 和恶心(50.4% vs. 49.9%),最常见的3-5级 AE 为中性粒细胞减少(46.7% vs 40.4%)、白细胞减少 (8.9% vs 9.7%) 和发热性中性粒细胞减少(7.6% vs 4.7%)。奥妥珠单抗组48.9%的患者和利妥昔单抗组43.4%的患者发生SAE,分别有17.2%和14.5%的患者在观察/随访期间发生SAE(表2)。随访期间报告的最常见 SAE 是感染及侵染类疾病,奥妥珠单抗组和利妥昔单抗组分别有6.6%和6.3%。在观察/随访期间分别有1.9%和2.1%的患者报告了肺炎。
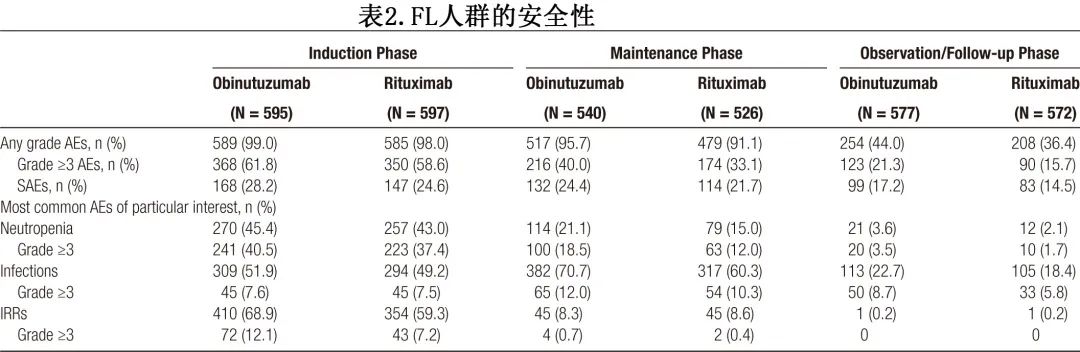
大多数致死性 AE 发生在化疗接受苯达莫司汀治疗的患者中,且治疗组之间无差异;20例 (5.9%) 接受奥妥珠单抗+苯达莫司汀治疗的患者和21例 (6.2%) 接受利妥昔单抗+苯达莫司汀治疗的患者报告了致死性AE。
研究药物首次给药后至少6个月报告的继发性恶性肿瘤(包括恶性和性质不明的肿瘤)的发生率,奥妥珠单抗组和利妥昔单抗组分别为13.1%和9.9%(≥3级分别为8.4%和6.5%)。组间差异主要由非黑色素瘤皮肤癌(奥妥珠单抗组3.9%;利妥昔单抗组2.8%)和血液恶性肿瘤(奥妥珠单抗组1.2%;利妥昔单抗组0.3%)的发生率驱动。
总结
III 期 GALLIUM 研究中, 1202例 FL 患者以1:1的比例随机接受基于奥妥珠单抗或利妥昔单抗的免疫化疗,随后接受相同单抗维持治疗长达2年,既往分析证实了奥妥珠单抗的PFS优于利妥昔单抗组。本次中位随访7.9年后,与利妥昔单抗免疫化疗相比,奥妥珠单抗免疫化疗的 PFS 仍有改善,7年 PFS 率分别为63.4%和55.7%(P=0.006),至下次抗淋巴瘤治疗的时间也有所改善(74.1% vs 65.4%的患者在7年时未开始下次抗淋巴瘤治疗;P=0.001)。两组的总生存率相似 (88.5% vs 87.2%;P=0.36)。不考虑接受的治疗,完全分子学缓解 (CMR) 患者的 PFS 和 OS 高于无 CMR 患者 (P<0.001)。
奥妥珠单抗组和利妥昔单抗组分别有48.9%和43.4%的患者报告严重不良事件;致死性不良事件的发生率没有差异(分别为4.4%和4.5%)。此外未报告新的安全性信号。
总的来说, GALLIUM 研究最终报告(中位随访8年)的关键结果在于,在既往未经治疗的 FL 患者中,与基于利妥昔单抗的免疫化疗相比,基于奥妥珠单抗的免疫化疗可维持长期 PFS 获益,且至下次抗淋巴瘤治疗时间方面也更优。研究未观察到 OS 的显著差异,这并不意外,因为该研究没有足够的效力来检测这种生存期长的惰性淋巴瘤的 OS 差异,且复发时患者仍可获得高效治疗方案。因此,考虑到患者特征和药物安全性特征,应将基于奥妥珠单抗的治疗视为合适患者的标准治疗。
参考文献
Townsend W,et al. Obinutuzumab Versus Rituximab Immunochemotherapy in Previously Untreated iNHL: Final Results From the GALLIUM Study.Hemasphere . 2023 Jun 30;7(7):e919. doi: 10.1097/HS9.0000000000000919. eCollection 2023 Jul.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言