不止胃癌,Claudin18.2如何成为肿瘤治疗靶点界的“一匹黑马”?
2023-04-12 找药宝典 网络 发表于上海
Claudin18.2:肿瘤治疗靶点界黑马!
近日,FDA已授予奥司他单抗(TST001)用于治疗胰腺癌患者的孤儿药认定(ODD),这是该药物继2021年首次被认定用于治疗胃癌和胃食管结合部(GEJ)癌后的第二个ODD。Osemitamab是全球正在开发的第二先代Claudin18.2靶向抗体。作为一种高亲和力人源化抗claudin 18.2单克隆抗体,具有增强的抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)。研究者相信,对于缺乏有效治疗方案的晚期胰腺癌,它也有可能带来变革。
Claudin18.2因何而起?
寻找PDAC治疗性抗体的新靶点至关重要。Sahin发现紧密连接分子claudin-18.2 (CLDN18.2)在原发性胃肿瘤及其转移灶中有显著表达。Schnatbaum发现的单克隆抗体唑贝妥昔单抗(zolbetuximab)可与CLDN18.2阳性的癌细胞结合,并通过抗体依赖性细胞毒性和补体依赖性细胞毒性导致癌细胞死亡。在Türeci进行的2a期MONO研究、和Sahin进行的2期FAST研究中,唑贝妥昔单抗对转移性胃腺癌和食管腺癌患者有效。唑贝妥昔单抗联合化疗和免疫治疗一线治疗转移性胃癌和胃食管结合部癌的临床试验正在全球范围内进行(NCT03505320、NCT03504397、NCT03653507)。胰腺癌模型被用于Türeci进行的一项研究,以检测唑贝昔单抗的作用机制和抗癌疗效。表达CLDN18.2的患者胰腺癌细胞可被唑贝妥昔单抗选择性强结合。目前,一项使用标识符NCT03816163的临床试验正在研究唑贝妥昔单抗联合白蛋白结合型紫杉醇和吉西他滨对转移性PDAC患者的疗效。

Claudin18.2为何可以作为潜在治疗靶点?
Claudin18有两种亚型,claudin18.1和claudin18.2,分别针对肺和胃组织。Claudin18.2在其他几种癌症中也有过表达,包括胃癌、食管胰腺腺癌。
正常情况下,claudin18.2仅表达于胃黏膜分化的上皮细胞表面,正常黏膜细胞中claudin18.2的表达局限于紧密连接复合体的内部。然而,恶性发生后,紧密连接蛋白被破坏,使肿瘤细胞表面的claudin18.2表位暴露,使其成为极其理想的药物靶点。
胰腺癌困难且棘手的治疗领域
胰腺癌是第四大最常见的癌症相关死亡原因(4.7%),占全球46.6万例死亡,不幸的是转移性胰腺导管腺癌(PDAC)患者的中位总生存期(OS)不到1年。胰腺导管腺癌占所有胰腺肿瘤的85%。近年来,以分子为中心的治疗药物越来越流行。目前只有一小部分患者(10%)适合接受靶向治疗。奥拉帕利对携带BRCA1/BRCA2生殖细胞系突变的转移性胰腺癌患者有效。恩曲替尼(entrectinib)和拉曲替尼(larotrectinib)对神经营养酪氨酸受体激酶基因融合有效,达拉非尼(dabrafenib)对BRAF突变有效,alpelisib对磷脂酰肌醇3-激酶(PI3Ks)突变有效。
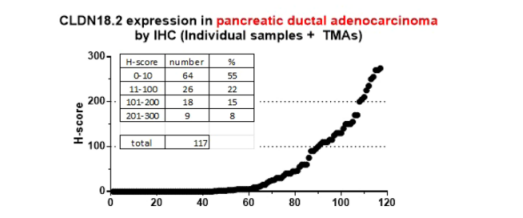
Claudin18.2取得的重大临床进展
Claudin18.2在胃腺癌和食管腺癌中高表达。对于Claudin18.2过表达的肿瘤,Claudin18.2是一个很有前景的治疗靶点。由于claudin18.2的高度特异性有助于T细胞识别肿瘤,因此被用于嵌合抗原受体T细胞疗法(CAR-T)。患者来源的异种移植(PDX)模型已被用于验证体内疗效,因此可能会带来突破,表明claudin18.2特异性CAR T细胞是claudin18.2阳性肿瘤,尤其是胃癌的有前景的治疗策略。
1、Zolbetuximab
唑贝妥昔单抗(Zolbetuximab, claudin18.2)是第一个开发的靶向claudin18.2的药物,在FAST研究中,唑贝妥昔单抗一线治疗胃癌使无进展生存期(PFS)延长了50%,总生存期(OS)延长了2倍。claudin 18.2阳性的胃/胃食管结合部/食管腺癌患者一线接受EOX(表柔比星+奥沙利铂+卡培他滨)单药或联合唑贝妥昔单抗治疗。对于claudin18.2在≥70%的肿瘤细胞中表达的患者,唑贝妥昔单抗+ EOX方案的中位PFS为9.0个月,中位OS为16.5个月。这组患者从唑贝妥昔单抗治疗中获益最大。claudin18.2阳性40 ~ 69%患者的中位PFS为5.7个月,中位OS为8.9个月。在疗效方面,表达claudin18.2的癌细胞比例越高,唑贝妥昔单抗方案的优势越显著。此外,在MONO研究中,唑贝妥昔单抗被用于转移或进展性胃/胃食管结合部/食管癌患者的单药治疗,包括50%肿瘤细胞中claudin18.2膜染色中度或强的患者。该方案显示了9%的总缓解率(ORR)和23%的临床获益率(部分缓解和疾病稳定)。在≥70%的肿瘤细胞表达claudin18.2的患者亚组中,ORR增加至14%。因此,在许多最近的临床研究中,癌细胞claudin18.2阳性表达的纳入标准增加到75%。
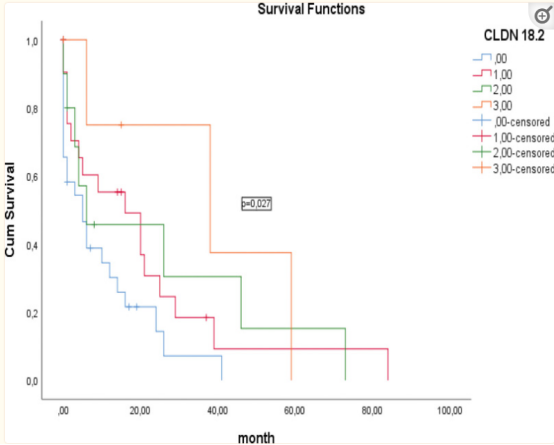
2、Osemitamab
之前,在claudin 18.2表达胰腺癌的临床前模型中,无论KRAS突变状态如何,奥塞米单抗均显示出稳健的抗肿瘤活性。此外,采用先进生物加工技术的生产减少了焦点含量,从而增强了使用奥塞米单抗的自然杀伤细胞介导的ADCC。
在2022年国际胃癌大会(International Gastric Cancer Congress)上公布的该药物的早期疗效数据表明,1例claudin 18.2低表达的胰腺癌患者在几个化疗周期后发生进展,并达到了持续的部分缓解。
该药物目前正在美国(NCT04396821)和中国(NCT04495296/CTR20201281)进行1/2期试验评估。两项试验均将在晚期或转移性实体瘤患者中研究奥司他单抗的安全性和初步疗效。
在2022年ESMO大会上公布的初步数据显示,在局部晚期或转移性胃/GEJ癌患者中,根据RECIST v1.1标准,在中位随访65日时,卡培他滨和奥沙利铂加用奥司他单抗作为一线治疗时,部分缓解(PR)率为73.3% (n = 11),疾病控制率为100% (n = 15) 。截至2022年8月4日,本试验已纳入并给药51例患者,包括在扩展阶段接受每3周1次6 mg/kg奥司他单抗+ CAPOX治疗的36例患者。其中Claudin18.2中、高表达的8例患者中6例达到PR, Claudin18.2表达未知的5例患者中5例达到PR。在安全性方面,大多数治疗中出现的不良反应为1/2级,包括恶心、低白蛋白血症、贫血、呕吐和血小板计数减少。12例(23.5%)患者出现给药延迟,5例(9.8%)患者需要减量,但无患者因治疗相关不良反应需要停止治疗。
新的希望不断涌现
根据clinicaltrials.gov和chinadrugtrials.gov网站,目前有数十项临床研究正在对claudin18.2高表达的实体瘤应用靶向治疗策略。这些靶向claudin18.2的药物包括单克隆抗体(mab)、双特异性抗体(bsab)、抗体偶联药物(adc)和CAR-T免疫疗法。希望进一步的临床研究证实,claudin18.2高表达的上消化道POMCs和MGMCs患者可以从针对claudin18.2的治疗策略中获益。联合检测claudin18.2和其他靶向治疗靶点,如HER-2、PD-L1、MMR和肿瘤浸润淋巴细胞(TILs),将有助于探索联合多靶点治疗策略,并预测POMCs和MGMCs患者对这些治疗的反应。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言