Blood:免疫效应细胞相关血液毒性:EHA/EBMT共识分级和最佳实践建议
2023-06-22 聊聊血液 聊聊血液 发表于上海
为了适应接受此类治疗的成人患者血液学副作用的独特特征,EHA和EBMT引入了免疫效应细胞相关血液毒性的概念,并基于新的分级框架概述了专家对其诊断检查和管理的建议。
免疫效应细胞相关血液毒性
CAR-T细胞疗法治疗难治性B细胞恶性肿瘤可以实现持久缓解,但也伴随着一系列独特的副作用,包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)和免疫效应细胞相关噬血细胞性淋巴组织细胞增生症样综合征(IEC-HS)。真实世界证据也强调,血液学毒性作为CAR-T细胞治疗后最常见的≥3级不良事件(CTCAE),其地位越来越重要;其他基于T细胞的免疫治疗(如双特异性抗体)也报告了类似的血细胞减少高发生率。值得注意的是,严重且通常持久的血细胞减少可加重B细胞再生障碍性贫血和连续低丙种球蛋白血症带来的免疫抑制。更重要的是,严重感染是CAR-T细胞治疗后发病率和非复发死亡率(NRM)的主要驱动因素。
CAR-T相关血液毒性具有独特性质。首先,血细胞减少可在临床CRS消退后长期存在,并且在CAR-T细胞输注后报告长达数月至数年;造血计数恢复通常遵循双相轨迹,可在间歇性恢复后出现第二次或多次下降。其次,患者可发生极重度骨髓(BM)再生障碍性贫血,常对生长因子支持等治疗措施无效。最后,潜在的病理生理学仍有待阐明,虽然有证据指出基线造血储备和宿主全身炎症状态的重要性。此外,重度CRS引起的炎症应激和相关的细胞因子模式改变可发挥骨髓抑制作用。
最近由EHA和EBMT领导的一项国际调查发现,当前的血细胞减少的分级和管理方面存在高度异质性。目前的分级系统(如CTCAE)多通过根据血细胞减少的深度来指定严重程度分级,但它们在日常实践中很难应用,也无法捕捉到CAR-T后造血重建的明显性质,如双相和/或延迟病程。此外,继发性并发症(例如感染、出血)的累积风险主要是随着相应血细胞减少症的持续时间而增加。因此针对经典细胞毒性化疗后血细胞减少症开发的分类系统可能不适用于接受新型、基于T细胞的免疫治疗的患者。
为了适应接受此类治疗的成人患者血液学副作用的独特特征,EHA和EBMT引入了免疫效应细胞相关血液毒性(Immune Effector Cell Associated Hemato Toxicity,ICAHT)的概念,并基于新的分级框架概述了专家对其诊断检查和管理的建议,形成EHA/EBMT共识分级和最佳实践建议,近日发表于《Blood》。

这些建议的范围普遍适用,适用于所有疾病和类型的自体CAR-T细胞治疗或作为标准临床实践采用的其他基于T细胞的免疫治疗(例如双特异性抗体)。该共识旨在反映这一新的、快速发展领域的当前最佳实践,帮助临床医生和其他医疗保健专业人员提供一致、高质量的患者护理。由于目前在临床试验外用于治疗血液恶性肿瘤的自体CAR-T细胞疗法越来越多,因此提出了这些建议。但鉴于缺乏该领域随机试验的高质量证据(预期证据等级3-5级,牛津循证医学中心),作者不对这些建议进行分级,它们代表的是作者的共识观点;而在临床试验中给予CAR-T细胞治疗时,建议医生应遵循相应的试验方案。
共识建议
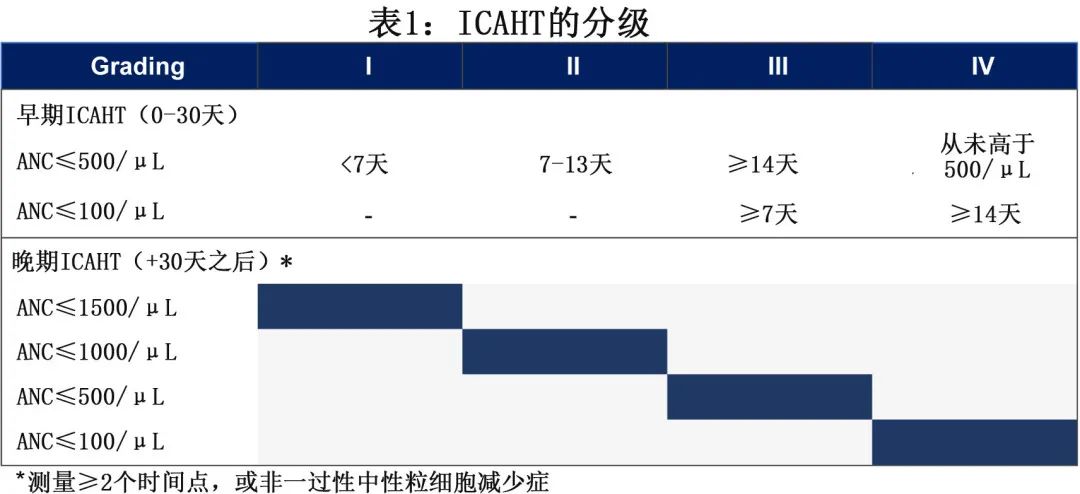
1.ICAHT的分级
根据代表EHA和EBMT的国际调查结果,专家小组将早期ICAHT定义为CAR-T细胞输注后前30天内发生的血细胞减少,而晚期ICAHT归类为第+30天后观察到的血细胞减少。专家小组认为,CAR-T后血细胞减少的主要临床行动要点是重度和/或长期中性粒细胞减少,而孤立性血小板减少或贫血是罕见事件。同时,本文采用基于中性粒细胞减少症的分级系统:对于早期ICAHT(第0-30天),由于相关的临床后遗症,定义基于中性粒细胞减少深度和持续时间的分级系统(见表1上半部);并根据CAR-T细胞输注后经过的时间(例如在第+30天后发生)对晚期ICAHT进行分级,严重程度(I-IV级)由中性粒细胞减少的深度来定义(表1下部)。对于贫血和血小板减少症,专家组参考了现有的分级系统,并建议应遵循机构指南,进一步概述见第6节和表4(见输血部分)。
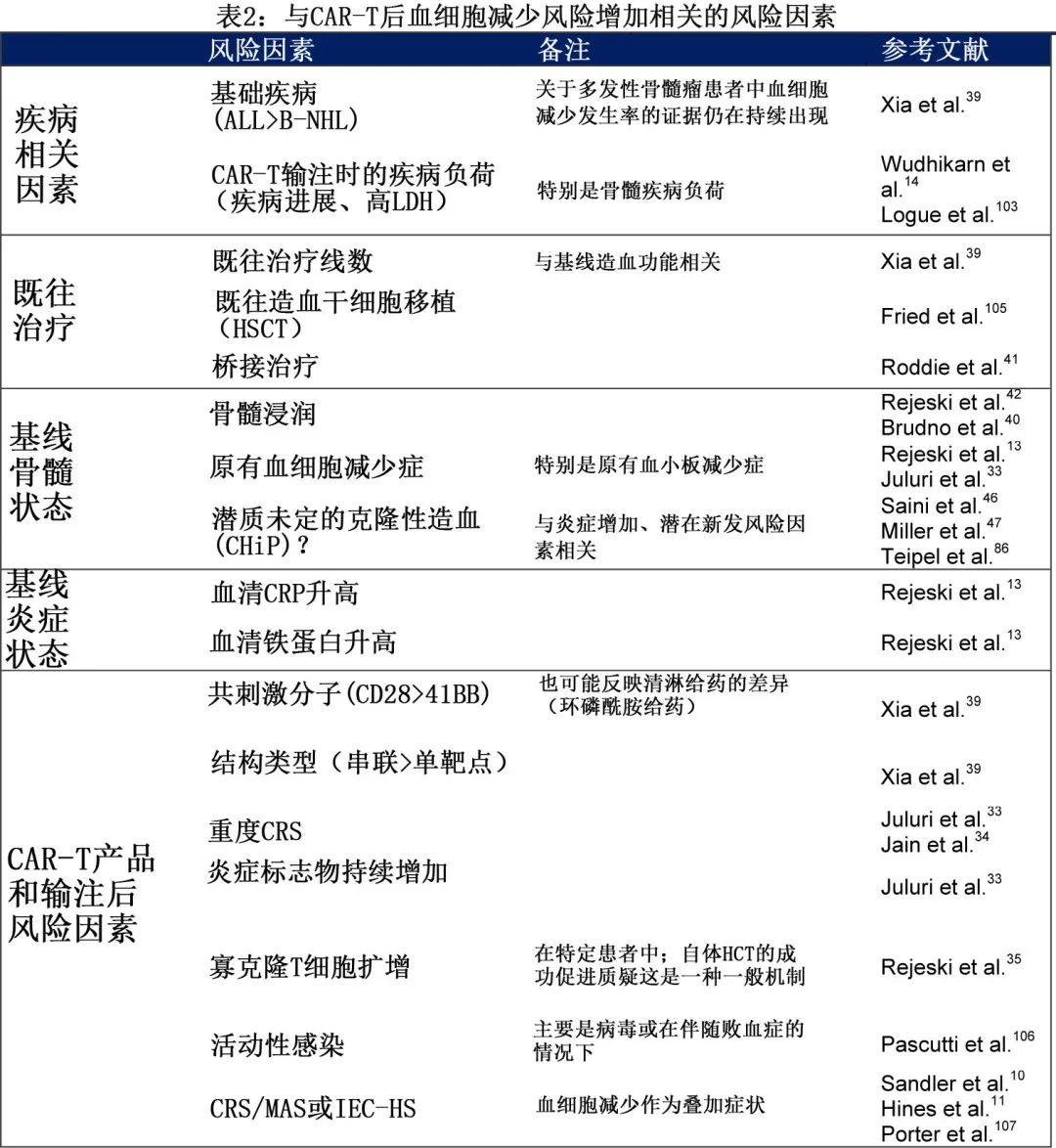
2.CAR-T后血细胞减少的风险因素
欧洲药品管理局(EMA)认可的CAR-T细胞产品关键注册试验中血液学毒性的总体发生率见补充表1。此外,作者对主要的真实世界研究进行了广泛的文献综述,特别关注相关研究和潜在风险因素。总体而言,大量因素可导致CAR-T后血细胞减少的发生,而其中一些因素仍不完全清楚。广义而言,CAR-T后血细胞减少与基础疾病及其既往治疗、基线风险因素(例如造血储备、骨髓浸润、全身性炎症)以及CAR-T产品特征和CRS相关炎症模式相关(表2)。
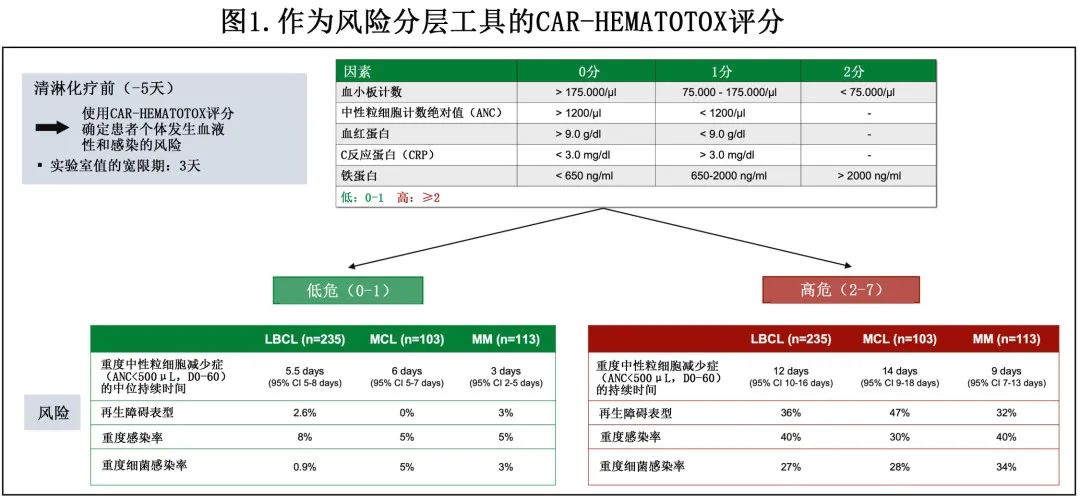
3.使用什么评分系统
基于上述几个风险因素开发了CAR-HEMATOTOX评分,以识别长期中性粒细胞减少症高危患者,尤其是发生中性粒细胞恢复的再生障碍表型(aplastic phenotype of neutrophil recovery)。可在德国淋巴瘤联盟(GLA)网站上找到在线计算器:https://www.german-lymphoma-alliance.de/Scores.html。该评分纳入与造血功能储备(中性粒细胞绝对计数[ANC]、血红蛋白、血小板计数)和基线炎症状态(CRP、铁蛋白)相关的因素,并针对CAR-T输注后前60天内持续时间超过14天的重度中性粒细胞减少症(ANC<500/μL)的主要终点进行了验证。重要的是,CAR-HEMATOTOX评分是在清淋化疗前确定的,因此可实现早期分层,将患者分为CAR-T细胞治疗后发生重度血液毒性的高危与低危(图1)。在随后的研究中,该评分还确定了多种疾病(例如LBCL、MCL、MM)存在重度感染和不良治疗结局风险的患者。然而重要的是要注意,该评分用于成人和儿童BCP-ALL患者仍有待前瞻性验证;此外检测特征(高灵敏度、低特异性)的阳性预测值较低,这意味着并非所有被认为是高危的患者都会发生重度血液毒性;相反的是,高阴性预测值表明,该评分在排除有重度血液毒性风险的患者方面特别有价值。
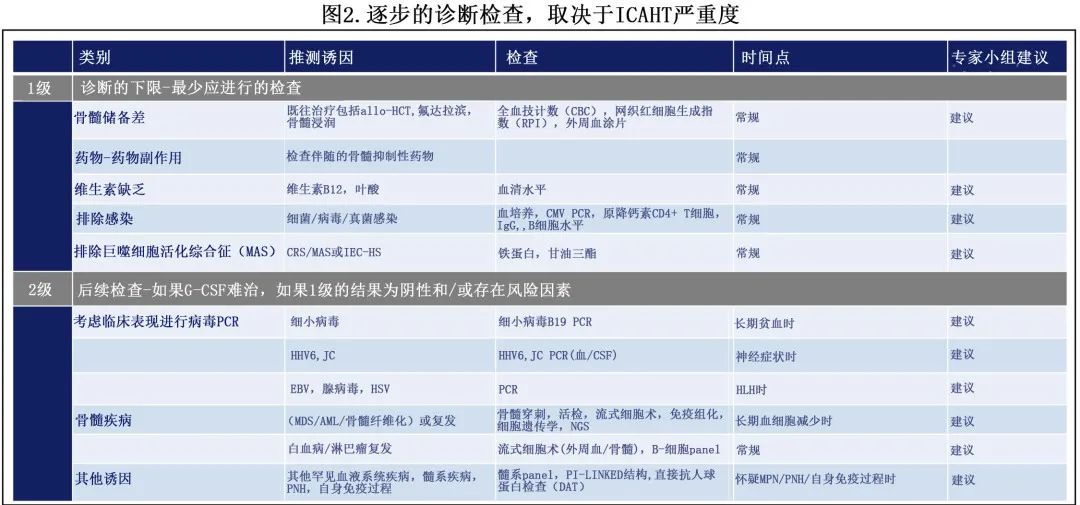
4.ICAHT的评估和诊断检查
在具有发生ICAHT高危特征的患者中(表2,图1),应考虑基线骨髓评估(单采或清淋前)以对患者进行血液学毒性风险分层,并确定潜在的骨髓浸润为相关风险因素。骨髓穿刺液和/或外周血单核细胞(PBMC)的冻存是可选项,但如果患者发生继发性骨髓衰竭(例如存在CHiP克隆)则可提供有用信息。
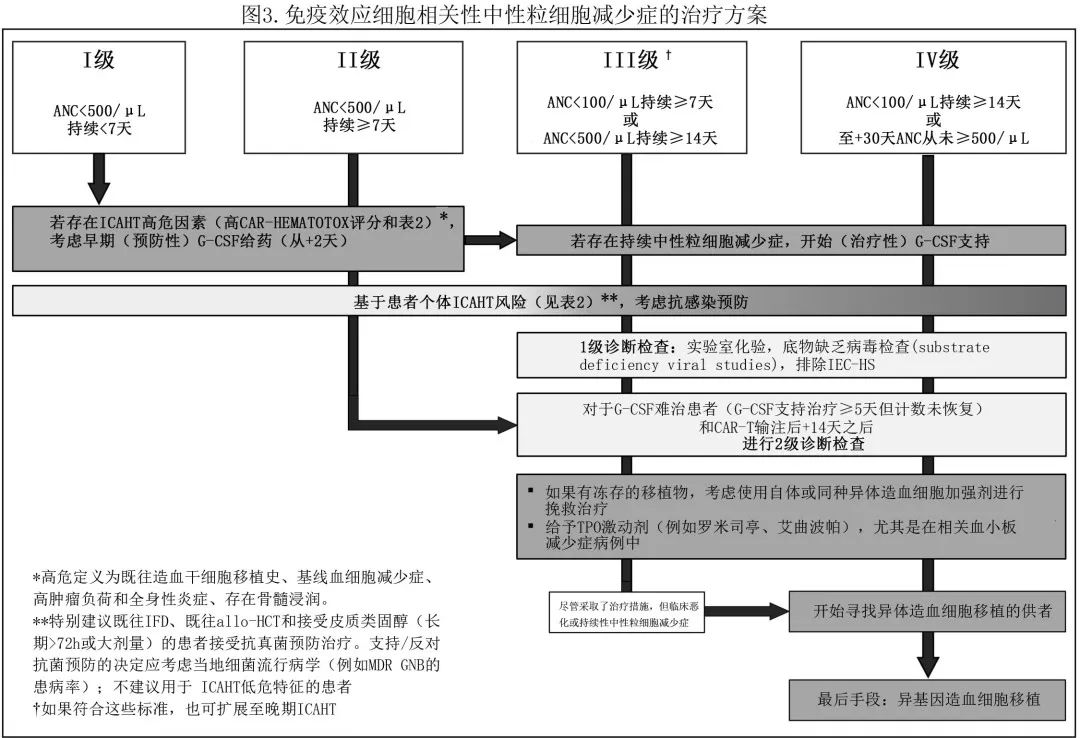
如果血细胞减少症持续时间超过清淋化疗的预期重建时间(通常在CAR-T输注后第2-3周),则检查的第一步包括鉴别诊断,包括药物诱导的血细胞减少症、维生素缺乏、感染原因、持续炎症应激源,复发和/或活动性骨髓疾病。专家小组建议进行2级诊断检查,初始1级评估包括标准诊断检查,应在所有重度或≥III级ICAHT病例中进行(图2)。如果1级结果不确定且血细胞减少持续存在和/或G-CSF难治(G-CSF支持治疗≥5天但计数未恢复),可进行后续2级诊断检查。重要的是还应包括扩展的病毒检测,以及骨髓穿刺和活检。专家组保留细胞遗传学和二代测序用于排除两种情况下的潜在髓系恶性肿瘤:深度、长期骨髓再生障碍(例如第+30天计数未恢复至ANC≥500/μL以上,全血细胞减少症)或CAR-T输注后晚期发生的、治疗措施难治的新发全血细胞减少症。
5.CAR-T细胞治疗后与重度血液毒性相关的噬血细胞作用
噬血细胞性淋巴组织细胞增生症(HLH)是一种由异常免疫激活导致的高炎症状态,与高热、高铁蛋白血症、长期血细胞减少和最终多器官衰竭相关。HLH仍是诊断难题,因为独特的生物标志物仍缺乏和/或不容易获得。在CAR-T细胞治疗中,HLH样症状的发生率介于1%-3.4%。CRS/MAS和IEC-HS两个实体可根据发作时间及是否伴随CRS/ICANS症状进行区分。在表现再生障碍性中性粒细胞恢复和血清铁蛋白升高的重度ICAHT患者中应考虑HLH的诊断,因两者均可表现为严重的免疫失调和IFN信号增加。建议进行全面检查,以便识别新发肝脾肿大、高甘油三酯血症、凝血障碍和低纤维蛋白原血症等其他异常,以及BM活检或其他组织中的噬血细胞特征(图2)。现有的评分系统可以指导重度ICAHT中HLH的诊断,包括HLH-2004标准、H评分和OHI指数;此外表S3概述了MD安德森标准、EBMT/EHA/JACIE建议和IEC-HS标准,专家小组认为这些标准更具体于CAR-T治疗。对于ICAHT表现为HLH形式的患者,应及时启动抗炎措施以减轻细胞因子风暴及其临床后遗症。患者应接受阿那白滞素(一种重组人源化IL-1受体拮抗剂)联合大剂量皮质类固醇治疗。难治性病例可以考虑使用芦可替尼、细胞因子吸附和emapalumab(IFN-γ抑制剂),尽管数据仍较缺乏。
6.血细胞减少的管理
ICAHT的管理大致可分为初始阶段(解决[预期的]早期血细胞减少,旨在降低感染和/其他并发症的风险)及后期阶段(在持续性和/或治疗难治性血细胞减少时启动)。早期ICAHT管理的专家建议概述如表3所示。
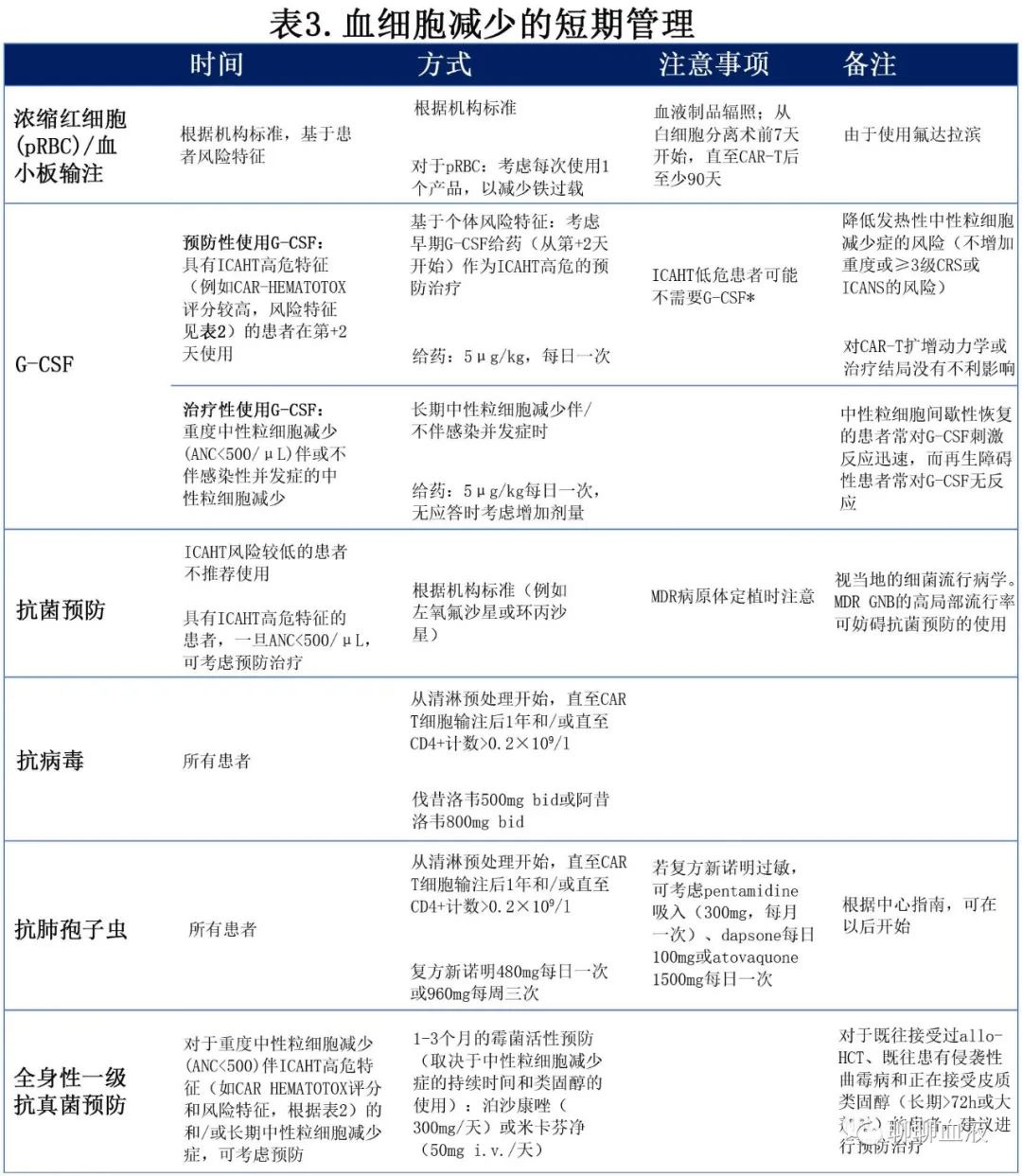
输血
由于CAR-T治疗后常见重度贫血和血小板减少,输血是支持治疗的重要组成部分,包括浓缩红细胞(pRBC)或血小板浓缩液(PC)。输血相关GvHD(ta-GvHD)是一种罕见的输血并发症,原因是细胞血液制品中的存活供者T淋巴细胞对受体产生免疫应答;考虑到其死亡率较高(>90%),建议进行ta-GvHD预防,但尚未就细胞治疗中使用经辐照血液制品的持续时间达成国际共识。在HCT背景下使用辐照血液的标准实践包括:(1)干细胞采集前至少2周,直至auto-HCT后至少3个月,(2)从预处理开始,最迟至allo-HCT后至少6个月,或直至免疫重建。而在CAR-T治疗时,专家小组建议从白细胞单采前7天至CAR-T输注后至少90天对血液制品进行辐照,除非预处理、疾病或既往治疗导致持续时间不确定(表3)。值得注意的是,在CAR-T输注前使用嘌呤类似物氟达拉滨作为清淋组分可能会影响辐照血液制品的当地指南。鉴于其相对罕见,建议向监管机构报告CAR-T后的ta-GVHD病例。
生长因子支持
粒细胞-巨噬细胞集落刺激因子(GM-CSF)
GM-CSF通常在CRS和ICANS的CAR-T患者中升高。应避免将GM-CSF作为生长因子用于血细胞计数较低的患者,因为其可能在CAR-T治疗后促进炎症毒性并诱导神经炎症。
粒细胞集落刺激因子(G-CSF)
由于担心使用GM-CSF和假设的(但很大程度上未知)毒性加重风险,早期指南建议通常推迟G-CSF直至急性CAR-T细胞相关免疫毒性消退(通常为第3周)。然而最近的报告质疑这一常见规则,并指出早期使用G-CSF的安全性特征可接受,未增加高级别(≥3级)CRS/ICANS。在Miller等(n=197)开展的最大型回顾性分析中,CAR-T前预防性使用G-CSF(主要是聚乙二醇化G-CSF)与中性粒细胞恢复更快、治疗结局相当和相似的重度ICANS发生率相关,但与≥2级CRS发生率更高相关,不过该观察结果未扩展至临床相关的≥3级CRS。在亚组分析中,作者发现G-CSF不会导致已经出现低度(1级)毒性的患者的CRS严重程度恶化。在Lievin等人的进一步研究中,在中性粒细胞减少症患者中早期给予G-CSF(从第+2天开始)与发热性中性粒细胞减少症风险降低相关,但不增加重度CRS或ICANS的风险。值得注意的是,G-CSF在维持CAR-T细胞扩增动力学和抗淋巴瘤活性方面也是安全的,对反应质量和结果无任何有害影响。评估上述证据并权衡获益和风险,高危患者可考虑在第+2天早期给予G-CSF,以缩短预期的重度中性粒细胞减少的时间(见表2和图1)。在长期重度中性粒细胞减少(ANC<500/μL)时,也可考虑使用治疗性G-CSF,并且对于识别再生障碍性中性粒细胞恢复表型(通常为G-CSF无反应)具有诊断获益。绝大多数CAR-T患者(>80%)最终对生长因子支持有反应,实现计数恢复,但复发性中性粒细胞下降(双相病程)可能需要间歇性应用治疗性G-CSF(图3)。最后,专家达成了统一共识,即在CAR-T治疗时及各疾病实体(B-ALL vs. B-NHL vs. MM) 中,开展前瞻性(最好是多中心)临床试验评估G-CSF的安全性和最佳治疗方案(预防性vs.早期/聚乙二醇化vs.非聚乙二醇化)是必要的。
血小板生成素(TPO)激动剂
TPO激动剂(例如,艾曲波帕、罗米司亭)主要用于血小板减少症持续时间较长和晚期的患者,血小板减少症的最低值通常出现在CAR-T治疗后的第2个月。支持在CAR-T中使用TPO激动剂的数据极为有限,仅限于来自单个中心的少数病例系列,患者数量有限。在这些有限的报告中,血小板以及血红蛋白和ANC改善,部分患者的血小板和pRBC不再依赖输血,与获得性骨髓衰竭病例中使用TPO激动剂的造血功能改善有所相似。由于现有数据有限,专家组建议TPO激动剂的使用应与HCT的实践相似。此外它们也可用于G-CSF难治性ICAHT病例(图3)。
感染预防
关于血细胞减少症期间抗感染预防的给药,专家小组广泛建议接受CAR-T细胞治疗的患者遵守EHA/EBMT/JACIE一般指南。以下为具体建议(表3):
-
遵守现行EHA/EBMT指南的规定,包括关于抗病毒和抗肺孢子虫肺炎(PCP)预防治疗,及静脉注射免疫球蛋白(IVIG)替代疗法用于CAR-T后低丙球蛋白血症。
-
专家小组不建议使用中性粒细胞减少性饮食来降低中性粒细胞减少CAR-T患者的感染风险。
-
抗菌预防:专家小组提出了一种基于患者个体感染风险特征的风险分层(risk-adapted)策略,包含长期、严重中性粒细胞减少症(ANC<100/μL持续≥7天)的预期发生率,符合美国临床肿瘤学会(ASCO)/美国传染病学会(IDSA)对成人癌症患者的共识建议。重度(≥III级)ICAHT风险较低的患者不建议使用氟喹诺酮类药物(如左氧氟沙星、环丙沙星)进行抗菌预防(表1、表3),且应避免使用,原因在于氟喹诺酮类药物特异性副作用、可能出现耐药菌株以及艰难梭菌和肠球菌选择压力。此外,CAR-T细胞治疗前的抗生素暴露可降低微生物组多样性,并与较差的结局相关,可能是由于肠道微生物组的多功能和免疫调节作用。另一方面,一旦ANC降至<500/μL,可考虑在高危患者中进行抗菌预防以降低重度感染的风险。CAR-HEMATOTOX评分可有助于指导和识别高危候选者。在接受CD19CAR-T的LBCL患者的大型回顾性分析中,在CAR-HEMATOTOXhigh而非CARHEMATOTOXlow患者中观察到氟喹诺酮预防治疗后重度细菌感染显著减少,从而支持风险分层策略。另外重要的是,小组建议遵守机构指南,因其考虑了当地流行病学和耐药模式。在这种情况下,监测多重耐药革兰氏阴性菌(MDR GNB)定植(即通过直肠拭子培养进行主动监测)可能有助于基线和长期中性粒细胞减少症期间的风险评估。
-
抗真菌预防:为降低侵袭性真菌病(IFD)的风险,对于重度ICAHT(≥III级)高危患者,一旦ANC降至<500/μL,可考虑进行抗霉菌预防(如米卡芬净或泊沙康唑)(表3)。需要考虑的其他风险因素包括既往allo-HCT、既往侵袭性曲霉病和接受皮质类固醇(长期≥72h或大剂量,例如大于10mg地塞米松或等效药物)。应考虑到CAR-T背景下IFD的总体发生率较低,尽管真菌感染是致死性感染并发症的常见原因。应继续进行全身性一级抗真菌预防,直至计数恢复稳定(3天内ANC> 500/μL)和停止类固醇(类固醇用于CRS/ICANS管理)。
造血细胞加强剂(Hematopoietic cell boost)
CAR-T输注后第+14天后对G-CSF无反应和/或难治的患者是极具临床挑战性的重度甚至致死性感染并发症高危患者亚组。虽然证据仍然有限,但在这种情况下可以提供TPO激动剂,尤其是在相关血小板减少的情况下。在认为炎症应激源(inflammatory stressor)起作用的重度ICAHT病例中(重度CRS/ICANS、CRS/MAS),应使用抗炎策略,如脉冲剂量皮质类固醇和/或抗细胞因子治疗(如托珠单抗、阿那白滞素)。一种有前景的策略是使用来自既往采集的冻存自体或异基因CD34+造血细胞(既往自体或异基因HCT)。最近的3个病例系列阐明了该方法在广泛的儿科和成人患者人群中的安全性和临床可行性,各研究中观察到持续中性粒细胞和血小板植入率较高。虽然在活动性感染时已成功应用造血细胞加强剂,但临床医生应意识到长期骨髓再生障碍性贫血患者发生免疫重建炎症综合征(IRIS)的可能性。由于早期应用可用的HCB与优越的生存结局相关,专家小组建议,如果(1)容易获得加强剂量和(2)已确定G-CSF难治性,则考虑在第+14天后应用HCB而不使用既往预处理化疗用于治疗≥III级ICAHT。同时,调查结果也强调,即使HCB是既往接受过auto-HCT患者的可行治疗选择,但它们通常并不可用。虽然高危候选者的预防性采集已被提出作为潜在的缓解策略,但专家小组警告称,采集过程可能会增加CAR-T细胞治疗本已很高的后勤负担(例如单采槽和存储容量的协调),在高疾病负担状态下可能对静脉-静脉时间产生负面影响。此外,这一过程可能会产生不必要的与收款和储存有关的费用。最终得出的结论是,需要进一步的研究来评估用于预防性干细胞采集所需要治疗的数量。
异基因造血细胞移植
如果上述手段仍然无效或不明确,并且IV级ICAHT持续超过第+30天,专家小组建议作为万不得已的情况(最后手段),应开始寻找供者用于可能的allo-HCT。在这种危及生命的ICAHT病例中,需要仔细权衡allo-HCT的获益和风险,并与患者的护理目标保持一致,此外还需要认真考虑自发性计数恢复的可能性。因此专家小组建议,需要根据具体情况讨论allo-HCT的最终触发因素。CAR-T输注后3-6个月是平衡感染风险和自发计数恢复可能性的合理时间范围。一旦决定进行allo-HCT,必须讨论关于供者选择、预处理方案和免疫抑制的详细信息,这方面的经验和证据非常有限,此处仅可提供一般注意事项。对于每次allo-HCT均应采用相同的基本原则,应牢记其主要适应症为重度和持续性血细胞减少,尽管目前基本上所有患者接受市售CAR-T细胞治疗的均是恶性淋巴系统疾病。最重要的是,挽救性allo-HCT还能够通过预处理方案和移植物抗肿瘤效应提供肿瘤控制,而目前的标准程序极有可能在完全供者嵌合体建立后导致CAR-T细胞被根除。因此,在allo-HCT前必须确定缓解状态,并可指导预处理方案的选择和免疫抑制的逐渐减量。通常来说,在讨论移植方式、供者挑选和选择时,应仔细考虑体能状态、合并症、既往治疗和预期的抗肿瘤活性。
7.总结和展望
过去几年中,在将血液学毒性定义为CAR-T细胞治疗的独特毒性实体方面取得了很大进展。虽然基础病理生理学仍不完全清楚,但越来越多的证据表明宿主造血与CAR-T细胞功能和疗效之间存在关键相互作用。通过定义ICAHT和描述特定的分级系统,作者提供了一个术语,能够进行交叉试验比较,并引入基于严重程度的管理策略。
在本国际共识指南文件中,作者提出了ICAHT诊断、分级/分期和临床管理的结构化方法,这一努力也为未来的发展领域奠定了基础,而这些领域将需要参与CAR-T细胞治疗的各种欧洲和非欧洲利益相关者之间的合作。跨多个中心的结构化样本收集是转化项目的基础,通过利用多组学和单细胞方法等新技术则可以描绘ICAHT的潜在机制。一个特别感兴趣的领域在于通过研究CAR-T前样本的外周血免疫背景和/或局部骨髓微环境来确定ICAHT的早期决定因素。此外,大型回顾性真实世界分析可能揭示EHA/EBMT调查确定的ICAHT临床管理的一些差异。剩余问题则与G-CSF启动的最佳时机以及使用的最佳方案相关(例如预防性与早期G-CSF),在高危候选者中预防性采集CD34+造血细胞的问题和HCB和allo-HCT的最佳触发时间点也是需要进一步系统研究的尚未解决的问题。最终,需要进行前瞻性临床试验,以确定减轻ICAHT的治疗策略的潜在获益和证据基础。
参考文献
Rejeski K,et al . Immune Effector Cell-Associated Hematotoxicity (ICAHT): EHA/EBMT Consensus Grading and Best Practice Recommendations.Blood.2023 Jun 10;blood.2023020578. doi: 10.1182/blood.2023020578.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







