指南与共识:| 基因重组溶瘤腺病毒治疗恶性肿瘤临床应用中国专家共识(2022年版)
2023-06-24 中国癌症杂志 中国癌症杂志 发表于上海
本共识为未来溶瘤病毒临床和基础研究探索、肿瘤一线医务人员临床实践、各级肿瘤免疫治疗医政管理等提供证据借鉴和规范依据,并为后续的相关行业指南制定奠定基础。
引用本文
中国临床肿瘤学会免疫治疗专家委员会,上海市抗癌协会肿瘤生物治疗专业委员会. 基因重组溶瘤腺病毒治疗恶性肿瘤临床应用中国专家共识(2022年版)[J]. 中国癌症杂志, 2023, 33 (5): 527-550.
基金项目:上海市科学技术委员会产学研医项目(18DZ1910102);上海申康医院发展中心医企融合创新协同专项 (SHDC2022CRT009)。
通信作者:许青(ORCID: 0000-0002-4785-2994),主任医师;王宝成(ORCID: 0000-0002-3988-4670),主任医师。
[摘要] 溶瘤病毒作为一种新型肿瘤免疫制剂,近年来在肿瘤基础和临床研究中不断取得突破,有望在未来肿瘤免疫治疗领域发挥重要作用。目前全球共有4种溶瘤病毒药物获批上市,其中重组人5型腺病毒注射液(H101)是中国目前唯一获得批准的溶瘤病毒药物。为进一步规范溶瘤病毒肿瘤临床研究实践,完善肿瘤免疫治疗临床应用,本共识基于《溶瘤病毒治疗恶性肿瘤临床应用上海专家共识(2021年版)》,采用循证医学方法,从聚焦国内外已获批上市的溶瘤病毒药物的适应证指导范围,围绕目前尚未获批适应证但已有较高循证医学证据的溶瘤病毒临床研究结果,展望未来溶瘤病毒药物的研究发展趋势,阐明溶瘤病毒药物(主要是基因重组溶瘤腺病毒)的具体使用方法,探讨随访与疗效评估新型模式等多个方面内容,在文献检索的基础上,进行质量等级评价、证据综合,并采用德尔菲问卷调查法,对目前基因重组溶瘤腺病毒肿瘤临床应用过程中所共同关注的应用场景、抗病毒合并用药、基因检测等具体问题和热点,通过多学科专家会议讨论、问卷调查等形式,经过4次逾12个不同城市、58家医院共计86名专家意见的调查汇总、归纳梳理和总结,依托中国临床肿瘤学会免疫治疗专家委员会及上海市抗癌协会肿瘤生物治疗专业委员会,形成了《基因重组溶瘤腺病毒治疗恶性肿瘤临床应用中国专家共识(2022年版)》,以期为未来溶瘤病毒临床和基础研究探索、肿瘤一线医务人员临床实践、各级肿瘤免疫治疗医政管理等提供证据借鉴和规范依据,并为后续的相关行业指南制定奠定基础。
1 共识的制定方法
1.1 共识专家构成
共有86名来自上海、山东、四川、黑龙江、辽宁、北京、天津、陕西、江苏、浙江、福建、江西、广东等10余个不同省市自治区的专家参与问卷咨询与调研,涵盖肿瘤科、介入治疗科、肝胆肿瘤科、胸部肿瘤内科、胸外科、肝胆外科、神经外科、放疗科、呼吸与危重症医学科、颌面外科、肿瘤基础研究、流行病学与卫生统计学等领域的多学科专家,其中53.5%(46/86)的专家有应用溶瘤病毒的一线临床实践经验,25.6%(22/86)的专家曾主持或参与过溶瘤病毒具体的相关临床研究,95.3%(82/86)的专家来自三级甲等医院,博士学历占比为80.2%(69/86)。
1.2 文献检索方法
检索的英文数据库包括PubMed和Embase,中文数据库包括中国知网和万方,检索时限均为建库至2022年3月6日,英文文献检索词主要包括oncolytic virus、oncolytic virotherapies、E1B gene-deleted adenovirus、H101、recombinant human adenovirus type 5、talimogene laherparepve、T-VEC、G47△、G47delta、teserpaturev、Rigvir、head and neck neoplasm、nasopharyngeal carcinoma、melanoma、glioma、hepatocellular carcinoma、hepatic metastases、pleural effusions、ascites、pancreatic cancer、pleural mesothelioma、cervical cancer;中文文献检索词主要包括溶瘤病毒、E1B敲除腺病毒、E1B缺失腺病毒、H101、重组人5型腺病毒注射液、头颈部肿瘤、鼻咽癌、黑色素瘤、胶质瘤、肝细胞癌(hepatocellular carcinoma,HCC)、肝转移、胸腹腔积液、胰腺癌、恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM)、子宫颈癌。文献纳入标准为:报道溶瘤病毒在恶性肿瘤患者中有效性与安全性的系统评价、荟萃分析、随机对照试验、队列研究、病例对照研究和病例报告等,或研究溶瘤病毒作用机制的动物实验与体外实验,或涉及溶瘤病毒药物的指南、共识与综述。文献排除标准为:非英语或汉语发表、学位论文、索引目录、社论、无法获取全文的文献及重复文献。通过文献检索与筛选、证据总结,构建并起草“陈述”。
1.3 德尔菲问卷调查法
采用德尔菲问卷调查法就溶瘤病毒相关“陈述”进行专家函询。投票设置“非常同意”、 “基本同意”、“不确定”、“不同意”和“非常不同意”5个选项,专家可对每条“陈述”提出修改意见。每次调查结束后,根据专家的反馈意见对“陈述”进行修改或增补。目前德尔菲问卷调查法并无统一标准化的赞同水平,参考Hassett等[11]的共识形成方法,若同意率(即选择“非常同意”或“同意”的专家人数比例)≥75%则认为该条“陈述”达成共识,同意率>90%为强推荐,同意率75%~90%为推荐。
1.4 证据分级方法
文献质量评价及证据强度的划分参考澳大利亚乔安娜·布里格斯研究所(Joanna Briggs Institute,JBI)证据级别系统(表1)[12]。

1.5 共识的目标人群与使用人群
本共识的目标人群为计划使用生物免疫治疗的恶性肿瘤患者,使用人群为从事恶性肿瘤基础和临床研究的医务工作者。
1.6 共识的传播、实施及更新
本共识发布后,共识工作组将主要通过以下方式进行传播和推广:① 在学术期刊上公开发表本共识;② 在相关学术会议中对本共识进行解读;③ 通过媒体、公众号等进行推广;④ 有计划地在中国部分省市自治区组织本共识的推广专场会议,确保基层的医务工作者充分了解并正确应用溶瘤病毒。共识工作组将综合循证医学证据及临床实践需求的进展,对本共识进行修订。计划每年对本共识的推荐意见进行更新。
2 结果
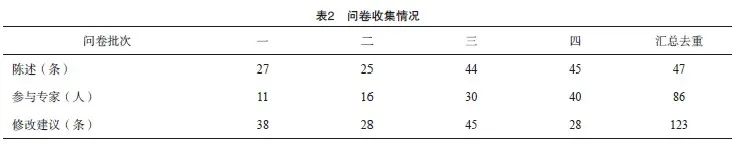
2.1 问卷收集情况
共开展了4次问卷调查,86名专家参与问卷填写,收集了123条专家建议(表2)。汇总分析4次问卷数据,共调查了47条“陈述”,基于审核专家的一致意见,删除了8条陈述,最终纳入分析的39条陈述中,共有35条达成共识(同意率 ≥75%),其中同意率为100%的共5条,强推荐的为31条,推荐的为3条,具体推荐结果见附录A。最后经审核并部分修改后定稿。
2.2 共识达成情况
2.2.1 基因重组溶瘤腺病毒的适用范围
2.2.1.1 H101与鼻咽癌
对于无法切除或术后复发转移的鼻咽癌患者,初始治疗可选择H101瘤内注射联合顺铂和5-氟尿嘧啶(5-fluorouracil,5-FU)(强推荐)。
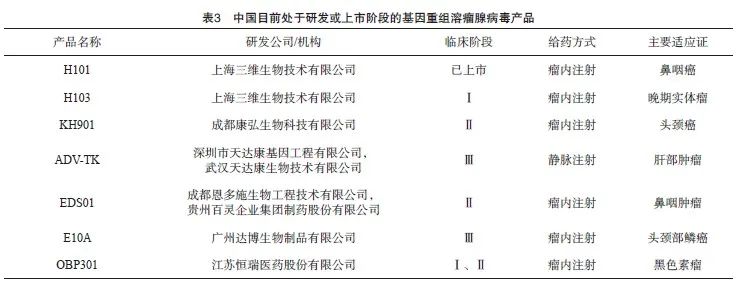
背景与证据:基因重组溶瘤腺病毒是指经过基因工程改造并具有溶解肿瘤细胞作用的腺病毒,是目前研究及临床应用极为广泛的溶瘤病毒之一。目前国内共有7款溶瘤腺病毒产品处于研发或上市阶段,其中仅H101已获批上市(表3)。H101是采用基因重组技术,以5型腺病毒载体为主链构建的一种删除E1B-55 kD和E3区基因片段(78.3~85.8 mu)的溶瘤病毒,是国外另一种E1B缺失腺病毒Onyx-015(dl1520)的类似物。临床前研究[13]结果证实,E1B缺失腺病毒能选择性地复制并溶解p53基因缺乏或异常的肿瘤细胞,而对正常人体细胞无明显的细胞毒作用(证据级别:5c)。2005年,H101在中国获批用于对常规放疗或放疗联合化疗无效,并以5-FU、顺铂化疗方案进行姑息治疗的晚期鼻咽癌患者[10,14]。H101治疗鼻咽癌的主要临床证据见表4。

2.2.1.2 H101与HCC
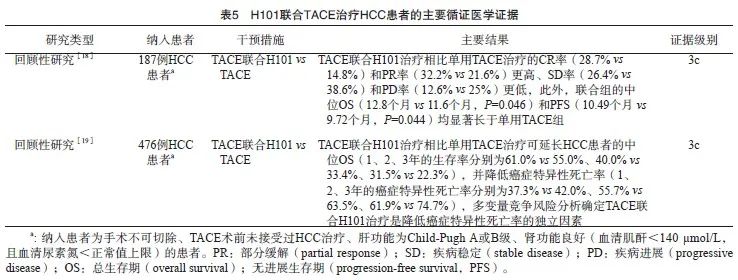
对于无法切除、Child-Pugh肝功能分级为A或B级、无肝外转移的HCC患者,初始治疗可考虑肝动脉注射H101联合经动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)(推荐)。
背景与证据:TACE是常用的HCC非手术治疗方法之一[17]。H101联合TACE治疗HCC患者的疗效与安全性已得到多项研究[18-19]证实(表5)。此外,H101联合其他治疗方式治疗HCC也可显著获益。一项前瞻性研究[20]显示, H101联合化疗(顺铂和5-FU)相比单用化疗可显著提高晚期HCC患者的客观有效率(22.5% vs 5.0%),联合组生活质量提高的患者比例显著更高(55.0% vs 22.5%),平均肿瘤进展时间显著更长[(11.93±2.54)周 vs(8.06±2.21)周],患者不良反应均为1/2级。有研究[21]观察到,1例患者在H101联合射频消融和帕博利珠单抗治疗后行根治性左侧半肝切除术后达到完全缓解(complete response,CR),且术后随访至第18个月时仍未见复发,1例患者在H101联合射频消融和帕博利珠单抗治疗后随访至第6个月时达到CR,这2例患者均未出现不良反应。
2.2.2 国外已获批上市溶瘤病毒及其适应证
2015年,美国食品药品管理局和欧洲药品管理局相继批准Ⅰ型单纯疱疹病毒T-VEC治疗晚期黑色素瘤[22]。2021年6月,溶瘤性单纯疱疹病毒药物G47△获得日本厚生劳动省的条件性限时批准,用于治疗恶性胶质母细胞瘤,成为全球首款获批用于治疗恶性胶质母细胞瘤的溶瘤病毒产品[23]。此外,还有一种经过基因改造的ECHO-7肠道病毒Rigvir先后于2004年在拉脱维亚、2015年在格鲁吉亚和2016年在亚美尼亚被批准用于治疗黑色素瘤,目前该疗法正在积极通过欧洲药品管理局的注册,溶瘤病毒正成为肿瘤治疗领域的研发热点[24]。这些药物的研发和应用为后续溶瘤病毒相关研究的设计与开展提供了重要参考,中国部分研究机构也在参照这些溶瘤病毒的研发模式开展临床研究。因此,本共识介绍T-VEC的适应证及其相关证据,以供相关医务工作者参考。
2.2.2.1 T-VEC与黑色素瘤
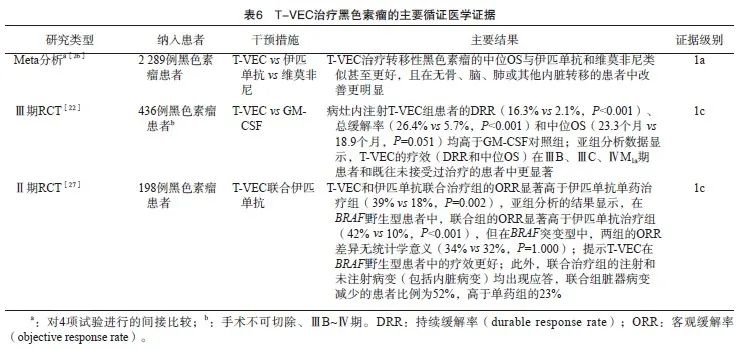
① 对于无法切除的Ⅲ期黑色素瘤,初始治疗可选择病灶内注射T-VEC(强推荐);② 对于不可切除、BRAF野生型、Ⅲb ~ Ⅳ期黑色素瘤,二线或后续治疗可考虑伊匹单抗联合病灶内注射T-VEC(强推荐)。
背景与证据:T-VEC是经过基因改造的一种Ⅰ型单纯疱疹病毒,其敲除了神经毒力基因ICP34.5和抗原递呈抑制基因ICP47,并插入人粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)基因[10,25]。2015年T-VEC在美国被获批用于初次手术后复发的不可切除的黑色素瘤患者的皮肤、皮下和淋巴结病灶的局部治疗。T-VEC治疗黑色素瘤的主要循证医学证据见表6。基于这些循证医学证据[22,26-27],美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐在某些情况下,转移性或不可切除的黑色素瘤的二线或后续治疗可考虑伊匹单抗联合病灶内注射T-VEC[28]。
2.2.2.2 G47△与胶质母细胞瘤
对于有残余肿瘤或复发的恶性胶质母细胞瘤患者,可考虑颅内注射单纯疱疹病毒G47△(强推荐)。
背景与证据:G47△是一款基于Ⅰ型单纯疱疹病毒开发的第3代溶瘤病毒[29]。一项在日本进行的开放标签、单组、非随机、单中心的Ⅱ期临床试验[30]评估了G47△在残余肿瘤或复发性胶质母细胞瘤患者中的疗效和安全性,纳入的人群为既往接受放疗和替莫唑胺化疗的成年胶质母细胞瘤患者,试验的主要终点是治疗后的1年生存率,次要终点包括PFS、OS和总反应率;中期分析显示,13例患者中有12例存活1年以上,1年生存率为92.3%,显著高于当前标准疗法的15.0%。这一研究由于达到主要终点而提前终止,最终数据显示,1年生存率为84.2%(95% CI:60.4%~96.6%,16/19),G47△治疗开始后的中位OS为20.2个月(16.8~23.6个月),首次手术后的中位OS为28.8个月(20.1~37.5个月)。最常见的G47△相关不良反应为发热(17/19),其次为呕吐、恶心、淋巴细胞减少和白细胞减少(证据级别:2d)[23]。基于这一研究,G47△于2021年6月获得日本厚生劳动省的条件性限时批准,用于治疗恶性胶质母细胞瘤患者。
2.2.3 溶瘤病毒药物未来的发展趋势
2.2.3.1 溶瘤病毒与其他疗法联合抗肿瘤
① 溶瘤病毒与化疗、放疗、靶向治疗和(或)免疫治疗联合可能具有协同抗肿瘤效益,在恶性肿瘤中,尤其在难治性肿瘤患者中具有较大潜力,建议开展注册临床研究以拓展溶瘤病毒的治疗模式(强推荐);② 不同疗法的组合方式、适用患者的选择标准、给药剂量、给药顺序及时间间隔等均可能影响溶瘤病毒的抗肿瘤活性,建议开展注册研究来深入探讨这些问题(强推荐)。
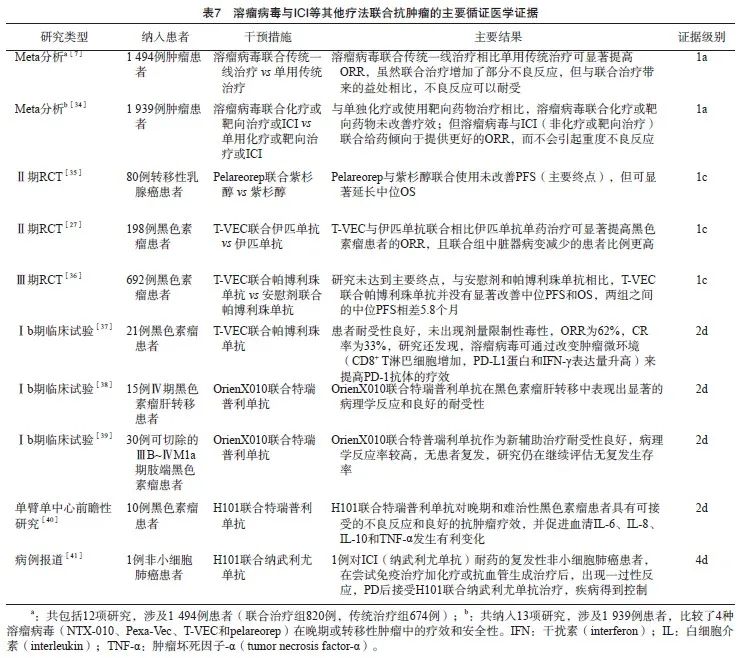
背景与证据:溶瘤病毒可打破肿瘤微环境中的免疫耐受局面,使无免疫原性的“冷”肿瘤转变为有免疫原性的“热”肿瘤,并通过促进T淋巴细胞募集和上调程序性死亡[蛋白]配体-1 (programmed death ligand-1,PD-L1)表达,使难治性肿瘤对随后的ICI敏感,提示溶瘤病毒是ICI的理想联合治疗方式[31]。溶瘤病毒与ICI等其他疗法联合抗肿瘤的主要循证医学证据见表7。这些证据表明,溶瘤病毒与其他疗法,尤其是ICI联合可能是未来癌症治疗的一个重要方向。但溶瘤病毒与其他药物之间的相互作用机制复杂,正确选择瘤种、病毒株和联合治疗时机对充分发挥协同效应至关重要。有动物研究[32]在使用牛痘病毒后同时或延迟给予抗细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抗体,以评估溶瘤病毒和免疫治疗药物联合给药的时机,结果显示,延迟给药可改善荷瘤小鼠的OS,而同时给药则无此效果,提示CTLA-4抗体可能会干扰病毒复制,从而降低整体疗效(证据级别:5c)。另一项动物研究[33]中,CTLA-4抑制剂在接种牛痘病毒1 d后给药时,在肿瘤控制方面可达到最大的协同治疗作用,而程序性死亡[蛋白]-1 (programmed death-1,PD-1)抗体在牛痘病毒处理7 d后给药的效果更好(证据级别:5c)。
2.2.3.2 适合开展溶瘤病毒临床研究的瘤种
① 肝转移癌:临床前研究及早期临床试验证实溶瘤病毒疗法在结直肠癌肝转移的患者中的安全性良好,且表现出初步的抗肿瘤活性,建议进一步开展临床研究以拓展溶瘤病毒在肝转移癌患者中的适应证(强推荐);② 胶质瘤:溶瘤病毒疗法治疗恶性胶质瘤的安全性已得到大量临床前及早期临床试验证实,建议开展注册研究以进一步验证溶瘤病毒疗法在恶性胶质瘤患者中的抗肿瘤效果(强推荐);③ 恶性胸腹腔积液:溶瘤病毒疗法在恶性胸腹腔积液患者中的治疗潜力已在一些动物研究及临床研究中得到证实,建议开展大样本、高质量的临床研究以拓展溶瘤病毒在恶性胸腹腔积液患者中的适应证(强推荐);④ 胰腺癌:溶瘤病毒疗法在胰腺癌患者中具有良好的安全性和疗效,建议开展大样本、高质量的临床研究以拓展溶瘤病毒在胰腺癌患者中的适应证(强推荐);⑤ MPM:鉴于溶瘤病毒胸腔注射的可操作性及其在MPM中表现出的抗肿瘤潜力,建议在MPM尤其是CDKN2A纯合缺失的患者中开展溶瘤病毒治疗研究(强推荐);⑥ 子宫颈癌:溶瘤病毒可特异性杀伤子宫颈癌细胞,也可以作为一个或多个治疗基因的载体,增强抗肿瘤效果,或与放疗等常规疗法协同抗肿瘤,溶瘤病毒可能是未来治疗子宫颈癌的新型疗法,建议在对现有治疗模式耐药的子宫颈癌患者中开展溶瘤病毒相关临床研究(强推荐)。
背景与证据:许多恶性肿瘤,如胶质瘤、胰腺癌、MPM、子宫颈癌、膀胱癌等的临床治疗效果差、复发率高、复发或转移患者往往预后不良,5年生存率低,需要更加有效的治疗方法。临床前研究及早期临床试验[42-65]发现,溶瘤病毒疗法在这些恶性肿瘤中表现出一定的治疗潜力,且安全性良好,其主要循证医学证据见表8。近年来,一项回顾性队列研究[66]对H101联合化学药物治疗晚期胃癌患者的临床效果进行评估,结果显示,H101联合化疗组的疾病控制率、总缓解率、1和2年OS率及PFS率均显著高于H101单药治疗组和化疗组,3组并发症差异无统计学意义,且H101治疗后的并发症并未随剂量增加而增加,提示H101联合化疗可能为晚期胃癌患者带来新的治疗选择,但其疗效和安全性仍需要大样本量的前瞻性随机对照临床试验进一步验证。


2.2.4 基因重组溶瘤腺病毒的使用方法
2.2.4.1 适用人群
使用基因重组溶瘤腺病毒之前,建议对患者的以下情况进行评估:
① 一般情况评估:年龄、体能状态评分、是否处于妊娠期或哺乳期、重要脏器功能;② 病史评估:有无恶性血液系统疾病、有无同类生物制剂过敏史、有无免疫缺陷或免疫功能低下、有无未经控制的活动性感染[10];③ 用药史评估:过去4周是否使用过抗病毒药物、免疫抑制剂或肾上腺糖皮质激素类药物;④ 既往治疗方案评估:是否接受过其他抗肿瘤治疗,如手术、放疗、化疗及生物治疗等;⑤ 影像学评估:病灶数量、大小、位置、有无转移等(推荐)。
计划应用基因重组溶瘤腺病毒治疗的患者应至少满足以下要求:① 经影像学、细胞学或病理组织学检查确诊为恶性肿瘤;② 年龄18~75岁;③ 肝肾功能良好;④ 体力状况0~2级[世界卫生组织(World Health Organization,WHO)分级];⑤ 无明显骨髓抑制;⑥ 签署知情同意书(推荐)。
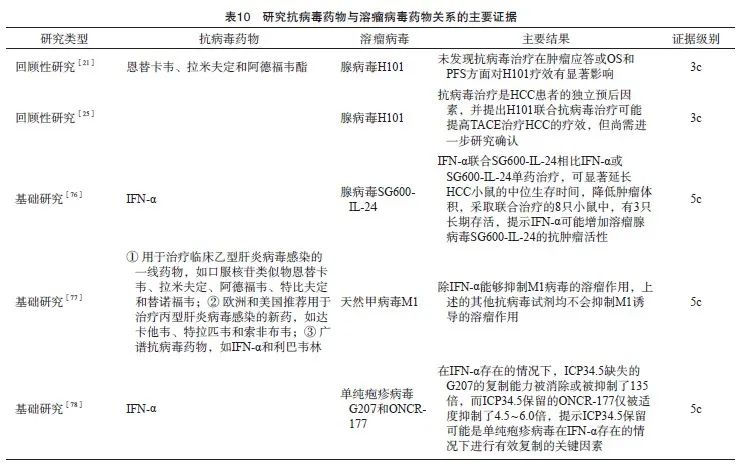
背景与证据:使用基因重组溶瘤腺病毒之前,是否需要进行基因检测,本次中国专家共识尚未就此达成共识。E1B-55K缺陷型腺病毒(如H101和ONYX-015)常被描述为一类能选择性复制并杀死p53缺失肿瘤细胞的溶瘤病毒,但p53与E1B-55K缺陷型腺病毒的关系尚存在争议(表9)。研究[67]显示,p53突变型肿瘤患者更有可能受益于H101治疗,但H101对p53无突变型肿瘤患者也具有一定的临床疗效,说明可能还有其他机制能促使E1B-55K缺陷型腺病毒在肿瘤细胞中复制并发挥抗肿瘤作用(证据级别:2d)。随后的研究[68]发现,p14ARF基因缺失可能是H101能在p53基因无突变的恶性肿瘤细胞内有效复制并杀死肿瘤细胞的重要影响因素之一(证据级别:2d)。

2.2.4.2 慎用或禁用人群
以下情况应慎用或禁用基因重组溶瘤腺病毒类药物[10]:① 有同类生物制剂过敏史者禁用;② 有未经控制的活动性感染者禁用;③ 正在使用抗病毒药物或大剂量肾上腺糖皮质激素类药物者慎用;④ 恶性血液系统疾病者慎用;⑤ 免疫缺陷和免疫抑制者慎用;⑥ 哺乳、妊娠期妇女禁用(强推荐)。
目前尚无证据表明抗病毒药物与基因重组溶瘤腺病毒药物有任何潜在的相互作用,对于计划使用H101治疗的HCC患者,经临床获益和安全性预后评估后可慎重继续使用抗病毒药物(恩替卡韦、拉米夫定和阿德福韦酯)(强推荐)。
背景与证据:抗病毒药物是否会影响溶瘤病毒的疗效一直是医务工作者比较关注的临床问题之一。尽管H101[15]与T-VEC[22]的Ⅲ期临床研究均排除了正在使用或需要接受抗病毒药物治疗的患者,但现有证据尚无法证实抗病毒药物与溶瘤腺病毒药物存在潜在的相互作用。探讨抗病毒药物与溶瘤病毒药物关系的主要证据见表10。
2.2.4.3 溶瘤病毒的给药途径
① 溶瘤病毒的给药途径包括瘤内注射、静脉注射、肝动脉注射、胸腹腔内注射等,其中瘤内注射与静脉注射各有利弊,但目前获批上市的多为瘤内和局部注射,临床医师应根据病毒类型、肿瘤部位、治疗目的及安全性评估,选择合适的给药途径(强推荐);② 在充分考虑溶瘤病毒药物的可及性、安全性、有效性及操作可行性后,也可考虑通过临床研究的方式,以其他途径给药,如肝动脉注射、胸腹腔内注射(强推荐)。
背景与证据:瘤内注射[15,26](证据级别:1c)、静脉注射[79-81](证据级别:2d、2d、2d)、肝动脉注射[21,25,82-83](证据级别:2c、 3c、3c、2d)和胸腹腔内注射[49-50,52,58](证据级别:4c、1c、1c、2d)溶瘤病毒的有效性和安全性均已在临床研究中得到证实,但在已正式发表的Ⅲ期临床研究中均采用的是瘤内注射。目前国内溶瘤腺病毒产品也多采用瘤内注射。图1为瘤内注射示意图(以H101为例)。一项分析溶瘤病毒有效性和安全性的meta分析[8]发现,通过瘤内注射的肿瘤患者获得了显著改善的ORR(P=0.000 2),而静脉注射无显著改善(P=0.990 0)(证据级别:1a)。瘤内注射与静脉注射的优缺点对比见表11[10]。
瘤内注射操作说明:
⑴ 注射前注意事项:① 用乙醇棉签清洁病灶处及其周围区域,等待晾干;② 如有必要,在病灶周围注射局部麻醉剂,切勿将麻醉剂直接注入病灶处。
⑵ 注射过程:① 选择皮下可见、可触及或可通过超声引导监测的病灶进行瘤内注射。从肿瘤边缘皮下的单个点位进针,沿不同运针轨迹注射H101,直到针头的径向范围允许H101在病灶内完全均匀分散。如果病灶位置大于针头的径向范围,则可从多个点位进针。② 稍退针(未退出病变),将H101完全均匀地注入病灶内。在注射剩余剂量的H101时,根据需要多次改变运针方向。按上述操作继续注射,直到全剂量完全均匀分散。③ 抽针时,从病灶处慢慢抽出针头,以免H101从进针点位溢漏。④ 对于其他需注射的病灶,需重复“注射前注意事项”,以及“注射过程”的第①~③步。一旦从病灶处完全抽出针头,以及对不同病灶进行注射时,均需更换新针头。
⑶ 注射后注意事项:① 用无菌纱布按压注射部位至少30 s;② 用乙醇棉签擦拭注射部位和周围区域;③ 更换手套,并用吸收垫和干燥的封闭敷料覆盖注射的病灶处;④ 用乙醇擦拭封闭敷料外表面;⑤ 建议患者:每次治疗后至少要将注射部位覆盖1周,如果注射部位有渗液,则延长覆盖时间,如果敷料脱落,则需更换敷料[10]。
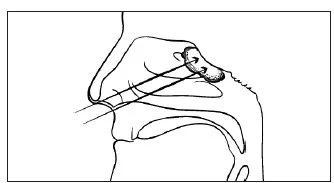
图1 瘤内注射示意图
头部正中矢状面,以H101治疗鼻咽癌为例。

2.2.4.4 基因重组溶瘤腺病毒的使用方法
① 建议根据肿瘤体积大小及病灶数量决定H101的剂量(强推荐)。
2.2.4.5 储存、运输和防护方法
① 溶瘤病毒应低温储存和运输,其中H101的储存和运输温度为-20℃(强推荐)。② 给药前应先将溶瘤病毒药物置于室温下解冻,直至药物转化为液态。使用过程中应避免反复冻融或在室温下放置过久而导致药效下降(强推荐)[10]。③ 使用溶瘤病毒前,应对患者及其家属以及相关医护人员进行药物使用说明及防护知识教育(强推荐)。④ 医护人员及其家属、孕妇和新生儿应避免直接接触患者的病灶注射处、敷料或体液;免疫功能低下或处于妊娠期的医护人员应避免制备或注射溶瘤病毒;患者应避免触碰或抓挠注射部位及其封闭敷料(强推荐)。⑤ 在制备和注射溶瘤病毒时,医护人员应穿戴个人防护装备(如工作服、安全眼镜、口罩和手套),避免溶瘤病毒药物接触到皮肤、眼睛和黏膜,若溅入眼睛或黏膜,应立即使用清水反复冲洗;若接触皮肤或被针头刺伤,应立即用75%乙醇溶液擦拭,再用清水彻底清洗(强推荐)[10]。⑥ 建议将所有可能接触过溶瘤病毒药物的材料(如药瓶、注射器、手套、口罩、敷料)作为生物危险废物进行处置(强推荐)。
2.2.4.6 不良反应的管理
① 建议参考美国国立癌症研究所(National Cancer Institute,NCI)发布的常见不良反应术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)6.0版对基因重组溶瘤腺病毒相关不良反应进行评价和分级(强推荐)。② 对于1或2级不良反应,建议对症处理,并继续使用基因重组溶瘤腺病毒治疗,同时密切监测疾病严重程度的变化(强推荐)。③ 对于3级及以上不良反应,建议紧急对症处理,并停止基因重组溶瘤腺病毒治疗(强推荐)。
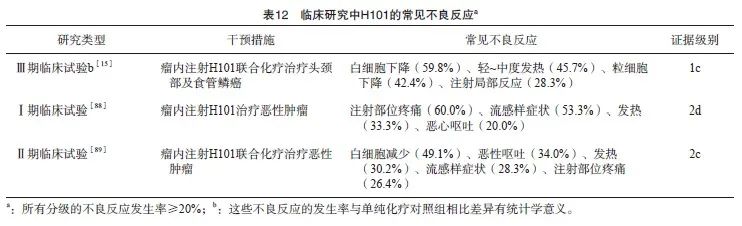
背景与证据:H101在临床研究中发生的常见不良反应如表12所示。国内外溶瘤病毒临床试验[22,15,27,87]中普遍应用NCI-CTCAE对不良反应进行评估。与基因重组溶瘤腺病毒(H101)治疗相关的不良反应多为轻~中度,一般无需特殊处理即可自行消退,部分患者在经过对症治疗后
可以缓解[15,88-89]。
2.2.5 随访与疗效评估
① 对于使用H101治疗的鼻咽癌患者,建议在治疗后的4~6周时进行复查评估,随后根据情况可间隔1~3个月复查(强推荐)。② 对于使用H101治疗的鼻咽癌患者,建议随访以下内容:纤维鼻咽镜或鼻内镜评估、注射部位的计算机体层成像(computed tomography,CT)或磁共振成像(magnetic resonance imaging,MRI)、转移部位的B超、脏器功能(包括肾功能、听力、甲状腺功能)、免疫功能、口腔科检查。其他检查还包括心脏、眼部、关节损害和其他晚期不良反应如继发的恶性肿瘤等相关检查(强推荐)。③ 对于使用H101治疗的HCC患者,建议在治疗后的4~6周时进行复查评估,随后根据情况可间隔1~3个月随访1次(强推荐)。④ 对于使用H101治疗的HCC患者,建议随访以下内容:甲胎蛋白、肝肾功能检测、影像学检查(注射部位的CT或MRI,也可视情况进行胸部X线、腹部超声、肝脏超声造影或肿瘤负荷评分)(强推荐)。⑤ 对于采取局部注射溶瘤病毒的患者,建议同时评估注射病灶和非注射病灶(强推荐)。
背景与证据:溶瘤病毒感染肿瘤细胞后,细胞发生裂解死亡,从而释放肿瘤相关抗原,进一步激活树突状细胞,增加细胞毒性T淋巴细胞的浸润以及其他免疫相关分子的募集,使肿瘤特异性免疫反应增加,导致远处和未感染的肿瘤细胞被清除[10,90]。在一项评估T-VEC瘤内注射联合CTLA-4抑制剂(伊匹单抗)治疗晚期黑色素瘤患者的疗效和安全性的Ⅱ期RCT[27]中,联合治疗组的注射和未注射病变(包括内脏病变)均出现应答。因此对于采取局部注射溶瘤病毒的患者,建议同时评估注射病灶和非注射病灶(证据级别:1c)。
3 讨论
本共识围绕基因重组溶瘤腺病毒的适用范围、使用方法、随访与疗效评估、溶瘤病毒临床研究发展趋势等多个方面开展了多次德尔菲问卷调查,参与专家来自全国各个地区,大多数专家为博士学历(80.2%)或来自三甲医院(95.3%),在肿瘤、介入、放疗等领域具有一定的代表性和权威性。在纳入调查的47条陈述中,删除的陈述为8个,强推荐的陈述为31个,推荐的陈述为3个,未达成共识的陈述共5个(附录A)。
删除的陈述包括H101与T-VEC的常见不良反应以及3~4级不良反应。专家认为,溶瘤病毒的不良反应属于客观存在的现象,不适合用投票方式决定。此外,考虑到药物可及性,本共识删去了《溶瘤病毒治疗恶性肿瘤临床应用上海专家共识(2021年版)》中T-VEC使用方法相关的陈述。
强推荐的陈述中,包括已获批上市的溶瘤病毒药物及其适应证的建议,这些建议得到多数受访专家同意的原因主要是基于相关循证医学证据级别较高,均有1c级证据支持。此外,强推荐的陈述还包括溶瘤病毒与其他疗法联用及其在结直肠癌肝转移、胶质瘤、胸腹腔积液、胰腺癌、MPM和子宫颈癌中的临床研究发展趋势,以及基因重组溶瘤腺病毒的储存、解冻、输注前后注意事项、不良反应的处理、随访与疗效评估的建议。值得关注的是,尽管H101说明书中将正在使用抗病毒药物列为H101的禁忌证,但考虑到目前尚无充分证据表明抗病毒药物与基因重组溶瘤腺病毒具有潜在的相互作用,97%的专家一致认为:对于计划使用H101治疗的HCC患者,经临床获益和安全性预后评估后可慎重继续使用抗病毒药物(恩替卡韦、拉米夫定和阿德福韦酯)。
推荐的陈述中,88.4%的受访专家同意:对于无法切除、Child-Pugh肝功能分级为A或B级、无肝外转移的HCC患者,初始治疗可考虑肝动脉注射H101联合TACE;9.3%的受访专家表示不确定,主要原因是需要有更高质量的循证医学证据支持;还有2.3%的专家表示不同意,其中多数专家对初始治疗提出异议,有的专家建议在TACE治疗后PD时使用,有的专家则建议晚期肝癌患者使用,还有专家对肝动脉注射的疗效和安全性提出质疑。尽管目前尚无前瞻性大样本量的RCT探讨H101联合TACE治疗HCC的效果,但已有回顾性研究[21,25]证实,与单用TACE相比,TACE联合肝动脉注射H101可显著改善手术不可切除HCC患者的OS、PFS和应答率,且耐受性良好,患者在TACE术前未接受过HCC治疗。
目前p53与E1B-55K缺陷型腺病毒的关系为关注热点。在使用基因重组溶瘤腺病毒治疗之前是否需要进行基因检测,受访专家对此尚未达成共识。73.8%的受访专家同意:对于计划使用H101治疗的患者,可不进行p53基因检测,但21.5%的专家选择不确定,4.6%的专家选择不同意。部分专家认为,p53具有一定的科研价值且检测费用不高,建议条件允许时进行p53基因检测;有的专家建议进一步研究,确定两者无相关性。在未达成共识的陈述中,还包括溶瘤病毒给药方式的建议,近1/3的受访专家对溶瘤病毒的瘤内注射方法以及静脉注射的可行性表示不确定,其中多数专家对静脉注射的安全性存在顾虑。尽管一些早期临床研究[78-80]已对静脉注射溶瘤病毒的安全性进行过评估,但其疗效仍有待临床研究证实。此外,关于H101的给药剂量和治疗周期目前尚未达成共识,约1/3的专家表示不确定,可能是由于受访专家中,部分专家尚无溶瘤病毒的临床应用经验或经验不足所致。因此,需开展更多的溶瘤病毒临床研究,进一步扩大溶瘤病毒的临床应用范围,让更多患者获益。
4 总结与展望
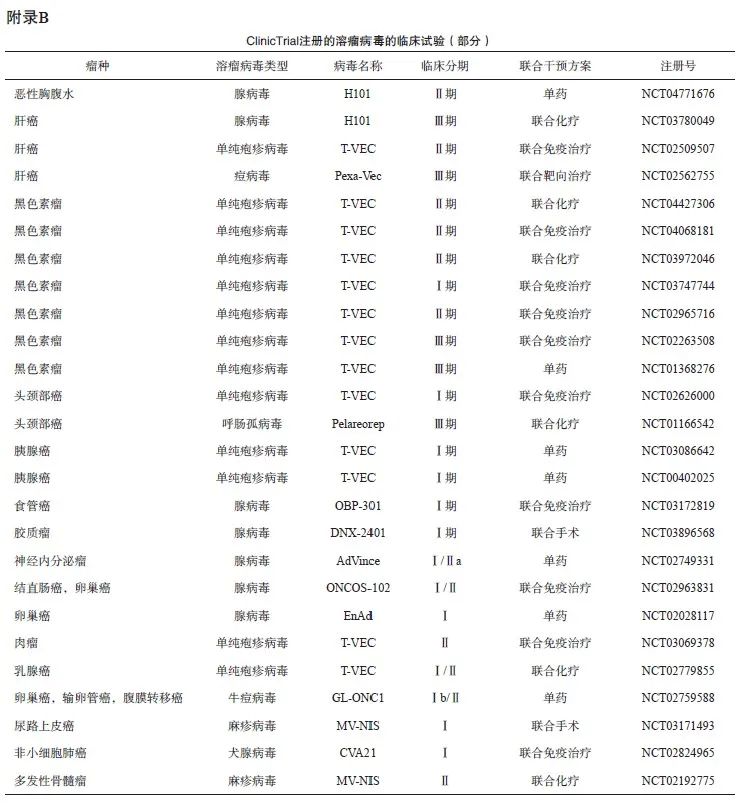
随着溶瘤病毒产品H101、T-VEC、G47△的相继获批上市以及联合疗法的发掘,溶瘤病毒在肿瘤治疗中发挥的作用日益突出,有望成为继传统化疗、靶向治疗后的突破性免疫治疗方法之一。截至2021年11月,在ClinicTrial.gov上注册的溶瘤病毒相关临床研究已达199个,其中Ⅲ期临床试验仅7个,除了本共识中提到的恶性肿瘤,溶瘤病毒在其他肿瘤,如非小细胞肺癌、乳腺癌、卵巢癌等患者中应用的研究也正在开展中;在众多联合治疗策略中,与其他免疫疗法联合抗肿瘤是溶瘤病毒颇受推崇的组合疗法之一(附录B)。虽然已进行了大量有关溶瘤病毒的基础和临床研究,但当前可用于临床治疗的溶瘤病毒类药物为数不多,远不能满足实际的临床需求,此外,溶瘤病毒与其他药物联合用药的疗效与安全性、给药顺序、时间间隔以及溶瘤病毒的最佳给药途径等问题仍未得到很好的解答。未来除了开展更多高质量临床试验以进一步扩展溶瘤病毒的适应证外,还应继续研发更加有效的溶瘤病毒药物,并探索溶瘤病毒与其他药物的联合治疗策略,从而更好地完善溶瘤病毒治疗方案,改善肿瘤患者的预后。
本共识基于国内外现有的文献证据及前期临床研究结果与专家共识,采用德尔菲问卷调查法,就基因重组溶瘤腺病毒的适用范围、使用方法、随访与疗效评估、国外已获批上市溶瘤病毒药物的适应证、未来溶瘤病毒药物的临床研究发展趋势等几个方面进行了系统评估,形成了更加量化精准的临床应用指导意见,有望为临床治疗恶性肿瘤、相关医疗管理部门制定医疗政策提供借鉴和参考。
利益冲突声明:所有作者均声明不存在利益冲突。
本文作者承诺:作者间、作者与审稿人间、与指南/共识中出现的药物或器械厂商之间无利益冲突;本共识制订过程中无第三方进行赞助。
[参考文献]
[1] HEMMINKI O, DOS SANTOS J M, HEMMINKI A. Oncolytic viruses for cancer immunotherapy[J]. J Hematol Oncol, 2020, 13(1): 84.
[2] JHAWAR S R, THANDONI A, BOMMAREDDY P K, et al. Oncolytic viruses-natural and genetically engineered cancer immunotherapies[J]. Front Oncol, 2017, 7: 202.
[3] SHAO X Y, WANG X K, GUO X L, et al. STAT3 contributes to oncolytic Newcastle disease virus-induced immunogenic cell death in melanoma cells[J]. Front Oncol, 2019, 9: 436.
[4] WANG X K, SHAO X Y, GU L, et al. Targeting STAT3 enhances NDV-induced immunogenic cell death in prostate cancer cells[J]. J Cell Mol Med, 2020, 24(7): 4286-4297.
[5] BREITBACH C J, ARULANANDAM R, DE SILVA N, et al. Oncolytic vaccinia virus disrupts tumor-associated vasculature in humans[J]. Cancer Res, 2013, 73(4): 1265-1275.
[6] COOK M, CHAUHAN A. Clinical application of oncolytic viruses: a systematic review[J]. Int J Mol Sci, 2020, 21(20): 7505.
[7] LI Y W, SHEN Y N, TANG T Y, et al. Oncolytic virus combined with traditional treatment versus traditional treatment alone in patients with cancer: a meta-analysis[J]. Int J Clin Oncol, 2020, 25(11): 1901-1913.
[8] LI Z B, JIANG Z J, ZHANG Y X, et al. Efficacy and safety of oncolytic viruses in randomized controlled trials: a systematic review and meta-analysis[J]. Cancers (Basel), 2020, 12(6): 1416.
[9] GARBER K. China approves world’s first oncolytic virus
therapy for cancer treatment[J]. J Natl Cancer Inst, 2006, 98(5): 298-300.
[10] 许 青, 陆 舜, 朱蕙燕, 等. 溶瘤病毒治疗恶性肿瘤临床应用上海专家共识(2021年版)[J]. 中国癌症杂志, 2021, 31(3): 231-240.
XU Q, LU S, ZHU H Y, et al. Shanghai expert consensus on clinical application of oncolytic virus in the treatment of malignant tumors (2021 edition)[J]. China Oncol, 2021, 31(3): 231-240.
[11] HASSETT M J, SOMERFIELD M R, BAKER E R, et al. Management of male breast cancer: ASCO guideline[J]. J Clin Oncol, 2020, 38(16): 1849-1863.
[12] 王春青, 胡 雁. J B I证据预分级及证据推荐级别系统 (2014版)[J]. 护士进修杂志, 2015, 30(11): 964-967.
WANG C Q, HU Y. JBI evidence pre-classification and evidence rank system (2014 edition)[J]. J Nurses Train, 2015, 30(11): 964-967.
[13] BISCHOFF J R, KIRN D H, WILLIAMS A, et al. An adenovirus mutant that replicates selectively in p53-deficient human tumor cells[J]. Science, 1996, 274(5286): 373-376.
[14] 蒋 泓, 刘 芳, 严爱芬, 等. 溶瘤病毒的肿瘤治疗作用研究[J]. 佛山科学技术学院学报(自然科学版), 2013, 31(2): 1-6.
JIANG H, LIU F, YAN A F, et al. The application of oncolytic virus to cancer therapy[J]. J Foshan Univ Nat Sci Ed, 2013, 31(2): 1-6.
[15]夏忠军, 常建华, 张 力, 等. 基因工程腺病毒(H101)瘤内注射联合化疗治疗头颈部及食管鳞癌的Ⅲ期临床研究[J]. 癌症, 2004, 23(12): 1666-1670.
XIA Z J, CHANG J H, ZHANG L, et al. Phase Ⅲ randomized clinical trial of intratumoral injection of E1B gene-deleted adenovirus (H101) combined with cisplatin-based chemotherapy in treating squamous cell cancer of head and neck or esophagus[J]. Chin J Cancer, 2004, 23(12): 1666-1670.
[16]陆永奎, 胡晓桦, 黎福祥, 等. 基因工程腺病毒(H101)瘤内注射联合化疗治疗鼻咽癌的疗效观察[J]. 中国肿瘤临床, 2005, 32(19): 1096-1099.
LU Y K, HU X H, LI F X, et al. Clinical observation of intratumoral injection of E1B gene-deleted adenovirus (H101) combined with chemotherapy in treatment of nasopharyngeal carcinoma[J]. Chin J Clin Oncol, 2005, 32(19): 1096-1099.
[17]中国医师协会介入医师分会. 中国肝细胞癌经动脉化疗栓塞治疗(TACE)临床实践指南[J]. 中华肝脏病杂志, 2019, 27(3)1117-1126
Interventional Physicians Branch of Chinese Medical Association. Chinese clinical practice guidelines for transarterial chemoembolization of hepatocellular carcinoma[J]. Chin J Hepatol, 2019, 27(3)1117-1126
[18]LIN X J, LI Q J, LAO X M, et al. Transarterial injection of recombinant human type-5 adenovirus H101 in combination with transarterial chemoembolization (TACE) improves overall and progressive-free survival in unresectable hepatocellular carcinoma (HCC)[J]. BMC Cancer, 2015, 15: 707.
[19]HE C B, ZHANG Y, LIN X J. Increased overall survival and decreased cancer-specific mortality in patients with hepatocellular carcinoma treated by transarterial chemoembolization and human adenovirus type-5 combination therapy: a competing risk analysis[J]. J Gastrointest Surg, 2018, 22(6): 989-997.
[20]陆吉麟, 张 浩, 石 伟, 等. 重组人5型腺病毒注射液局部瘤内注射治疗晚期肝癌的临床研究[J]. 中国现代医师, 2021, 59(12): 10-15.
LU J L, ZHANG H, SHI W, et al. Clinical research on topical intratumoral injection of recombinant human adenovirus type 5 in the treatment of advanced liver cancer[J]. China Mod Dr, 2021, 59(12): 10-15.
[21]XIE A Q, XIA F, PEI J, et al. Advanced hepatocellular carcinoma treated by radiofrequency ablation combined with oncolytic virus and anti-PD-1 antibody therapy: a case report and literature review[J]. J Int Med Res, 2021, 49(9): 3000605211044596.
[22]ANDTBACKA R H, KAUFMAN H L, COLLICHIO F, et al. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma[J]. J Clin Oncol, 2015, 33(25): 2780-2788.
[23]TODO T, ITO H, INO Y, et al. Intratumoral oncolytic herpes virus G47Δ for residual or recurrent glioblastoma: a phase 2 trial[J]. Nat Med, 2022, 28(8): 1630-1639.
[24]RASA A, ALBERTS P. Oncolytic virus preclinical toxicology studies[J]. J Appl Toxicol, 2022.
[25]徐雪丽, 张 伟, 胡又佳. 溶瘤病毒在肿瘤治疗中的研究进展[J]. 世界临床药物, 2014, 35(11): 710-716.
XU X L, ZHANG W, HU Y J. Research progress of oncolysis virus on tumor therapy[J]. World Clin Drugs, 2014, 35(11): 710-716.
[26]QUINN C, MA Q F, KUDLAC A, et al. Indirect treatment comparison of talimogene laherparepvec compared with ipilimumab and vemurafenib for the treatment of patients with metastatic melanoma[J]. Adv Ther, 2016, 33(4): 643-657.
[27]CHESNEY J, PUZANOV I, COLLICHIO F, et al. Randomized, open-label phase Ⅱ study evaluating the efficacy and safety of talimogene laherparepvec in combination with ipilimumab versus ipilimumab alone in patients with advanced, unresectable melanoma[J]. J Clin Oncol, 2018, 36(17): 1658-1667.
[28]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN guidelines®) non-small cell lung cancer (version 3, 2018)[EB/OL]. (2021-06-06)[2022-12-01]. www.nccn.org/patients.
[29]TODO T, MARTUZA R L, RABKIN S D, et al. Oncolytic herpes simplex virus vector with enhanced MHC class Ⅰ presentation and tumor cell killing[J]. Proc Natl Acad Sci U S A, 2001, 98(11): 6396-6401.
[30]Brain cancer. SNO 2019: the oncolytic herpes virus G47Δ may lead to a potential cure of malignant glioma[EB/OL]. (2019-02-02)[2022-12-10]. https://www.practiceupdate.com/content/sno-2019-the-oncolytic-herpes-virus-g47-may-lead-to-a-potential-cure-of-malignant-glioma/92833.
[31]LIU Y, CAI J, LIU W F, et al. Intravenous injection of the oncolytic virus M1 awakens antitumor T cells and overcomes resistance to checkpoint blockade[J]. Cell Death Dis, 2020, 11(12): 1062.
[32]ROJAS J J, SAMPATH P, HOU W Z, et al. Defining effective combinations of immune checkpoint blockade and oncolytic virotherapy[J]. Clin Cancer Res, 2015, 21(24): 5543-5551.
[33]FEND L, YAMAZAKI T, REMY C, et al. Immune checkpoint blockade, immunogenic chemotherapy or IFN-α blockade boost the local and abscopal effects of oncolytic virotherapy[J]. Cancer Res, 2017, 77(15): 4146-4157.
[34]XIE R Y, BI X G, SHANG B Q, et al. Efficacy and safety of oncolytic viruses in advanced or metastatic cancer: a network meta-analysis[J]. Virol J, 2021, 18(1): 158.
[35] BERNSTEIN V, ELLARD S L, DENT S F, et al. A randomized phase Ⅱ study of weekly paclitaxel with or without pelareorep in patients with metastatic breast cancer: final analysis of Canadian Cancer Trials Group IND.213[J]. Breast Cancer Res Treat, 2018, 167(2): 485-493.
[36] RIBAS A, CHESNEY J, LONG G V, et al. 1037O MASTERKEY-265: a phase Ⅲ, randomized, placebo (Pbo)-controlled study of talimogene laherparepvec (T) plus pembrolizumab (P) for unresectable stage ⅢB-ⅣM1c melanoma (MEL)[J]. Ann Oncol, 2021, 32: S868-S869.
[37] RIBAS A, DUMMER R, PUZANOV I, et al. Oncolytic virotherapy promotes intratumoral T cell infiltration and improves anti-PD-1 immunotherapy[J]. Cell, 2018, 174(4): 1031-1032.
[38] GUO J, CUI C L, WANG X, et al. A phase Ⅰb clinical trial of anti-PD-1 ab (toripalimab) plus intralesional injection of OrienX010 in stage melanoma with liver metastases[J]. J Clin Oncol, 2021, 39(15_suppl): 9559.
[39] WANG X, CUI C L, SI L, et al. A phase Ⅰb clinical trial of neoadjuvant OrienX010, an oncolytic virus, in combination with toripalimab in patients with resectable stage Ⅲb to stage ⅣM1a acral melanoma[J]. J Clin Oncol, 2021, 39(15_suppl): 9570.
[40] ZHAO H X, GUO X L, LIU Z Q, et al. Recombinant human adenovirus 5 injection plus toripalimab therapy in patients with advanced and refractory melanoma: a single arm, single-center, prospective study[J]. J Clin Oncol, 2022, 40(16_suppl): e21503.
[41] ZHANG Q N, LI Y, ZHAO Q, et al. Recombinant human adenovirus type 5 (Oncorine) reverses resistance to immune checkpoint inhibitor in a patient with recurrent non-small cell lung cancer: a case report[J]. Thorac Cancer, 2021, 12(10): 1617-1619.
[42] HE Y, CHEN J H, ZHU Z Z, et al. H101 treatment of hepatic metastasis of colorectal cancer with recombinant human adenovirus 5 injection: a phase Ⅰ clinical trial-TROJAN 021[J]. J Clin Oncol, 2021, 39(15_suppl): 3605-3605.
[43] GEEVARGHESE S K, GELLER D A, DE HAAN H A, et al. Phase Ⅰ/Ⅱ study of oncolytic herpes simplex virus NV1020 in patients with extensively pretreated refractory colorectal cancer metastatic to the liver[J]. Hum Gene Ther, 2010, 21(9): 1119-1128.
[44] CAFFERATA E G, MACCIÓ D R, LOPEZ M V, et al. A novel A33 promoter-based conditionally replicative adenovirus suppresses tumor growth and eradicates hepatic metastases in human colon cancer models[J]. Clin Cancer Res, 2009, 15(9): 3037-3049.
[45] CHIOCCA E A, ABBED K M, TATTER S, et al. A phase I open-label, dose-escalation, multi-institutional trial of injection with an E1B-attenuated adenovirus, ONYX-015, into the peritumoral region of recurrent malignant gliomas, in the adjuvant setting[J]. Mol Ther, 2004, 10(5): 958-966.
[46] 米中波, 焦保华. 重组人5型腺病毒术中瘤腔内注射治疗脑胶质瘤的安全性研究[J]. 河北医药, 2009, 31(14): 1760-1761.
MI Z B, JIAO B H. Study on the safety of intra-operative injection of recombinant human adenovirus type 5 in the treatment of glioma[J]. Hebei Med J, 2009, 31(14): 1760- 1761.
[47] LANG F F, CONRAD C, GOMEZ-MANZANO C, et al. Phase Ⅰ study of DNX-2401 (delta-24-RGD) oncolytic adenovirus: replication and immunotherapeutic effects in recurrent malignant glioma[J]. J Clin Oncol, 2018, 36(14): 1419-1427.
[48] 杨 帆, 卢 斌, 胡春燕, 等. 胸腔内注射重组人5型腺病毒治疗晚期肺癌恶性胸腔积液的疗效观察[J]. 实用医学杂志, 2013, 29(17): 2885-2886.
YANG F, LU B, HU C Y, et al. Therapeutic effect of intrathoracic injection of recombinant human adenovirus type 5 on malignant pleural effusion of advanced lung cancer[J]. J Pract Med, 2013, 29(17): 2885-2886.
[49] 王 维, 李枋霏, 肖彩芝, 等. 攻癌利水散外敷联合重组人5型腺病毒注射液胸腔内灌注治疗肺癌恶性胸水的临床疗效[J]. 中国老年学杂志, 2018, 38(21): 5184-5186.
WANG W, LI F F, XIAO C Z, et al. Clinical efficacy of external application of Gongailishui Powder combined with intrathoracic perfusion of recombinant human adenovirus type 5 injection in the treatment of malignant pleural effusion of lung cancer[J]. Chin J Gerontol, 2018, 38(21): 5184-5186.
[50] ZHANG Y L, QIAN L, CHEN K, et al. Intraperitoneal oncolytic virotherapy for patients with malignant ascites: characterization of clinical efficacy and antitumor immune response[J]. Mol Ther Oncolytics, 2022, 25: 31-42.
[51] LIU H L, CHEN J. Oncolytic virus as an agent for the treatment of malignant ascites[J]. Cancer Biother Radiopharm, 2009, 24(1): 99-102.
[52] ZHOU Y, WEN F, ZHANG P F, et al. Vesicular stomatitis virus is a potent agent for the treatment of malignant ascites[J]. Oncol Rep, 2016, 35(3): 1573-1581.
[53] HECHT J R, BEDFORD R, ABBRUZZESE J L, et al. A phase Ⅰ/Ⅱ trial of intratumoral endoscopic ultrasound injection of ONYX-015 with intravenous gemcitabine in unresectable pancreatic carcinoma[J]. Clin Cancer Res, 2003, 9(2): 555-561.
[54] 朱颖炜, 龚 镭, 吴高珏, 等. 超声内镜引导下瘤体内注射H101治疗胰腺癌疗效分析[J]. 南京医科大学学报(自然科学版), 2016, 36(10): 1166-1169.
ZHU Y W, GONG L, WU G J, et al. Therapeutic effects analysis of tumor injection of H101 guided by endoscopic ultrasonography for patients with pancreatic carcinoma[J]. J Nanjing Med Univ Nat Sci, 2016, 36(10): 1166-1169.
[55]MAHALINGAM D, WILKINSON G A, ENG K H, et al. Pembrolizumab in combination with the oncolytic virus pelareorep and chemotherapy in patients with advanced pancreatic adenocarcinoma: a phase Ⅰb study[J]. Clin Cancer Res, 2020, 26(1): 71-81.
[56]HIROOKA Y, KASUYA H, ISHIKAWA T, et al. A phase Ⅰ clinical trial of EUS-guided intratumoral injection of the oncolytic virus, HF10 for unresectable locally advanced pancreatic cancer[J]. BMC Cancer, 2018, 18(1): 596.
[57]DANSON S J, CONNER J, EDWARDS J G, et al. Oncolytic herpesvirus therapy for mesothelioma-a phase Ⅰ/Ⅱa trial of intrapleural administration of HSV1716[J]. Lung Cancer, 2020, 150: 145-151.
[58]DELAUNAY T, ACHARD C, BOISGERAULT N, et al. Frequent homozygous deletions of type Ⅰ interferon genes in pleural mesothelioma confer sensitivity to oncolytic measles virus[J]. J Thorac Oncol, 2020, 15(5): 827-842.
[59]ZHANG J, ZHANG Q Y, LIU Z, et al. Efficacy and safety of recombinant human adenovirus type 5 (H101) in persistent, recurrent, or metastatic gynecologic malignancies: a retrospective study[J]. Front Oncol, 2022, 12: 877155.
[60]ZHANG J, LIU Z, ZHANG Q Y, et al. Successful treatment of a 19-year-old patient with locally advanced clear cell adenocarcinoma of the uterine cervix using recombinant human adenovirus type 5 (Oncorine) combined with chemoradiotherapy: a case report[J]. Ann Transl Med, 2021, 9(23): 1747.
[61]HSU K F, WU C L, HUANG S C, et al. Conditionally replicating E1B-deleted adenovirus driven by the squamous cell carcinoma antigen 2 promoter for uterine cervical cancer therapy[J]. Cancer Gene Ther, 2008, 15(8): 526-534.
[62]DUAN Y X, BAI H X, LI X, et al. Oncolytic adenovirus H101 synergizes with radiation in cervical cancer cells[J]. Curr Cancer Drug Targets, 2021, 21(7): 619-630.
[63]KAGABU M, YOSHINO N, SAITO T, et al. The efficacy of a third-generation oncolytic herpes simplex viral therapy for an HPV-related uterine cervical cancer model[J]. Int J Clin Oncol, 2021, 26(3): 591-597.
[64]PACKIAM V T, LAMM D L, BAROCAS D A, et al. An open label, single-arm, phase Ⅱ multicenter study of the safety and efficacy of CG0070 oncolytic vector regimen in patients with BCG-unresponsive non-muscle-invasive bladder cancer: interim results[J]. Urol Oncol, 2018, 36(10): 440-447.
[65]BURKE J M, LAMM D L, MENG M V, et al. A first in human phase 1 study of CG0070, a GM-CSF expressing oncolytic adenovirus, for the treatment of nonmuscle invasive bladder cancer[J]. J Urol, 2012, 188(6): 2391-2397.
[66]ZHANG R, CUI Y X, GUAN X, et al. A recombinant human adenovirus type 5 (H101) combined with chemotherapy for advanced gastric carcinoma: a retrospective cohort study[J]. Front Oncol, 2021, 11: 752504.
[67]徐瑞华, 袁中玉, 管忠震, 等. 瘤内注射E1B缺失腺病毒治疗恶性肿瘤的Ⅱ期临床研究[J]. 中国癌症杂志, 2004, 14(1): 12-14.
XU R H, YUAN Z Y, GUAN Z Z, et al. Phase Ⅱ clinical study of intratumoral H101, an E1B deleted adenovirus, in patients with cancer[J]. China Oncol, 2004, 14(1): 12-14.
[68]李永强, 胡晓桦, 谢伟敏, 等. p14ARF、p53蛋白表达与H101治疗鼻咽癌疗效的关系[J]. 肿瘤, 2007, 27(5): 390-392.
LI Y Q, HU X H, XIE W M, et al. Relationship between the expressions of p14ARF and p53 proteins and the therapeutic efficacy of H101 on nasopharyngeal carcinoma[J]. Tumor, 2007, 27(5): 390-392.
[69]ROGULSKI K R, FREYTAG S O, ZHANG K, et al. In vivo antitumor activity of ONYX-015 is influenced by p53 status and is augmented by radiotherapy[J]. Cancer Res, 2000, 60(5): 1193-1196.
[70]NEMUNAITIS J, GANLY I, KHURI F, et al. Selective replication and oncolysis in p53 mutant tumors with ONYX-015, an E1B-55kD gene-deleted adenovirus, in patients with advanced head and neck cancer: a phase Ⅱ trial[J]. Cancer Res, 2000, 60(22): 6359-6366.
[71]MCCORMICK F. Interactions between adenovirus proteins and the p53 pathway: the development of ONYX-015[J]. Semin Cancer Biol, 2000, 10(6): 453-459.
[72]HEISE C, SAMPSON-JOHANNES A, WILLIAMS A, et al. ONYX-015, an E1B gene-attenuated adenovirus, causes tumor-specific cytolysis and antitumoral efficacy that can be augmented by standard chemotherapeutic agents[J]. Nat Med, 1997, 3(6): 639-645.
[73]GEOERGER B, GRILL J, OPOLON P, et al. Oncolytic activity of the E1B-55 kDa-deleted adenovirus ONYX-015 is independent of cellular p53 status in human malignant glioma xenografts[J]. Cancer Res, 2002, 62(3): 764-772.
[74]O’SHEA C C, JOHNSON L, BAGUS B, et al. Late viral RNA export, rather than p53 inactivation, determines ONYX-015 tumor selectivity[J]. Cancer Cell, 2004, 6(6): 611-623.
[75]李永强, 胡晓桦, 谢伟敏, 等. p53基因表达与H101治疗恶性肿瘤疗效的关系[J]. 广西医科大学学报, 2006, 23(6): 951-952.
LI Y Q, HU X H, XIE W M, et al. Relationship between p53 gene expression and therapeutic effect of H101 on malignant tumor[J]. J Guangxi Med Univ, 2006, 23(6): 951-952.
[76]WANG C J, XIAO C W, YOU T G, et al. Interferon-α enhances antitumor activities of oncolytic adenovirus-mediated IL-24 expression in hepatocellular carcinoma[J]. Mol Cancer, 2012, 11: 31.
[77] YING L, CHENG H, XIONG X W, et al. Interferon alpha antagonizes the anti-hepatoma activity of the oncolytic virus M1 by stimulating anti-viral immunity[J]. Oncotarget, 2017, 8(15): 24694-24705.
[78] HAINES B B, DENSLOW A, GRZESIK P, et al. ONCR-177, an oncolytic HSV-1 designed to potently activate systemic antitumor immunity[J]. Cancer Immunol Res, 2021, 9(3): 291-308.
[79] BREITBACH C J, BURKE J, JONKER D, et al. Intravenous delivery of a multi-mechanistic cancer-targeted oncolytic poxvirus in humans[J]. Nature, 2011, 477(7362): 99-102.
[80] FREEMAN A I, ZAKAY-RONES Z, GOMORI J M, et al. Phase Ⅰ/Ⅱ trial of intravenous NDV-HUJ oncolytic virus in recurrent glioblastoma multiforme[J]. Mol Ther, 2006, 13(1): 221-228.
[81] NEMUNAITIS J, CUNNINGHAM C, BUCHANAN A, et al. Intravenous infusion of a replication-selective adenovirus (ONYX-015) in cancer patients: safety, feasibility and biological activity[J]. Gene Ther, 2001, 8(10): 746-759.
[82] SHEN A, LIU S H, YU W Q, et al. p53 gene therapy-based transarterial chemoembolization for unresectable hepatocellular carcinoma: a prospective cohort study[J]. J Gastroenterol Hepatol, 2015, 30(11): 1651-1656.
[83] REID T, GALANIS E, ABBRUZZESE J, et al. Hepatic arterial infusion of a replication-selective oncolytic adenovirus (dl1520): phase Ⅱ viral, immunologic, and clinical endpoints[J]. Cancer Res, 2002, 62(21): 6070-6079.
[84] DE GRAAF J F, HUBERTS M, FOUCHIER R A M, et al. Determinants of the efficacy of viro-immunotherapy: a review[J]. Cytokine Growth Factor Rev, 2020, 56: 124-132.
[85] HARRINGTON K, FREEMAN D J, KELLY B, et al. Optimizing oncolytic virotherapy in cancer treatment[J]. Nat Rev Drug Discov, 2019, 18(9): 689-706.
[86] BOMMAREDDY P K, SHETTIGAR M, KAUFMAN H L. Integrating oncolytic viruses in combination cancer immunotherapy[J]. Nat Rev Immunol, 2018, 18(8): 498-513.
[87] TIAN G, LIU J L, ZHOU J S, et al. Multiple hepatic arterial injections of recombinant adenovirus p53 and 5-fluorouracil after transcatheter arterial chemoembolization for unresectable hepatocellular carcinoma: a pilot phase Ⅱ trial[J]. Anticancer Drugs, 2009, 20(5): 389-395.
[88] 袁中玉, 张 力, 李 苏, 等. E1B缺失腺病毒瘤内注射治疗恶性肿瘤的安全性研究[J]. 癌症, 2003, 22(3): 310-313.
YUAN Z Y, ZHANG L, LI S, et al. Safety of an E1B deleted adenovirus administered intratumorally to patients with cancer[J]. Chin J Cancer, 2003, 22(3): 310-313.
[89] 徐瑞华, 袁中玉, 管忠震, 等. 瘤内注射E1B缺失腺病毒(H101)与化疗联合治疗恶性肿瘤的Ⅱ期临床试验[J].癌症, 2003, 22(12): 1307-1310.
XU R H, YUAN Z Y, GUAN Z Z, et al. Phase Ⅱ clinical study of intratumoral H101, an E1B deleted adenovirus, in comb ination with chemotherapy in patients with cancer[J]. Chin J Cancer, 2003, 22(12): 1307-1310.
[90] GORADEL N H, BAKER A T, ARASHKIA A, et al. Oncolytic virotherapy: challenges and solutions[J]. Curr Probl Cancer, 2021, 45(1): 100639.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#期刊论坛#
44