Nat Med:最新临床试验表明基因治疗早期过程可能导致血液干细胞的癌症相关突变
2023-12-19 测序中国 测序中国 发表于上海
研究团队使用全基因组测序追踪了参与SCD基因治疗临床试验的6名SCD患者治疗前、后的造血干细胞(HSC)DNA,绘制了基因修饰和未修饰HSC的体细胞突变和克隆图谱。
近日,美国FDA宣布批准CRISPR/Cas9基因编辑疗法Casgevy上市,用于治疗镰状细胞病(SCD),预计于2024年3月30日前做出是否批准其β地中海贫血适应证的决定。此前的11月16日,英国MHRA全球首次批准Casgevy有条件上市,用于治疗SCD和输血依赖性β地中海贫血(TDT)。Casgevy的获批为新一代基因编辑技术的发展树立了信心。
虽然已有研究成果及上述监管批准表明,基因疗法有可能极大地造福遗传性血液疾病患者,但近期一项针对SCD临床试验参与者的分析研究显示,在治疗前进行的一个关键过程可能会导致突变,使血液干细胞更有可能癌变。
由美国约克大学领导的国际研究团队已将相关研究发表成果在Nature Medicine上,文章题为“Clonal selection of hematopoietic stem cells after gene therapy for sickle cell disease”。研究团队使用全基因组测序追踪了参与SCD基因治疗临床试验的6名SCD患者治疗前、后的造血干细胞(HSC)DNA,绘制了基因修饰和未修饰HSC的体细胞突变和克隆图谱。在6名患者的血液干细胞样本中检测到癌症相关突变迹象。基因治疗后的“驱动突变”数量比之前要高;与髓系肿瘤或克隆造血(HSC)相关的潜在驱动突变(特别是DNMT3A和EZH2突变克隆)在转基因和未修饰细胞中都观察到频率增加,表明突变克隆在基因治疗期间呈正向选择。
该研究揭示了SCD中基因治疗后HSC克隆动态和突变图谱,突出了一些先前存在驱动突变HSC的适应性增强。研究团队表示,这表明需要进行长期研究来确定细胞是如何继续进化的。

文章发表在Nature Medicine
文章共同通讯作者、波士顿儿童医院David Williams医学博士认为:“从长远来看,基因疗法在治疗SCD等遗传疾病方面具有巨大的潜力,了解这一过程如何影响血液干细胞的生长对其安全性至关重要。”
SCD是一种遗传性疾病,患者的血红蛋白会发生病理变化导致红细胞硬化,呈“镰刀”状,过早死亡。在死亡之前,这些镰刀状红细胞可能会粘在一起,阻塞血液流动,导致严重的并发症,例如感染、中风和剧烈疼痛。基因疗法提供了一种解决方案,通过改变患者的基因,纠正潜在的突变,或使其表达一种健康的血红蛋白。
在这项临床试验中,6名患者年龄在7-26岁,均被诊断为严重的SCD,并接受了GT治疗。该临床试验(NCT03282656)利用plerixafor-mobilized的CD34+外周血细胞,转导嵌入microRNA(shmiR)中的短发夹RNA(shRNA),敲除BCL11A基因,导致γ-球蛋白表达的去抑制和胎儿血红蛋白的诱导表达。研究团队采集了所有患者基因治疗前后不同时间点的血液干细胞样本进行分析。
研究团队分析了SCD患者的体细胞突变。结果显示,在治疗前的样本中,6名患者中有4名患者的突变负荷与这些患者年龄匹配的个体相比显著升高(图1a)。所有患者都没有普遍的新突变特征,表明疾病本身似乎与特定的突变过程无关。
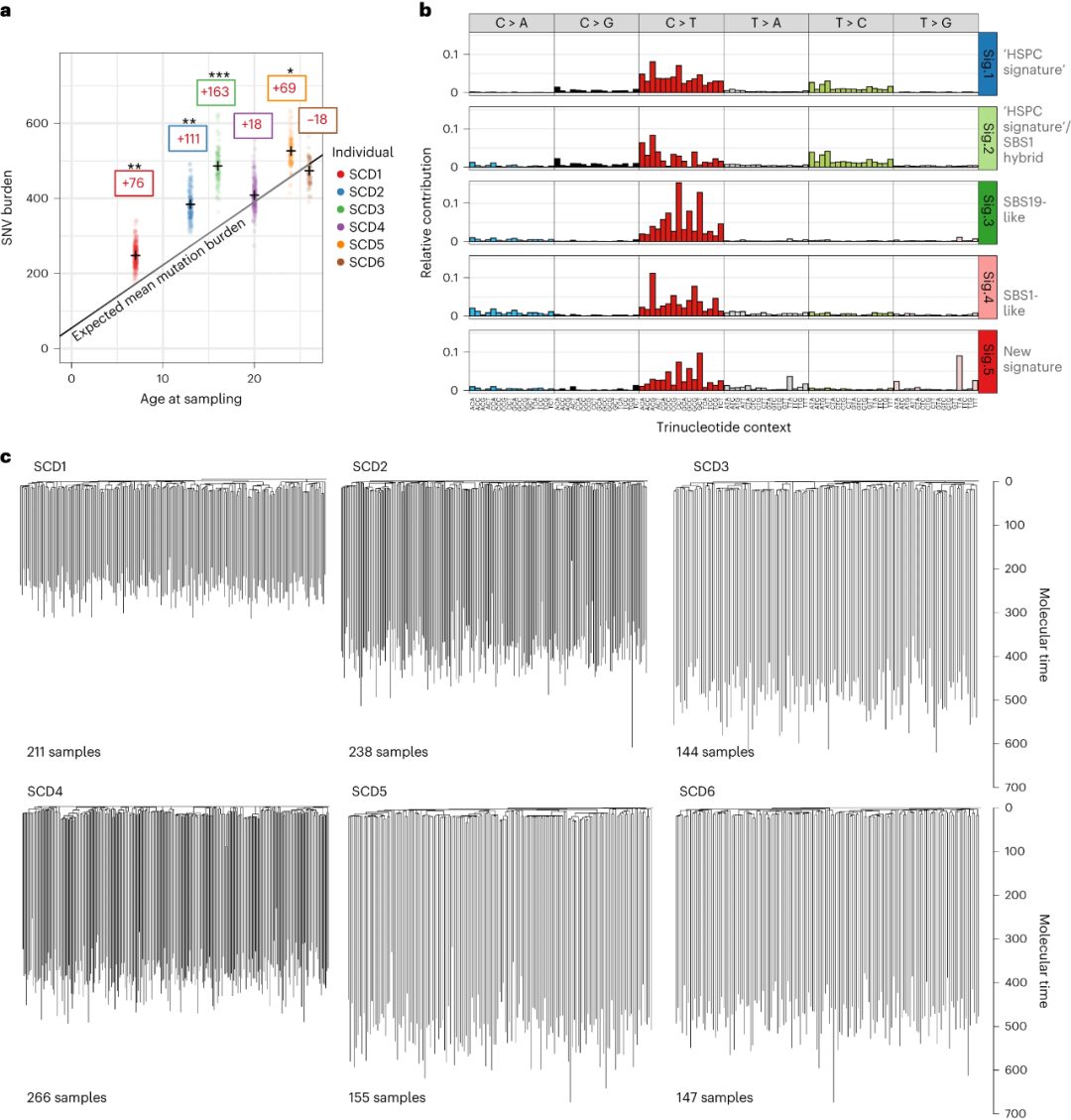
图1.SCD中体细胞突变。
研究团队比较了治疗前和治疗后的HSC突变负荷,以确定细胞制造、慢病毒整合和治疗所需的操作是否诱导突变。平均而言,与治疗前样本相比,治疗后的突变负荷在每个HSC中增加了9至42个SNV(图2a);当根据正常衰老进行调整时,研究发现除了患者1之外的任何SCD患者在治疗前后之间没有显著的突变负荷差异。SCD患者1比同龄人多了14个突变,相当于健康个体衰老约1年(图2b)。没有证据表明GT操作诱导了额外的不良事件(图2c)。
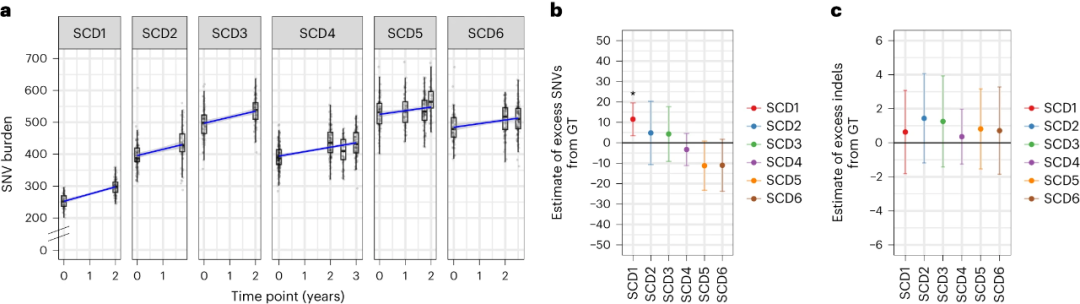
图2.基因治疗诱导了少量额外的体细胞突变。
研究团队还分析了基因治疗前后造血干细胞的驱动突变。数据显示,基因治疗后携带可能的驱动基因突变的colonies比例从基因治疗前的0.1%增加到基因治疗后的0.8%。虽然正常老化可能有所贡献,但预计仅基因治疗后样本的短期随访(最长3年)不会导致可检测的驱动基因突变增加。
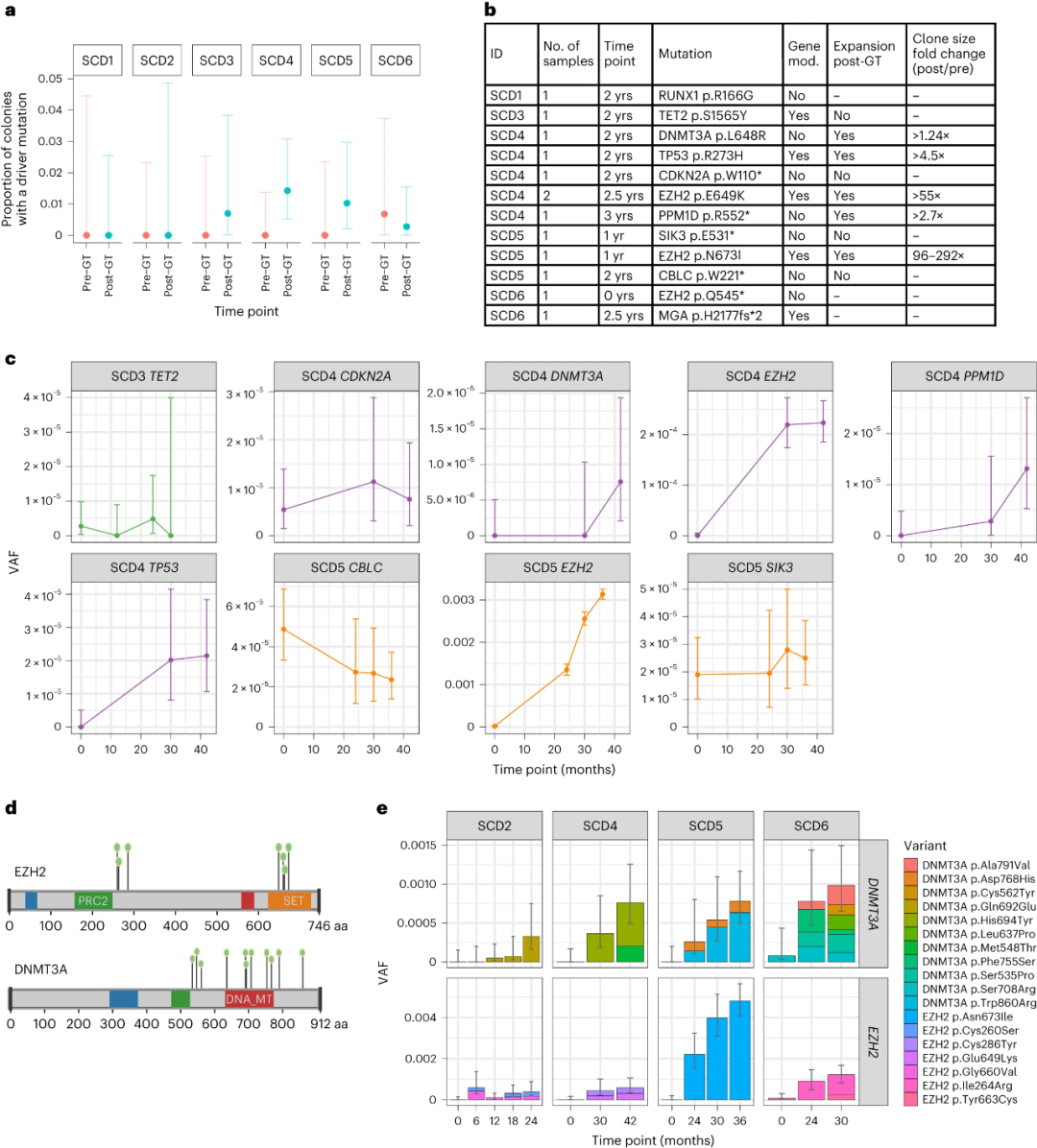
图3.含有驱动突变的colonies比例在基因治疗后增加。
总体来说,在基因治疗之前,患者的系统发育树是高度多克隆的,每个细胞的突变负荷在部分患者中升高。基因治疗后,基因修饰或未修饰的细胞均未发现克隆扩增。但与髓系肿瘤或克隆造血相关的潜在驱动突变,特别是DNMT3A和EZH2突变克隆,在转基因和未修饰细胞中都观察到频率增加,表明突变克隆在基因治疗期间呈正向选择,这可能与在基因治疗或移植过程中的离体操作有关。
研究人员指出,治疗本身并不是导致突变的原因。相反,这些突变似乎来自该过程的早期:为了编辑SCD患者的血液干细胞以产生胎儿血红蛋白,必须将干细胞从骨髓中取出,以便在体外编辑基因。然后编辑过的干细胞被注入体内,以克隆扩增方式增殖,并产生正确形式的血红蛋白。
共同通讯作者、约克大学研究员David Kent博士表示:“研究显示,基因治疗对不同的血液干细胞进行选择,这可能有利于携带某些突变的干细胞生长,而这反过来可能导致携带这些突变的血细胞扩增。”潜在病理驱动突变数量的增加表明,这些突变可能有助于细胞的生存。虽然目前尚不清楚其临床意义是什么,但监测这些变化是有必要的。
Williams指出,这也表明,在SCD患者积累大量驱动基因突变之前,对其进行治疗可能是值得考虑的事情。“值得注意的是,该研究显示,在干细胞基因突变较少的年轻患者中,其治疗后并没有表现出强烈的突变迹象,表明患者在更年轻的年龄接受基因治疗可能更安全、更有效,但需要做大量的工作来验证。”
此外,研究数据表明,预先存在的克隆通常远低于标准临床测序技术的检测极限,使得通过这些方法进行筛选的实用性受到限制。目前,没有确凿的证据表明低VAF突变(只有高度敏感的测序平台才能检测到)与癌症风险增加有关。因此,需要进行讨论以确定是否应该使用高敏感性方法来筛选患者并限制潜在治愈性自体疗法的资格。
目前,各种疾病的基因治疗越来越多地为患者提供,仅在美国就有数百项临床试验在进行。开创性的研究为使用基因治疗难治性单基因疾病奠定了基础,镰状细胞已经成为基因治疗开发者的一个有竞争力的适应症。该研究使用全基因组测序探索了SCD和基因治疗对造血干细胞的遗传影响,强调了在部分SCD患者中突变率的升高,以及部分携带预先存在的驱动突变的HSC的适应性增强,或有可能增加SCD基因治疗试验中白血病风险。
参考资料:
1.Spencer Chapman, M., Cull, A.H., Ciuculescu, M.F. et al. Clonal selection of hematopoietic stem cells after gene therapy for sickle cell disease. Nat Med (2023). https://doi.org/10.1038/s41591-023-02636-6
2.https://www.fiercebiotech.com/research/sickle-cell-gene-therapy-process-may-cause-cancer-linked-mutations-blood-stem-cells
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#基因治疗# #镰状细胞病# #血液干细胞#
45