专家述评:如何更好地识别多系统萎缩
2022-10-14 ANDs ANDs
多系统萎缩很容易误诊为帕金森病或其他不典型帕金森病,由于他们不但具有相同的病理改变,临床表现亦有许多相似之处,所以早期诊断比较困难。
多系统萎缩
多系统萎缩(multiple system atrophy,MSA)是一种少见、原因不明的、进行性神经系统变性疾病。少突胶质细胞内包涵体形成是此病的特征性病理学改变,早期临床表现为多系统受累,特别是早期出现严重的自主神经功能障碍包括泌尿系统和心血管系统。MSA临床早期诊断比较困难,容易与帕金森病(PD)、路易体痴呆(DLB)和其他不典型PD等神经变性病相混淆。因为它们具有相同的病理改变,均有突触核蛋白(α-synuclein)沉积,临床表现亦有许多相似之处。近期研究表明自主神经功能障碍是该病早期临床的突出表现,且占有很大的比例,所以,MSA诊断需要强调对自主神经功能障碍的早期识别。与PD和其他非典型PD相比,MSA在疾病进展、多巴胺能药物反应及动态影像学改变等方面也有其较明显的临床特征。为了让临床医师更好地识别MSA,我们就这一领域进展进行综述。
01流行病学
MSA发病率约3.4-4.9例/10万人,40岁以上上升为7.8例/10万人,通常60岁以后发病,无明显性别差异。从起病至死亡的自然病程约为6-10年,较PD病程(约为13.2年)短,极少数患者生存期可超过15年。从发病到需要辅助行走、依赖轮椅、卧床不起和死亡的平均时间分别为3、5、8和9年。猝死和感染(肺炎和泌尿系感染)为MSA患者最常见的死亡原因。关于对MSA认识的演变过程,经历了几个重要的里程碑事件:1900年首次提出橄榄脑桥小脑萎缩(OPCA);1969年首次提出MSA概念;1989年首次描述该疾病的病理特征;1998年MSA共识标准首次公布;2003年欧洲多系统萎缩研究组建立了统一多系统萎缩评估量表;2015年,提出MSA关键性特征是早期出现且严重的自主神经功能衰竭。
02MSA自主神经功能障碍的特点
自主神经功能障碍在MSA发病中最先出现且较PD表现全面、程度较重。主要原因如下:(1)PD系自主神经中枢与外周神经同时受累,以节后纤维病变受累为主,而MSA属于中枢交感神经节前纤维病变,严重程度远重于PD。(2)MSA病理突出特点是脑干不同分布区域的自主神经核发生病变,与PD相比,MSA病变受累神经的数量更多,程度更广泛,导致自主神经功能障碍更加严重。例如MSA患者延髓腹外侧的儿茶酚胺能神经元变性丢失,要比PD和纯自主神经功能不全(PAF)都要严重,造成心血管自主神经功能障碍更明显。通过经典的MSA相关临床症状与其相应的病变解剖结构相衔接,阐明了MSA自主神经功能障碍的病理生理过程,见表1。依据MSA自主神经核受累的不同区域,重点介绍MSA常见的临床症状及表现:
 1泌尿系统障碍
1泌尿系统障碍
(1)勃起功能障碍(ED):几乎所有男性患者均存在ED,且近37%-48%可为首发症状。回顾性研究报道,男性MSA患者在出现其他症状之前,ED即已经存在了5-10年。女性则表现外生殖器敏感度降低,达47%,而PD仅有4%。
(2)排尿困难:表现为尿急、尿频、尿失禁以及膀胱排空障碍,这些症状早期常不易被患者发现或重视,初始往往容易就诊泌尿科。
2心血管系统
发生率比泌尿生殖功能障碍低,且可以无症状或症状轻微。可以出现体位性低血压(OH),近半数患者还伴有餐后低血压(PPH)或夜间高血压(NH),需加强识别,临床表现还有反复晕厥、眩晕、头痛等,有时还可以颈肩为中心样疼痛(又称衣架样疼痛)。另外,还需要注意排除其他疾病导致的OH,比如糖尿病自主神经病变、类淀粉样变性、药物性等因素。OH的定义采用的是1999年Gilman标准:受试者安静仰平卧5min后迅速站立1min,收缩压下降>30mmHg和(或)舒张压下降>15mmHg(1mmHg-0.133kPa),即可诊断为OH。需要说明的是如果OH在站立3min后发生,则称之为迟发型OH。临床还需要注意,单独一次的测量,患者未达到OH诊断标准,并不能完全除外OH诊断,需要反复、多次、不同地点的测量,以验证OH的诊断。
3其他系统
呼吸系统受累常表现为夜间喘鸣和阻塞性睡眠呼吸暂停,主要是疑核神经元变性,导致喉肌失神经支配,喉展肌麻痹而诱发,但也可由声带的肌张力障碍引发。快速眼动睡眠行为障碍(RBD)亦是MSA重要临床表现之一,有时可以在MSA临床诊断前10-15年出现,它的发生与脑桥核病变有关。关于嗅觉测试,有研究发现嗅觉保留或轻度受损可能与非典型帕金森病(AP)相关,特别是原发性PD患者90%嗅觉减退或丧失。
欧洲MSA协会,曾经对来自十个国家的19个中心的437例MSA患者,进行了临床特征的汇总分析、结果:男性52.8%,女性47.2%,平均起病年龄57.8岁,平均病程5.8年,其中59%诊断可能MSA,46%符合很可能MSA标准。排尿功能障碍比OH更常见,PD(87%)症状比小脑性共济失调(64%)更常见。99%患者存在自主神经功能障碍,泌尿系统症状占83%,其中急性尿失禁73%,不全膀胱排空48%,ED84%;OH75%,晕厥19%,慢性便秘33%;神经精神症状与睡眠障碍,抑郁症41%、幻觉5.5%、痴呆4.5%、失眠19%、白天嗜睡17%、不宁腿10%。另外,锥体束征和腱反射活跃体征在MSA中并不常见,其中巴氏征阳性为28%,腱反射活跃为43%。上述研究为我们了解MSA临床特征的多样性及复杂性提供了依据。
03辅助检查
1影像学特点:
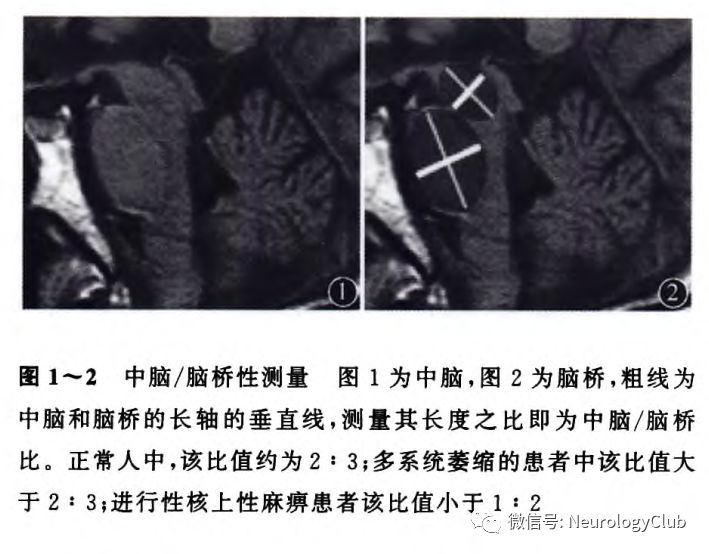
MSA早期头颅影像学会出现一些特征性表现,如十字征和裂隙征。十字征是因为脑桥横行纤维和小脑中脚的纤维变性和神经胶质增生使其含水量增加,形成MRI的T2加权像上脑桥的十字形高信号影。Deguchi等研究表明,3T MRI上质子密度加权像(PDWI)较T2WI能更加清晰的显示“十字征”,梯度回波序列(T2*WI)比T2WI在发现MSA“十字征”更为敏感。有时临床疑似MSA,但头颅MRI不支持,可以每半年至1年定期复查。裂隙征表现为壳核外侧边缘高信号,与壳核低信号、萎缩,黑质铁沉积增多有关。临床上“十字征”有时并非MSA特有,还可见于其他神经系统疾病,例如脊髓小脑性共济失调(SCA)、副肿瘤综合征等,一定要结合临床和影像学资料,综合分析。另外,还有报道可通过测量中脑/脑桥比,有助于MSA、PD、进行性核上性麻痹(PSP)三者的鉴别,见图1-2。近年来,131I间碘苄胍(131I-MIBG)检查越来越多运用于临床,也有助于PD与MSA的鉴别,其特异性较高。这是因为131I-MIBG可被心脏交感神经节后纤维摄取,PD属于外周交感神经节后纤维受损,MSA属于中枢交感神经节前纤维受损。所以MSA患者心脏摄取率正常或略下降,而PD患者心脏摄取率明显下降。
 2肛门括约肌肌电图(EAS-EMG)特点
2肛门括约肌肌电图(EAS-EMG)特点
MSA患者神经元的脱失在EMG上表现为时限延长、多相波百分比增多、出现自发电位或卫星电位等神经源性损害,这主要是与Onuf核神经元病变有关。但需要指出的是MSA早期阶段,Onuf核的参与似乎不突出,存在时间依赖性特点,故EMG阴性结果也不能完全排除MSA诊断,而且神经源性损害还可以见其他疾病,如PD、圆锥马尾病变等。Tison等提出平均时限13ms对鉴别MSA和PD具有较好的灵敏度和特异度。Vodusek提出以5年时限为界来鉴别MSA与PD:如果发病5年以后,EMG仍正常,则可排除MSA。
3认知功能的评价
随着对MSA研究的深入,发现MSA患者可以合并认知功能障碍,但均在病情的中晚期出现。目前早期诊断标准中并未包括认知功能障碍,而将痴呆列为不支持诊断标准。Stankovic等强调,大约1/3的MSA患者存在认知损害,特别是额叶执行功能如注意力缺陷和工作记忆能力下降。临床应首选简易精神状态核查量表(MMSE)和蒙特利尔认知评估量表(MoCA)量表进行初筛,以明确是否存在轻度认知损害或痴呆。还可以由神经心理医师进行言语功能、视空间能力和额叶执行功能的测验,同时进行抑郁和焦虑情绪评价,这有助于对MSA患者认知功能障碍进行早期诊断和治疗。
04MSA的诊断及鉴别诊断
2015年Fanciulli和Gregor提出新的诊断共识。临床根据帕金森病症状和小脑性共济失调症状为主的临床表现,将MSA分为MSA-P型和MSA-C型,即帕金森型和小脑型,但各型之间临床表现有交叉和重叠。MSA-P型病理上属于纹状体黑质的退行性变,临床主要是一种快速进展的运动不能-僵硬综合征,其特征是运动减少且缓慢,并伴有肌肉僵硬和被动运动抵抗。而MSA-C型病理上属于脑桥小脑萎缩的退行性变,临床表现为进行性步态和肢体共济失调,从下肢开始,且以下肢的表现为突出。实际临床当中,许多患者会表现出混合表型。而在对左旋多巴治疗不敏感性帕金森症状或小脑性症状为诊断前提下,自主神经功能障碍严重程度是可能MSA和很可能MSA诊断之间最重要的区分点。如存在尿失禁(男性存在勃起功能障碍)或OH收缩压下降≥30mmHg或舒张压下降≥15mmHg,称为自主神经功能衰竭,支持很可能MSA诊断,反之,未到达自主神经功能衰竭标准,称为可能MSA。
对于MSA与PD的鉴别,除了前面的影像学等方面,临床还可以通过一些非运动症状进行区分见表2。PD往往是尿频、尿急,很少尿失禁,而MSA首先是ED,其次是排尿困难,最后是OH。其次,从起病年龄、病程及病情进展速度上看,二者也有一些差别:(1)MSA起病年龄更早;(2)MSA患者药物疗效维持时间更短;(3)从出现运动症状到发生频繁跌倒、导尿、构音障碍或吞咽困难、依赖轮椅等系列发生事件,MSA患者在较短的时间间隔出现。因MSA病程进展快,早期出现自主神经功能障碍的患者预后不良,对多巴胺能药物治疗反应差也有互助于二者的鉴别。多数临床医生认为MSA对左旋多巴反应不敏感而放弃应有的治疗,但有研究表明40%以上MSA患者可能有效,应该通过逐渐增加剂量进行试治>3个月(如果患者可耐受,每天左旋多巴剂量可达1000mg/d以上),故早期诊断及干预极为重要。除了一线药物左旋多巴外,多巴胺受体激动剂作为二线用药推荐,但要关注用药后低血压、恶心、水肿等不良反应。金刚烷胺作为三线用药,可逐渐增加到100mg,3次/d,但如果症状不缓解,建议尽早停用。MSA非运动症状的治疗更需要引起关注,例如对伴神经源性膀胱症状的MSA患者需常规筛查泌尿系感染;间断置管治疗是残余尿量>100ml尿潴留患者的一线疗法;对伴有严重抑郁、焦虑的患者可选择5-羟色胺再摄取抑制剂,该药发生OH和尿潴留不良反应低。
 05总结与展望
05总结与展望
总之,MSA临床诊断很容易与其他类型神经变性疾病相混淆,特别是PD,早期识别较困难。应该注意以下关键几点:(1)MSA早期自主神经功能障碍临床表现最为突出,尤其泌尿系统和心血管系统症状,占有较大的比例,对早期识别有极大的帮助;(2)MSA发病年龄较PD和其他非典型PD早;(3)病情进展快,尤其是非运动症状;(4)如果动态复查影像学,对MSA诊断更有帮助。但因MSA临床异质性明显,尤其MSA与PD的重叠性比较大,还有待大家进一步临床验证,对于早期鉴别困难的,病程很重要,建议随访,观察药物疗效及动态监测影像学,寻找临床诊断支持证据。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言