UICC/IASLC/AJCC 胸腺肿瘤第九版 TNM 分期解读:改变与传承
2024-01-01 于丰浩,谷志涛,茅腾,许宁,章雪飞,郝秀秀,方文涛 中国胸心血管外科临床杂志 发表于上海
2023年9月于新加坡落下帷幕的世界肺癌大会公布了第九版胸腺肿瘤TNM分期。新版分期基于更庞大、全面的数据库,对胸腺肿瘤的TNM分期进行了修改和验证,目的是使第九版TNM分期在更具统计学力度的同时,也
于丰浩,谷志涛,茅腾,许宁,章雪飞,郝秀秀,方文涛
上海市胸科医院 胸外科(上海 200030)
摘要
2023年9月于新加坡落下帷幕的世界肺癌大会公布了第九版胸腺肿瘤TNM分期。新版分期基于更庞大、全面的数据库,对胸腺肿瘤的TNM分期进行了修改和验证,目的是使第九版TNM分期在更具统计学力度的同时,也拥有更强的临床可操作性。而第九版分期的推出,也必将会对胸腺肿瘤将来的临床工作、科研带来改变。
恶性肿瘤的TNM分期基于原发灶(T)、淋巴结转移(N)、远处转移(M)的解剖基础对肿瘤进行分期划分,是实体肿瘤应用最广泛的分期方式,也是全球众多医务工作者的共同语言和肿瘤学临床诊疗、研究的根基。在2023年9月召开的世界肺癌大会上,国际肺癌协会(International Association for the Study of Lung Cancer,IASLC) 分期委员会公布了最新的国际抗癌联盟/美国癌症联合会(Union for International Cancer Control/American Joint Committee on Cancer,UICC/AJCC)TNM胸腺肿瘤分期,距第八版TNM分期的正式使用间隔将近7年。本文将集中对新版分期的数据依据以及新旧分期之间的变化和传承进行说明,并就其对临床工作的指导意义和对未来分期工作提供的经验进行分析。
1 胸腺肿瘤分期背景
胸腺上皮肿瘤作为一种罕见、相对惰性的实体肿瘤,针对其开展的临床研究一直面临病例数少、终点事件数少、随访时间长等问题,因此既往的分期系统也存在构建数据量小、以经验性为主的缺陷。从上个世纪60 年代开始,曾先后出现过10 多种胸腺肿瘤的分期系统,其中应用最广泛的Masaoka-Koga分期也只是基于单中心不到100例患者的5年随访结果[1],虽然此分期在临床上得到较好验证,但由于其固有的缺陷,不能很好地反映临床的具体情况和对不同患者进行精密区分。
鉴于胸腺肿瘤长期缺乏TNM 分期这一问题, IASLC和国际胸腺肿瘤协会(International Thymic Malignancy Interest Group,ITMIG)两大全球性组织,在UICC和AJCC的同意和支持下,于2010年成立了胸腺肿瘤分期和预后委员会 (Staging and Prognostic Factors Committee-Thymic Domain, SPFC-TD),拟利用全球多中心、多组织提供的数据,打造属于胸腺肿瘤的TNM分期。第八版胸腺肿瘤TNM 分期于2014 年面世,该分期建立在来自全球105家中心、共8 145 例患者的临床、生存数据的基础上,其中1 031例来自当时的中国胸腺肿瘤研究协作组(Chinese Alliance for Research in Thymomas,ChART)。第八版分期首次为胸腺瘤、胸腺癌、胸腺神经内分泌肿瘤建立了具有较强数据基础、国际统一的共同语言[2]。
第八版分期的建立对于胸腺肿瘤具有划时代的意义,很快得到全球医学界的支持和使用,其较高的临床可行性也快速得到了外部验证[3]。但在广泛的接受和支持中也存在质疑:第八版分期正式使用1年后,SPFC-TD针对分期的使用情况向全球217家中心发放调查问卷;调研结果显示,虽然78%的中心支持TNM分期的使用,但是临床医生认为第八版分期中的部分分类缺乏依据、需要改进[4]。由于第八版分期使用的数据库存在某些项目数据有限、早期晚期病例数据失衡等缺点,部分分类的划分只能基于实用性、解剖位置、逻辑推理给出专家共识,而并非完全基于统计学的差异。这是第八版分期留下的最大遗憾,也自然成为第九版分期工作的一个重要出发点:以第八版分期作为修订的参考,在新数据库和既有证据的支持下,使第九版TNM 分期更具有统计学力度,并兼顾临床意义。因此,分期委员会在制定第九版分期时,提出遵守解剖学基础、不使分期过度复杂化、在临床和病理学上都能进行评估以及在所有国家都具备可行性几项基本原则;并且提出在新分期的修订过程中要前瞻性地挖掘未来分期验证、修订所需的数据[5]。
2 第九版分期的数据来源
第九版分期的数据来自全球13家组织和机构,共收集了11 347 例患者数据,时间跨度超过50 年(1965—2021年),确保随访时间充足。在去除随访信息缺失和病理类型不明确的病例后,共有9 147例患者纳入最终分析,相比于第八版分期的8 145例病例有进一步扩充。9 147例患者中胸腺瘤患者7 662例,占总体的83.8%(图1)。数据的主要来源地为亚洲地区,其中中国抗癌协会纵隔肿瘤专业委员会的全国多中心回顾性和前瞻性数据库分别提供了1 172例和343 例患者[6]。相比于第八版,此次使用的数据库不仅总数据量有所提升、病例时间跨度延长,而且淋巴结转移和远处转移的晚期患者数量也有显著增加,但仍存在以亚洲病例为主导(占62%)、以手术治疗病例为主(占97%)的特征。
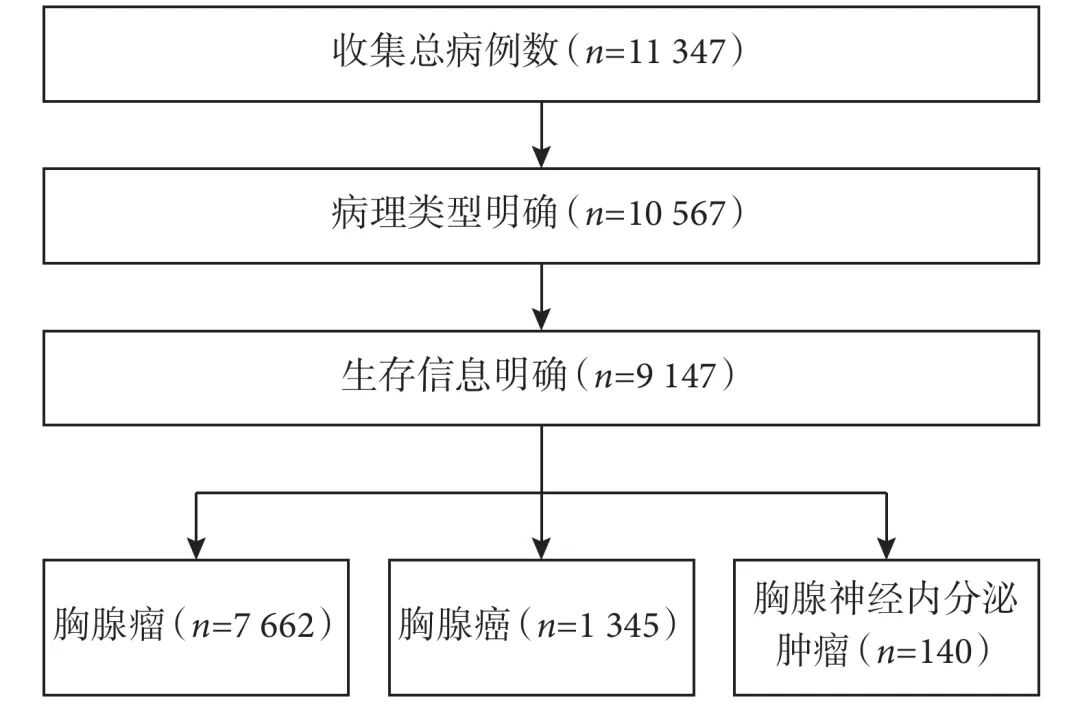
图 1 第九版UICC/IASLC/AJCC胸腺肿瘤TNM分期最终纳入分析的患者例数
3 第九版分期的变与不变
如前所述,新分期并非单纯追求改变,还需要对既往的分期进行验证。一个良好的分期不仅要做到期别之间存在明显区分有统计学差异、期别内部有较好的一致性,还要做到与前一版分期有较好的延续性,并且实现临床价值和临床可操作性间的均衡。同时,TNM分期需要维持其普适性原则,不仅应适用于不同国家、地区、医院,而且也应适用于所有的病理类型。正如肺癌分期不会区分鳞癌与腺癌,胸腺肿瘤分期也不会区分瘤与癌,只要同一个分期在所有瘤种里达到相似的预后区分即可。
基于这些要求,第九版分期利用更为全面的临床数据和复发、生存结果,对既往的TNM 分期进行了重新划分和组合,进一步贯彻不同期别间差异明显、同一期别内部高度一致的原则;而对于既往更多是出于经验进行的分类划分则利用前所未有的大病例组数据给予验证和肯定。同时,由于胸腺肿瘤相对比较惰性,早期胸腺肿瘤手术完整切除后有不易复发、复发时间较晚、复发后仍然可以获得长期生存、死亡病例以非肿瘤相关原因为主的特点。例如 ChART 数据库中手术完整切除的 Ⅰ ~ Ⅲ a 期 胸 腺 肿 瘤 患 者 , 1 0 年 总生 存 (overall survival,OS)高达 89.5% ;基于这部分患者的复发信息建立的复发预测模型将T1期的所有胸腺瘤以及T2期、T3 期的A、AB、B1型胸腺瘤划分为转移风险低危组,而T2期、T3期的B2、B3 型胸腺瘤以及所有的胸腺癌和神经内分泌肿瘤划分为转移风险高危组,前者的复发率为2.7%,而后者则高达20.1%[7]。因此出于对胸腺肿瘤特殊生物学行为的考虑,对于早期胸腺肿瘤使用肿瘤无复发率(freedom from recurrence,FFR)作为划分的终点,相比于生存更加能反映早期胸腺肿瘤临床上的治疗结果;而对于晚期胸腺肿瘤则参照其他恶性实体肿瘤使用OS作为划分的终点。充足的数据和合理的划分终点保证了新分期拥有坚实的统计学基础。
3.1 以肿瘤大小决定T1a期和T1b 期
第八版分期以是否侵犯纵隔胸膜把局限在前纵隔胸腺及其周围脂肪的早期肿瘤划分为T1a期和T1b期。而第九版分期则第一次将肿瘤大小纳入T分期中,在T1 分期中做出了以下更改:以5 cm为界限,局限在胸腺以及周围脂肪的胸腺肿瘤,肿瘤直径≤5 cm为T1a期,>5 cm为T1b 期(表1)[5]。

将肿瘤大小纳入分期是建立在新的数据库中肿瘤大小的数据较第八版数据库更加齐全的基础上,通过在训练数据集中选取可以区分预后的肿瘤大小临界值,在验证数据集中进行验证。最终所选取、验证的临界值为4.5~9.0 cm,而所取5 cm是在借鉴既往研究[8]结果后的人为设定。对比>5 cm和≤5 cm的T1期肿瘤的OS 和FFR可发现,在胸腺瘤中,前者OS和FFR都显著低于后者(P均<0.05);而在胸腺癌中,前者和后者的OS和FFR 有数值差别,但差异无统计学意义。由于T2 期、T3期、T4 期患者数量较少,无法在这些分期中进行验证,同时考虑到肿瘤外侵程度对预后的影响远大于肿瘤本身的大小,在第九版分期中肿瘤大小的区分仅用于T1 期早期肿瘤中[9]。
胸膜侵犯虽然在新的数据库中也有区分T1 期肿瘤预后的作用,但在新分期中仅作为额外的病理学表述(additional histologic descriptor),而不作为T1a期和T1b期的区分标准。其中最主要的原因是分期委员会T分期小组认为胸膜侵犯无论是术前临床影像还是术后病理评估均有一定难度,因此利用一个在临床上难以判断的因素作为标准可行性较差。但胸膜侵犯也不应因新分期的改变而被忽视,在ICCR(International Collaboration of Cancer Reporting)最新提出的胸腺肿瘤手术切除标本的汇报标准中,肿瘤直接侵犯(包括胸膜侵犯)是汇报的10 项“核心因素”之一[10]。这提醒临床工作者,尤其是外科医生和病理科医生,在对标本处理和检查上应有更好的沟通和交流,外科医生应注重手术切除标本上纵隔胸膜的标注,以便病理科医生在镜下对肿瘤是否浸润穿透胸膜弹力层进行判断;同时,临床医生也应探索如何通过影像组学手段提高术前对胸膜侵犯判断的准确性。
3.2 对T2期和T3期的修改
第八版中的T2 期为心包侵犯,T3期为肺、膈神经、胸壁、头臂静脉、上腔静脉以及心包外的肺动静脉受侵。第九版分期则将肺与膈神经从T3期中移除,降至T2期(表1)[5]。
既往临床实践中,肺实质的局部侵犯以及膈神经的侵犯相比其他T3期结构的侵犯在临床处理方面有较大不同,这一点在外科手术上体现得最为明显:心包、局部肺、膈神经的侵犯更易完整切除,即使在微创手术下也有较大可行性;而静脉系统和心包外肺血管的侵犯则可能会导致更多的非R0 切除或开放手术。此前谷志涛等[11]针对这一点在进展期胸腺肿瘤微创对比开放的研究中,创新性地使用了切除指数(resection index,RI)对原T3 期结构进行了较好的手术难度划分,其RI 所采用的计算方式与新分期T2期、T3 期的重新划分不谋而合。
既往Masaoka-Koga分期中局部进展期肿瘤均列入Ⅲ期,非常混杂;UICC/IASLC/ITMIG第八版分期利用T分期概念将常规手术无法切除的肿瘤划分为T4期,首次将原发肿瘤按照手术切除可能性进行了区分[1];而第九版分期则进一步将肺与膈神经等易于手术完整切除的结构与胸壁、大血管等切除难度较高的结构进行了细分。通过利用新数据对原本T2期/T3期患者的预后进行分析发现,在胸腺瘤中,肺和膈神经的侵犯相比于其他T3 期结构的侵犯,虽然OS差异无统计学意义,但有更好的FFR:在R0 切除且N0M0期的前提下,前者的5年FFR为82%,后者为70%;在胸腺癌中,相比于其他T3N0M0期,侵犯肺/膈神经的T3N0M0期患者与仅侵犯心包的T2N0M0期在R0切除后有更加接近的FFR:侵犯心包、侵犯肺/膈神经和侵犯其他原T3 期结构患者的5年FFR 分别为50%、 61%和41%[9]。T2 期、T3期的修改无疑做到了不同分期间差异明显、同一分期内部高度统一,但在细节方面仍存在着美中不足,比如局部肺实质侵犯和广泛肺实质侵犯的区分,新T3 期内部的继续划分,单侧、双侧膈神经侵犯的区分,这些问题都因第九版数据库中病例数据缺乏相应的细节项而无法做出更进一步的划分。
膈神经和肺实质侵犯的分类下降,必将成为临床治疗改变的催化剂。首先在手术方面,此举将进一步推动外科医生对进展期胸腺肿瘤微创手术的探索和尝试。在中国抗癌协会胸腺肿瘤诊疗指南中,UICCⅠ期胸腺肿瘤推荐微创手术,在微创技术较为成熟的大的临床中心,对UICC Ⅱ~Ⅲa期(第八版)可尝试进行微创胸腺手术[12]。此推荐来自于部分胸外科中心对于进展期胸腺肿瘤微创手术的成功尝试,希望未来可以有多中心、随机对照的研究结果支持微创手术在进展期胸腺肿瘤中的使用。其次,T2 期、T3期的修改可能会推动胸腺肿瘤术后辅助治疗的变化。对于局部进展期胸腺肿瘤完整切除后的辅助治疗,各个指南、组织、中心都有不同的推荐, NCCN指南中,Masaoka-KogaⅢ 期的胸腺瘤R0 切除后建议术后放疗[13];ITMIG的回顾性研究[14]结果则提示Masaoka-KogaⅡ~Ⅲ 期 R0切除的胸腺瘤患者,术后放疗组10年OS明显高于未放疗组(86% vs. 79%,P=0.002);而日本胸腺肿瘤研究协作组的研究则发现术后辅助放疗仅对Ⅲ期胸腺癌患者有益[15]。中国抗癌协会胸腺肿瘤诊疗指南则推荐R0 切除后,UICCⅠ期的胸腺瘤和Ⅱ~ⅢA期(第八版)的A、AB、B1型胸腺瘤,不进行术后辅助治疗,UICC Ⅱ~ⅢA(第八版)的B2、B3 型胸腺瘤,可考虑术后辅助放疗或随访[12]。鉴于目前为止所有的回顾性研究都是基于以往的分期系统,希望新分期的推出有助于基于T分期的细分行进一步的研究,为未来胸腺肿瘤辅助治疗策略提供高级别的新证据。
3.3 对N分期、M分期的继承
第九版分期将继续沿用第八版分期中关于淋巴结和远处转移的分期(表2)。鉴于第八版分期数据存在着晚期病例较少、分类依赖专家共识的问题,第九版分期在胸腺肿瘤淋巴结和远处转移所做的工作是利用总体病例数更庞大、阳性病例更丰富的新数据库,对第八版分类进行验证[16-17]。

由于第八版数据库淋巴结转移阳性的病例有限,将胸腺肿瘤淋巴结转移分为位于前纵隔的N1期和居于纵隔深处和颈部的N2期并非完全出自统计分析,而是基于以下几点:第一是解剖位置上远近的猜测,N1 期为前纵隔胸腺内的淋巴结, N2期为深纵隔和更远的淋巴结;第二为手术摘除的困难程度不同,N1 期淋巴结通过全胸腺切除可以一并去除,而N2 期淋巴结的摘除则需要额外的操作;第三则为是否有足够可用的数据将不同N分期的预后进行区分[18]。第九版数据库中淋巴结信息的完整度明显提高,病理学淋巴结信息存在的病例数占74.6%(6 820/9 147),但治疗前临床淋巴结信息存在的病例仅占25.3%(2 317/9 147),一定程度上反映了胸腺肿瘤基于影像对淋巴结转移情况判断的困难。病理学N1(pN1)期阳性患者有168例、病理学N2 期(pN2)阳性患者123 例,相比于第八版的75 例pN1和68例pN2 有大幅度增加。由于胸腺肿瘤淋巴结转移并非常见事件,因此在新的数据库中病理淋巴结阴性(pN0)和临床淋巴结阴性(cN0)有较高的一致性,两者的占比分别为89.0%和97.7%;而病理淋巴结阳性(pN+)和临床淋巴结阳性(cN+)之间的一致性则较低,一定程度上由于临床医生对于胸腺肿瘤术前淋巴结状态的忽视以及缺乏较好的手段判断术前淋巴结状态。第九版数据库显示淋巴结转移率在不同病理类型中有明显差异:在胸腺瘤中占1.5%,在胸腺癌中占17.6%,在胸腺神经内分泌肿瘤中占27.7%。此与既往来自ChART多中心回顾性数据库得到的结果一致;而此前ChART前瞻性多中心观察性研究结果也表明,术中主动清扫淋巴结的胸腺肿瘤病例淋巴结转移比例较回顾性数据库中报道的结果显著增高,相比于胸腺瘤,胸腺癌和胸腺神经内分泌肿瘤更容易发生淋巴结转移[19-20]。
利用新的数据库对既往N 分期进行验证:在胸腺癌中,pN1 病例的OS明显低于pN0(P= 0.017),pN2病例的OS也明显低于pN1(P= 0.006);在胸腺瘤中,pN1 病例的OS 明显低于pN0(P<0.001),pN2和pN1 的OS相近(P=0.85)。这些结果肯定了第八版分期N0、N1、N2的分类,为N分期维持不变提供了充足的证据。SPFC-TD N分期小组就此提醒临床工作者今后应进一步重视胸腺肿瘤治疗前淋巴结状态评估、手术中加强对高级别和进展期肿瘤的淋巴结清扫、术后进行细致的病理评估,提高分期准确性,指导预后判断和治疗选择,并为未来第十版分期的修订提供更为详实的数据基础。
对于胸腺肿瘤的远处转移,第八版分期借鉴了既往Masaoka-Koga分期对于不同转移方式机制的猜想以及临床处理方式的不同,将胸膜、心包播散分类为M1a,肺实质、远处器官转移分类为M1b,但两者在生存曲线上仅存在肉眼的区分[18]。在新的数据库中,cM1a病例数为101 例,cM1b病例数为29 例;pM1a的病例数为326 例,pM1b的病例数为155例。临床上判断有转移的胸腺瘤和胸腺癌的病例仅有69.1% 和51.0% 接受了手术治疗,再加上M0 病例所占比例较高,导致cM和pM之间的一致性不高:胸腺瘤和胸腺癌中分别有76%和53%的cM1a最后诊断为pM1a,14%和33% 的cM1b最后诊断为pM1b。
由于cM 数据较少,新分期仅利用pM数据对既往M分期进行验证。在胸腺瘤中, pM1a的OS和FFR 均显著低于pM0[HR=3.23,95%CI (2.38, 4.55),P<0.001;HR=14.30,95%CI(9.09,43.00), P<0.001];在胸腺癌中,pM1a的FFR 显著低于pM0[HR=2.63,95%CI(1.33,5.26),P=0.004],但OS差异无统计学意义。在胸腺瘤和胸腺癌中,并未找到pM1a和pM1b间显著的OS或FFR差异。另外,分期委员会对同一分期内部不同描述进行了进一步分析,结果发现,对于pM1a期胸腺瘤患者,胸膜播散、心包播散或兼具两者的OS无明显差异;对于pM1b期胸腺瘤患者,肺转移和胸外转移的OS也无明显差异;但对于pM1a期胸腺癌患者,胸膜播散的OS有优于心包播散和兼具两者的趋势。由于有细节分类的数据量过少以及将M1a和M1b继续细分的证据尚不充足,第九版分期将维持第八版分期提出的M分期。但与此同时,分期委员会也基于临床实践对未来的M分期进行了猜测和畅想。在治疗上,单一胸腔、远处转移患者,相比多发胸腔、远处转移患者,更容易通过局部治疗获得较好的治疗效果,得到较好的预后;而一侧胸腔多发转移和双侧胸腔、远处多发转移在治疗效果上也有不同。因此,分期委员会将在未来探讨是否有将M分期划分为单一的种植或转移、同侧多发转移、双侧和远处多发转移的可能性。
4 总结和展望
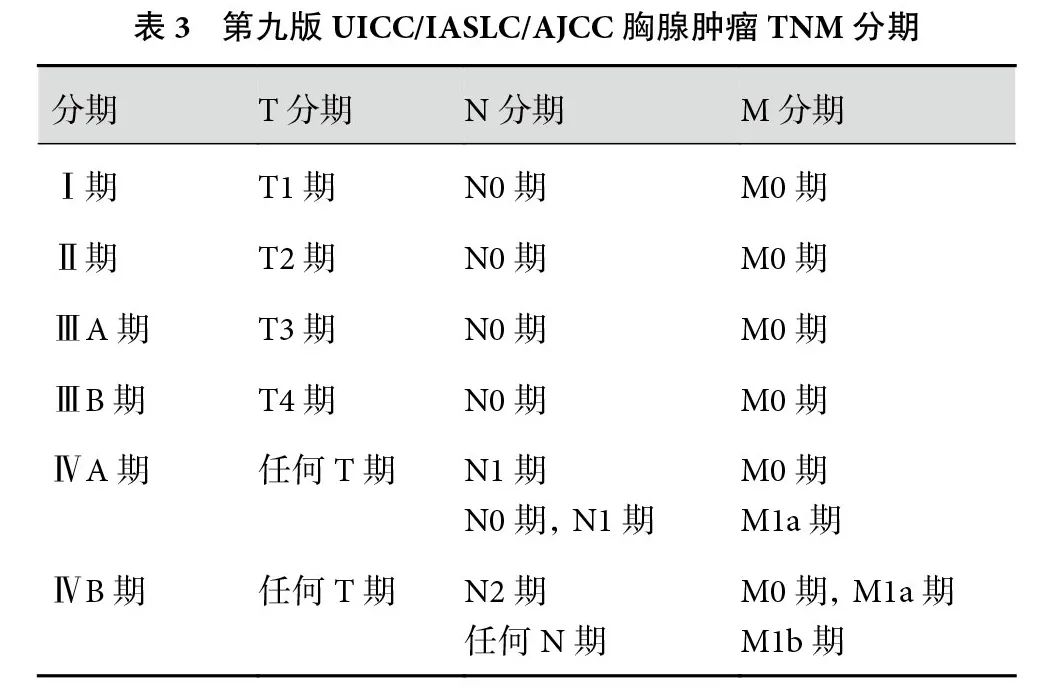
总之,胸腺肿瘤的第九版分期基于全新的数据,对第八版分期进行了验证传承和修订更新,将T1a和T1b 期的区分从纵隔胸膜的侵犯更改为肿瘤大小,将肺侵犯、膈神经侵犯降至了T2 期;而N、 M分类保持不变,整体的TNM 分期组合维持不变(表3)。其中的变是根据更大量、更全面的数据进行更有意义的区分,这种意义不仅仅是统计学层面,更体现在临床应用上;而不变则是通过新的数据对既往经验层面上的划定进行统计学验证,有力地说明了其合理性。这些改变也提醒临床医生在诊断和治疗方面需要不断进行相应的思考、改变和提高,比如如何提高临床分期判断的准确性,如何采取有效的手段发现隐匿的淋巴结和远处转移,从而为患者提供合适的治疗模式;如何以分期的改变作为出发点,对局部进展期患者的手术治疗、辅助治疗甚至新辅助治疗优化选择。同时,新分期的提出也促使医生用临床一线发现的问题、得到的数据对分期进行进一步的验证和改进。
虽然第九版分期在上一版的基础上做到了改革和继承齐头并进,但此次收集的数据仍存在诸多问题:1/4的病例缺少病理学分期信息,3/4的病例缺少临床分期信息;虽然晚期病例和前瞻性的病例数增加,但接受手术切除病例和来自回顾性数据库的病例仍占绝大部分,导致数据库中的病例仍以相对早期的病例为主,且在数据质量方面难以把控;一些细节变量的高频率缺失以及部分分组数据丰度较低,比如胸腺癌和神经内分泌肿瘤病例较少,转移病例缺少转移数量、位置等细节。这些问题导致临床医生面临的一些困扰没有得到全部解答,比如肺侵犯范围是否应在分期中进行细分,N2 中的各站淋巴结是否有相同的预后价值,转移的数量和位置是否应该加入分期中,胸腔内播散和其他远处脏器转移是否应该有所区分等,这些问题可能需要更庞大、更精细的数据进行回答。同时,第九版数据库中的病例仍存在较大的地区性差异,并且非手术病例较少,无法更好地覆盖晚期胸腺肿瘤的预后。要克服这些缺陷,不仅需要更加紧密的全球范围内多组织、多中心的合作,而且对各个组织、中心提供的数据质量也提出了更高的要求。在ICCR最新提出的胸腺肿瘤手术切除标本的病理报告标准中,有10项“核心元素”和8 项“非核心因素”,被认为与胸腺肿瘤的临床管理、分期、预后息息相关[10],能否以此作为基石和启发,为胸腺肿瘤分期数据录入提供统一、详细的模板,组建更高质量的数据库,或将成为克服第九版分期缺陷的重要武器。
利益冲突:无。
作者贡献:于丰浩负责内容构思和文章撰写;谷志涛、茅腾、许宁、章雪飞、郝秀秀负责文章修改意见的提出;方文涛负责文章思路构架的提出以及提供文章修改意见。
原始出处:
引用本文:于丰浩,谷志涛,茅腾,等. UICC/IASLC/AJCC 胸腺肿瘤第九版 TNM 分期解读:改变与传承. 中国胸心血管外科临床杂志, 2024, 31(2). doi: 10.7507/1007-4848.202311063
Yu FH, Gu ZT, Mao T, et al, Change and continuity: on the 9th UICC/IASLC/AJCC TNM staging system for thymic tumors. Chin J Clin Thorac Cardiovasc Surg, 2024, 31(2). doi: 10.7507/1007-4848.202311063
作者介绍
通信作者 方文涛

上海市胸科医院胸外科主任、肺癌外科主任、上海市交通大学食管专病诊治中心主任、交通大学医学院博士导师。
学术任职:中国抗癌协会纵隔肿瘤专业委员会名誉主任委员、中华胸心外科学会肺癌专家组委员、中国抗癌协会食管癌专业委员会副主任委员、中国医师协会胸外科分会常务委员及微创外科专家委员会副主任委员、中国医药教育协会肺部肿瘤专业委员会副主任委员、上海市医学会外科学组委员;同时担任国际肺癌研究会(IASLC)会员和胸部肿瘤分期委员会(SPFC)执行委员及多学科临床科学委员会委员、国际胸腺瘤研究会(ITMIG)执行委员会委员、国际食管疾病协会(ISDE)会员、欧洲胸心外科协会(EACTS)胸外科部执行委员会委员、美国胸心外科协会(AATS)会员、亚洲胸心血管外科协会(ASCVTS)胸外科部执行委员会委员。担任《Mediastinum》杂志主编、《Shanghai Chest》执行主编、《Journal of Thoracic Diseases》副主编和《Journal of Thoracic and Cardiovascular Surgery》、《Annals of Thoracic Surgery》、《Frontiers in Surgery》、《Chinese Medical Journal》、《Gastroenterology Research》等SCI期刊编委、《中华外科杂志》、《中华胸心血管外科杂志》、《中国胸心血管外科临床杂志》等核心期刊编委。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#TNM分期# #胸腺肿瘤# #方文涛# #胸腺上皮肿瘤#
32