


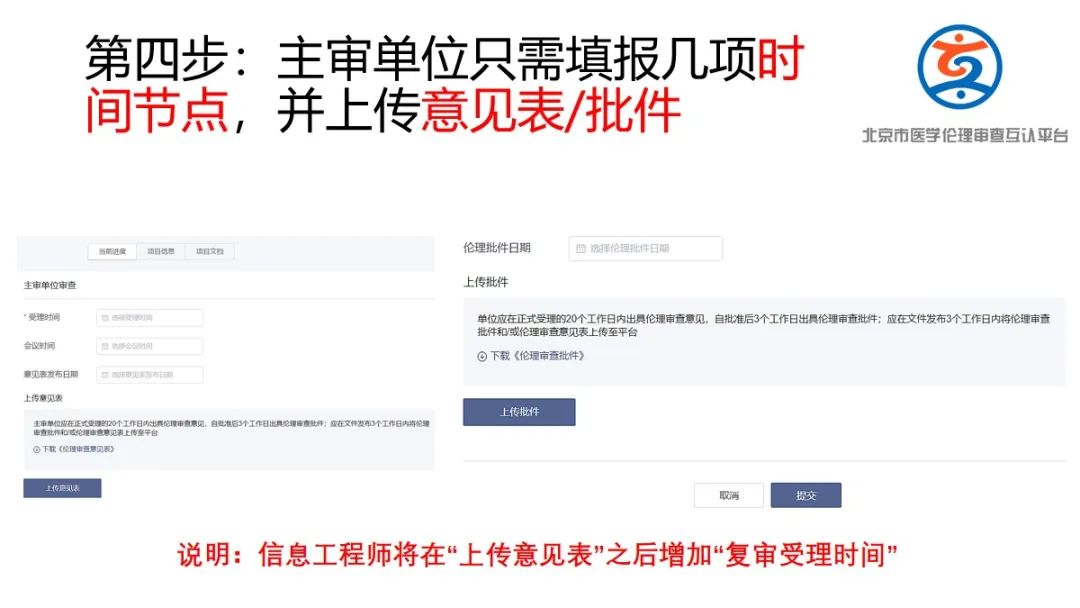




联盟互认卫健委平台信息录入方法
符合以下条件的项目进行互认项目信息录入
(1) 15家医院内既有组长单位,又有参与单位(至少1家)
(2) 组长单位即将或已通过伦理审查;
(3) 参与单位还未伦理审查。
信息录入方法:
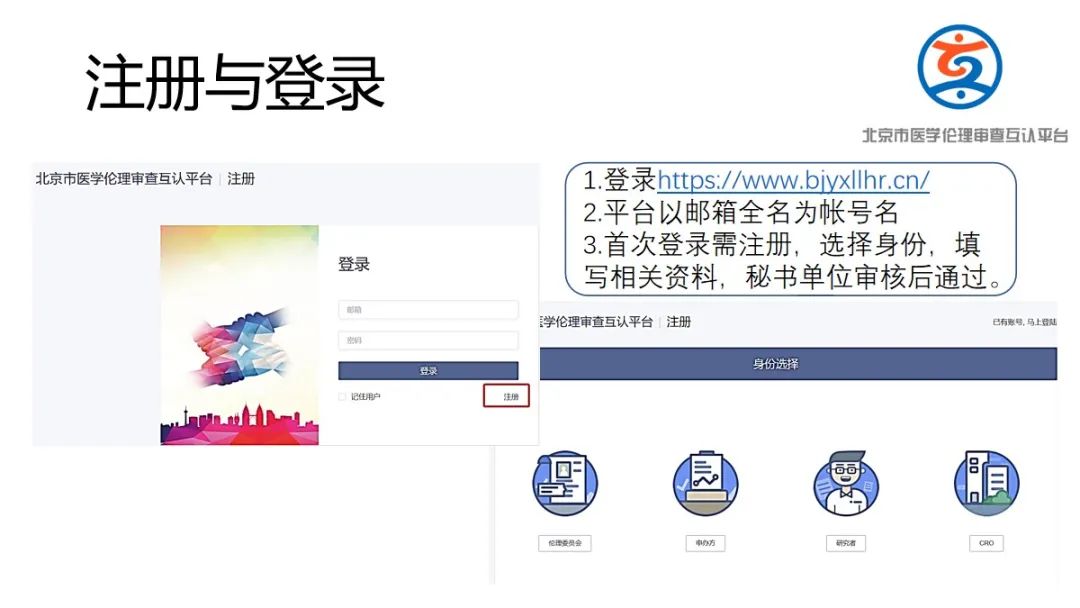
(1)请组长单位将“北京市医学伦理审查互认平台”网址(https://www.bjyxllhr.cn/) 告知申办方/CRO/主要研究者;
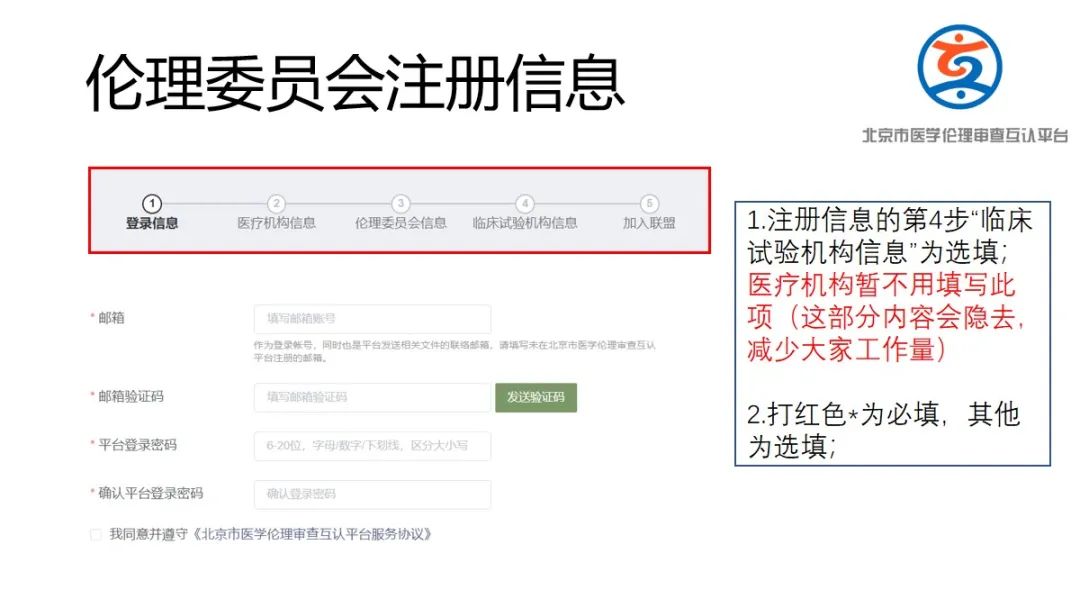
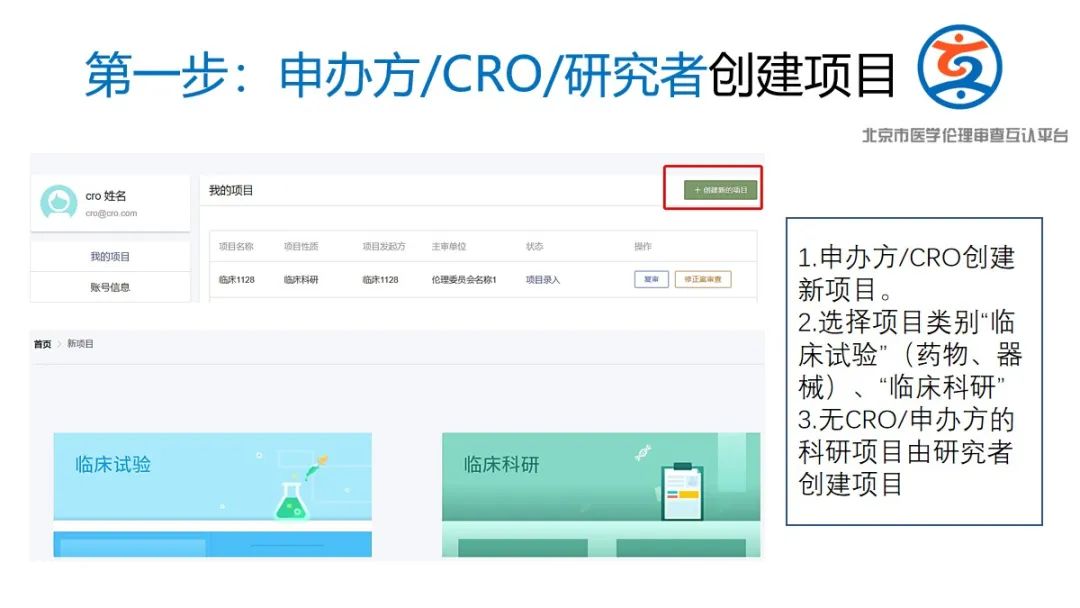
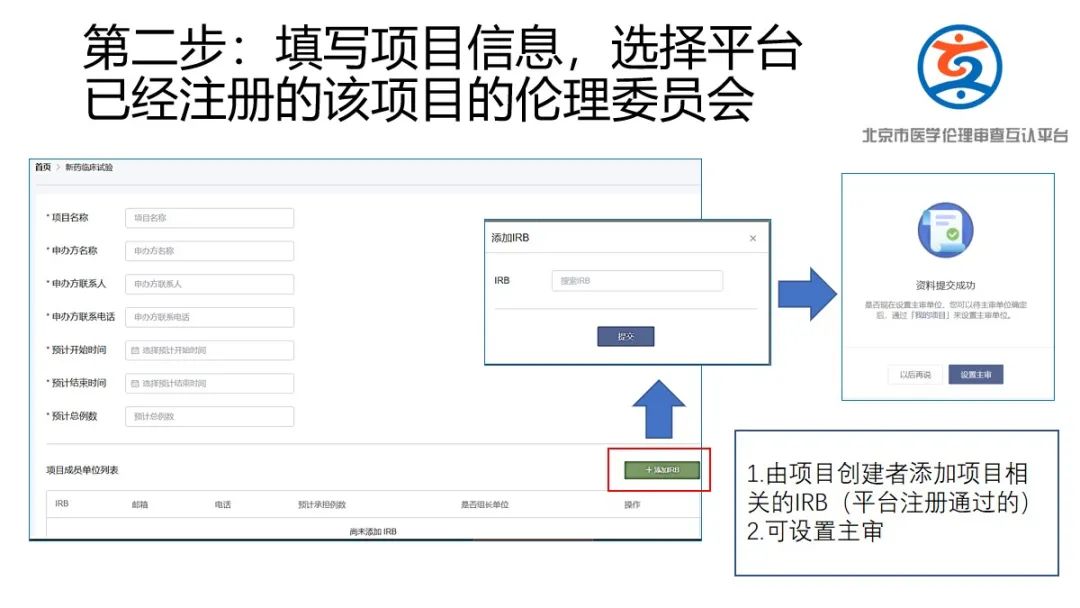
(2)请申办方/CRO(临床科研项目为研究者)在平台进行注册并进行信息填报,发起互认申请;
(3)如有疑问,组长单位伦理办公室/申办者/CRO(临床科研项目为组长单位伦理办公室)可联系宣武医院伦理办李晓玲 83198856
送审文件清单
(文件格式,均需PDF扫描件,不接受任何.jpg等照片格式的文件)适用于以下所有文件
伦理审查申请文件清单
一、初始审查文件
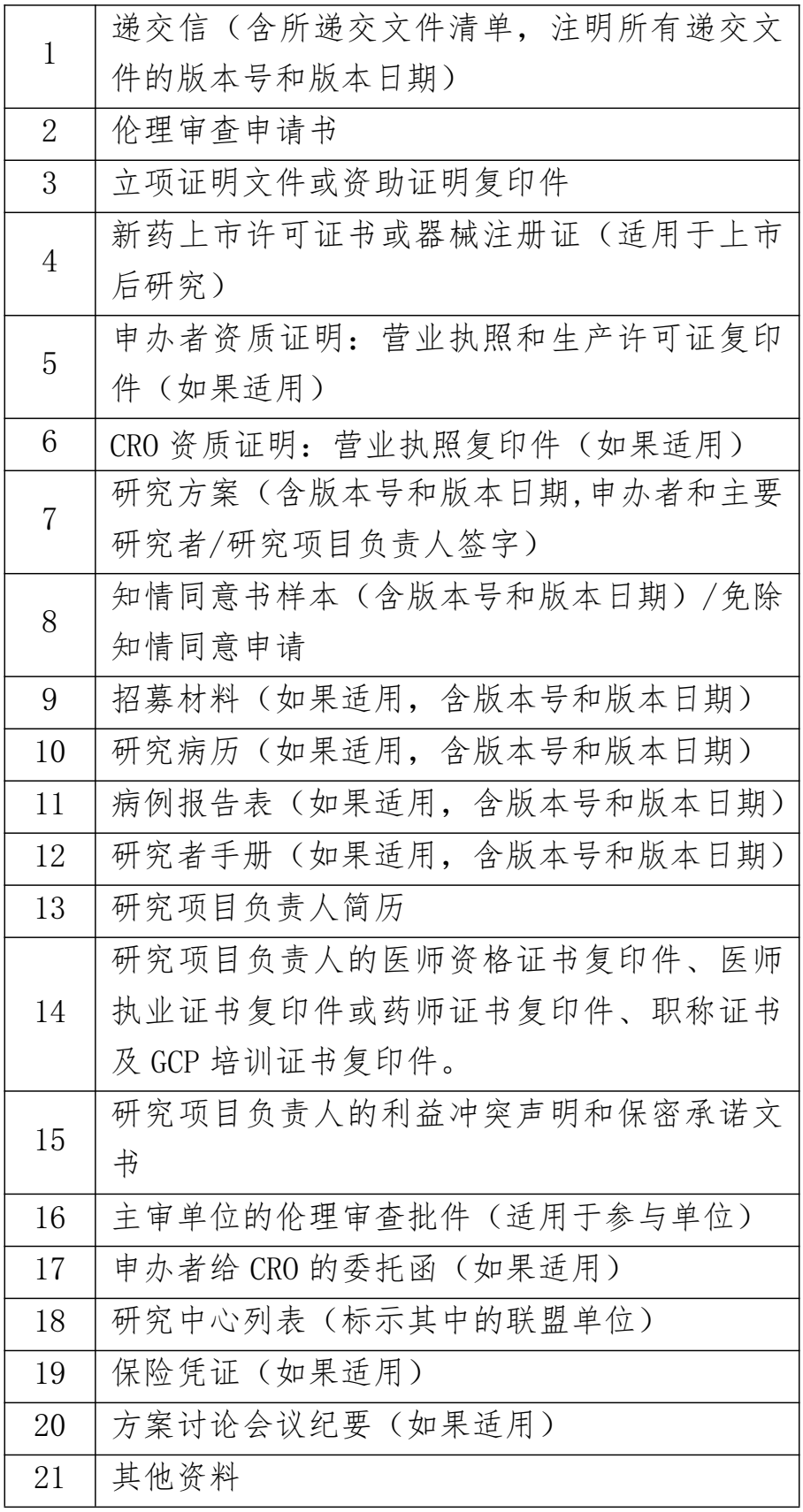
1.药物临床试验初次申请审查提交文件
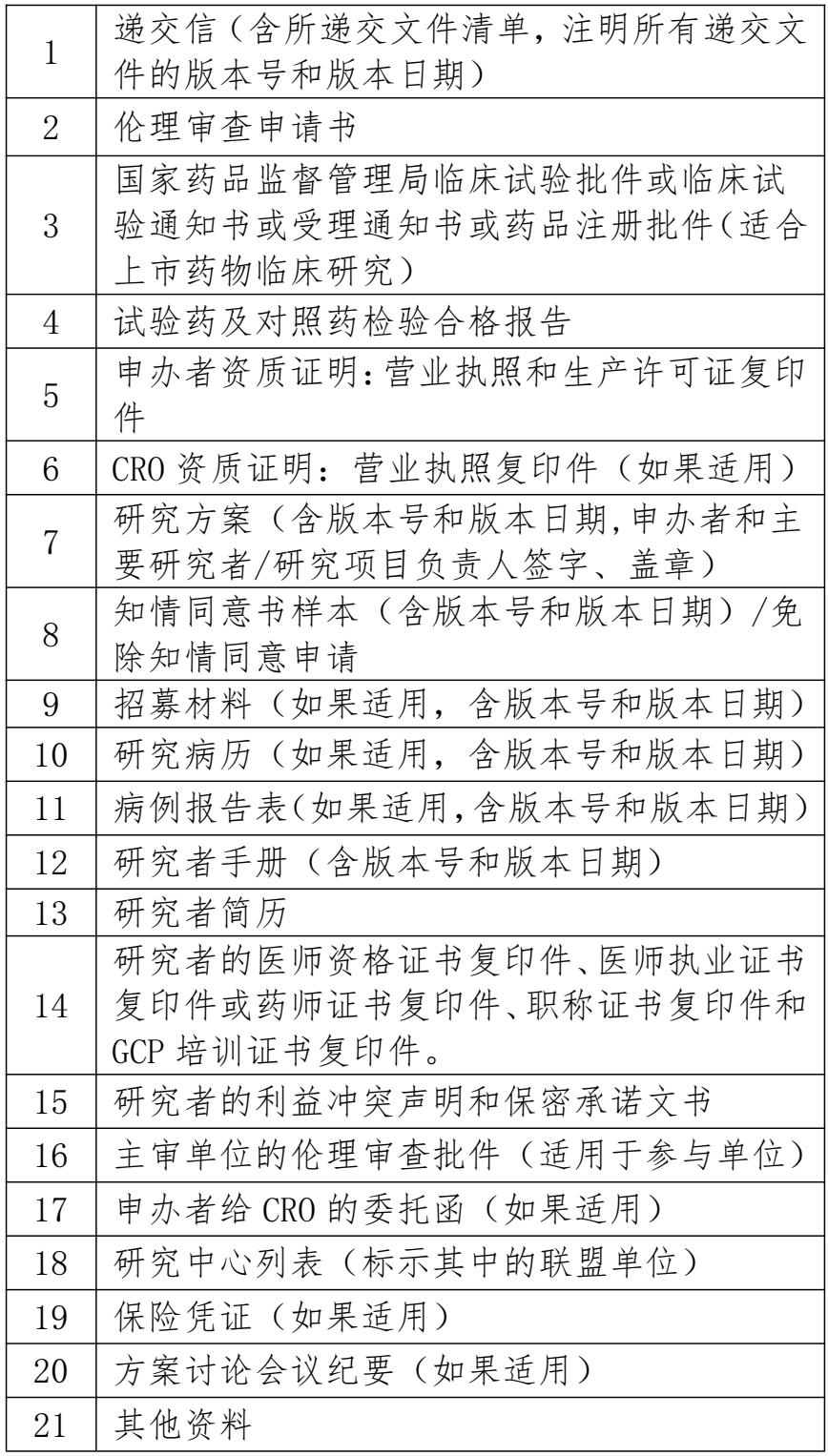
2.医疗器械临床试验初次申请审查提交文件
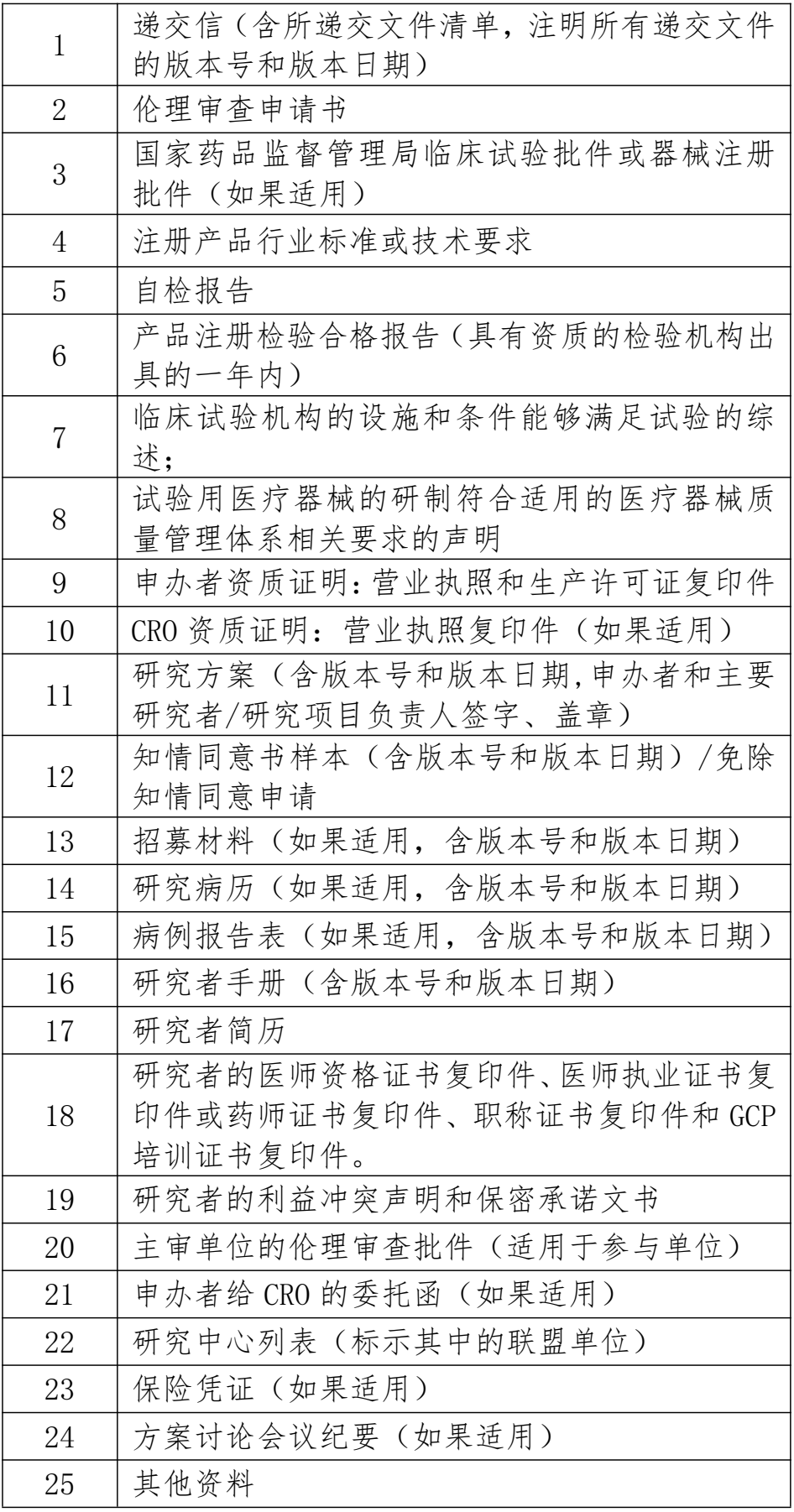
3.临床科研项目初次申请审查需提交文件
二、复审文件
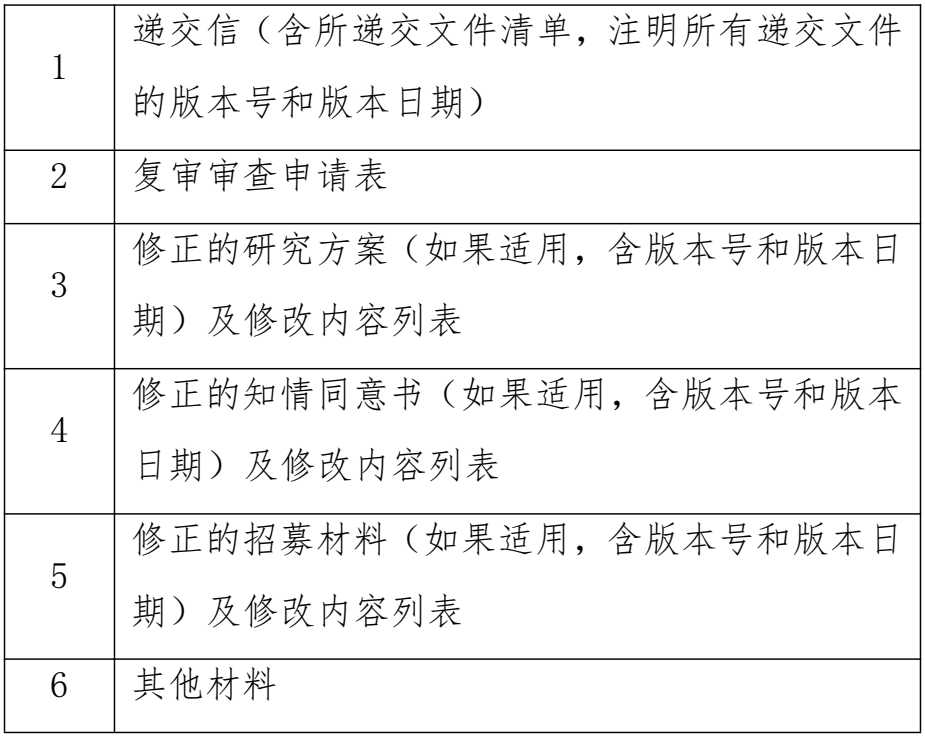
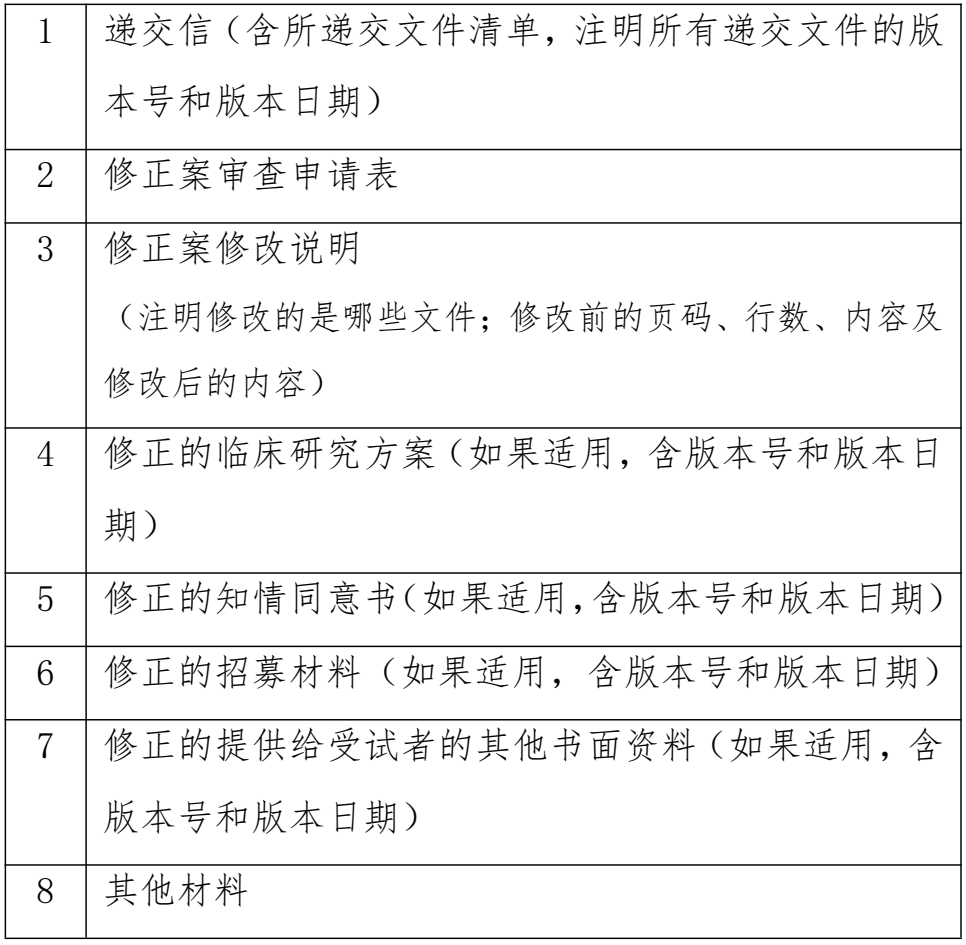
三、修正案文件
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#伦理#
42
#重磅#
42
#医学伦理#
53