血液病诊疗过程中MICM-P综合诊断非常重要!
2022-02-13 秦尤文 张炳尧 高博医学(血液病)上海研究中心/上海闸新中西医结合医院检验科 “ 检验医学”公众号
骨髓纤维化(MF)是指骨髓造血组织被纤维组织代替,以致影响造血功能所产生的病理状态,按原因是否明确可分为原发性骨髓纤维化(PMF)和继发性骨髓纤维化(SMF)
骨髓纤维化(MF)是指骨髓造血组织被纤维组织代替,以致影响造血功能所产生的病理状态,按原因是否明确可分为原发性骨髓纤维化(PMF)和继发性骨髓纤维化(SMF)。
PMF是由异常造血干细胞克隆性增殖,导致进行性骨髓纤维化的一种BCR-ABL1阴性的骨髓增殖性肿瘤(MPN)。其主要特征是骨髓纤维组织增生、髓外造血、贫血、肝脾肿大、进展为白血病和生存期缩短。
PMF患者常有不同程度贫血,血片中可见幼红、幼粒细胞,易见异形红细胞和泪滴样红细胞,细胞遗传学异常可见20q缺失、5q缺失、7q缺失、+8、+9和13q缺失等。PMF的驱动性基因突变为JAK2、CALR和MPL突变。
SMF是指在有明确原发病基础上出现骨髓纤维组织增生,并出现造血功能异常,临床常见于白血病、淋巴瘤、多发性骨髓瘤等血液系统恶性疾病。
骨髓增生异常综合征(MDS)伴MF就是较为常见的SMF,需与PMF相鉴别。MDS是一组起源于骨髓造血干/祖细胞的克隆性恶性血液病,以一系或多系细胞减少、病态造血为主要特征,通常可见重现性染色体异常和向白血病转化高风险,部分MDS患者骨髓中有轻度至中度的网状纤维增多,其中的一部分患者会有明显MF。
案例经过
患者女性,69岁,主因“头晕乏力伴间断高热4月余”于2021年11月17日入我院。发现贫血病史5月余,间断使用EPO改善血象,症状改善不明显。末次血常规提示为重度贫血伴血小板减少、白细胞升高,需进一步完善相关检查明确诊断。11月18日血常规:WBC 15.03×109/L↑,Hb 48g/L↓,PLT 44×109/L↓,CRP 27.54 mg/L↑,PCT 0.40ng/mL。
患者曾于2021年7月19日就诊本市某三甲医院肾内科,当时血常规:WBC 2.82×109/L、Hb 100g/L、PLT 56×109/L,CRP 74mg/L,PCT 1.77ng/mL,诊断为感染性发热,但经抗生素治疗后症状无改善。
在肾内科住院期间行骨髓涂片形态学和骨髓活检。骨髓涂片形态学示:中性分叶核细胞32%,中性杆状核细胞2%,嗜碱粒细胞4%,小淋巴细胞60%,单核细胞2%。骨髓活检提示纤维组织及网硬蛋白纤维增生,骨髓增殖性肿瘤(骨髓纤维化待排)。

出院诊断主要有:1.发热待查;2.IgA肾病;3.慢性肾病;4.白细胞减少;5.中度贫血;6.血小板减少等。
转入我院后进行了骨髓形态、流式免疫分型、FISH、基因突变及活检检查。
骨髓涂片:1.有核细胞约5-20个/HP,增生减少,G:E无意义。2.单核细胞异常增生,占41.0%,其中原始、幼稚细胞占38.0%。3.粒系占45.5%,以中、晚幼粒及成熟阶段粒细胞为主,可见双核中、晚幼粒及杆状核粒细胞,部分细胞可见核分叶不良、核染色质异常凝聚及胞浆内颗粒减少或缺失;分类可见嗜酸及嗜碱性粒细胞。
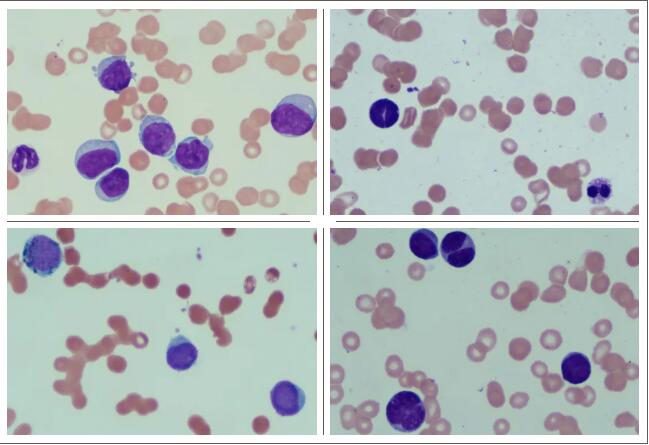
细胞化学染色:POX91%(-)、7%(+)、2%(2+),DCE93%(-)、7%(+),PAS约14%的细胞呈弥散状阳性,ANAE约56%的细胞呈弥漫状阳性,ANAE+NaF约6%的细胞呈弥漫状阳性,抑制率89.3%。外周血片可见43%原、幼细胞(似单核)。结论:本次涂片符合AML(M5可能,部分稀释不排除)骨髓象,骨髓涂片如下图:
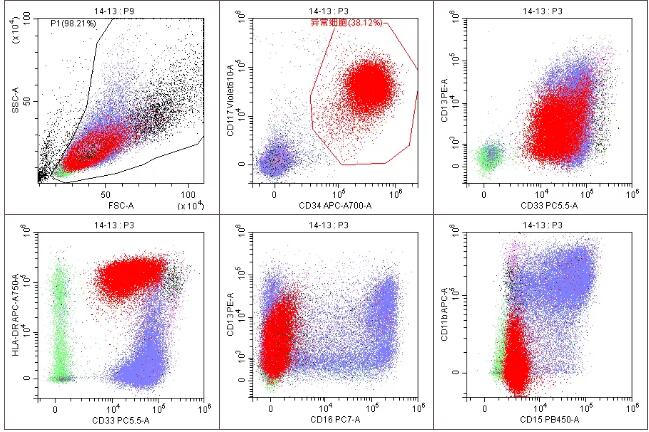
流式免疫分型:样本中见38.19%异常髓系幼稚细胞,考虑为急性髓系白血病(AML),其LAIP为CD45dim+CD34+CD117+CD7+CD13part+CD33+CD38+HLA-DR+CD371dim+。流式主要阳性表达抗原图如下:

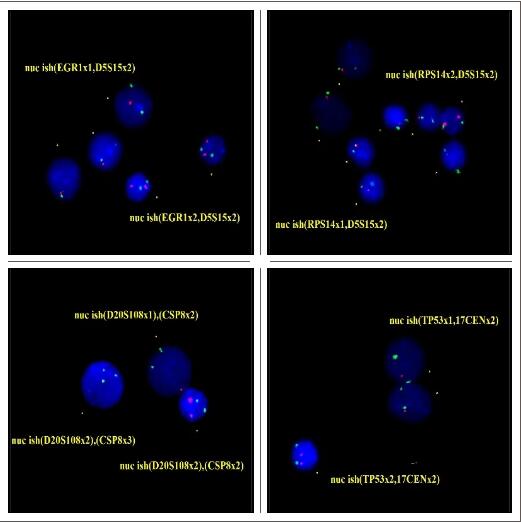
FISH检测结果:5q31缺失的异常信号细胞比例88.8%,5q33缺失的异常信号细胞比例88%,TP53缺失的异常信号细胞比例93.6%,20q缺失的异常信号细胞比例9.2%,+8的异常信号细胞比例5.4%。5q31、5q33、TP53、20q/CEP8原位杂交图如下:
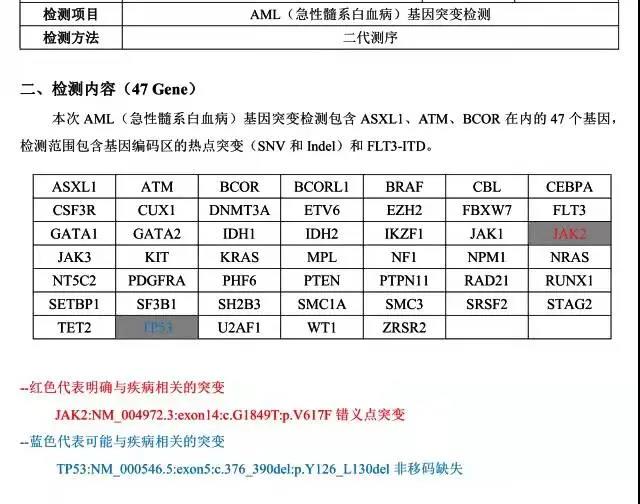
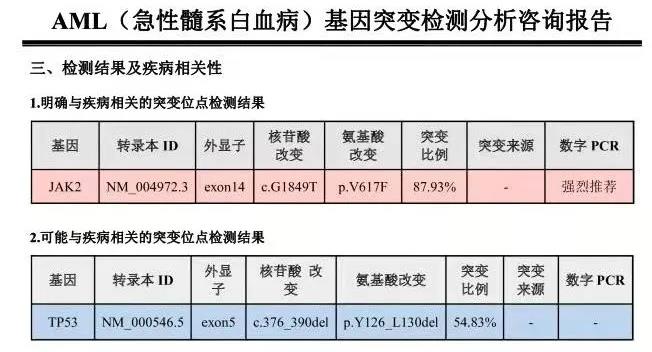
WT1定量:30.495%。MPN常见突变基因和AML基因突变panel检测到JAK2错义突变(VAF:87.93%)和TP53(VAF:54.83%),报告分别如下:

骨髓活检示:骨髓有核细胞增生极度活跃,以原始/幼稚细胞为主,密集分布,CD34+CD117+大于20%,符合急性髓系白血病,报告如下:
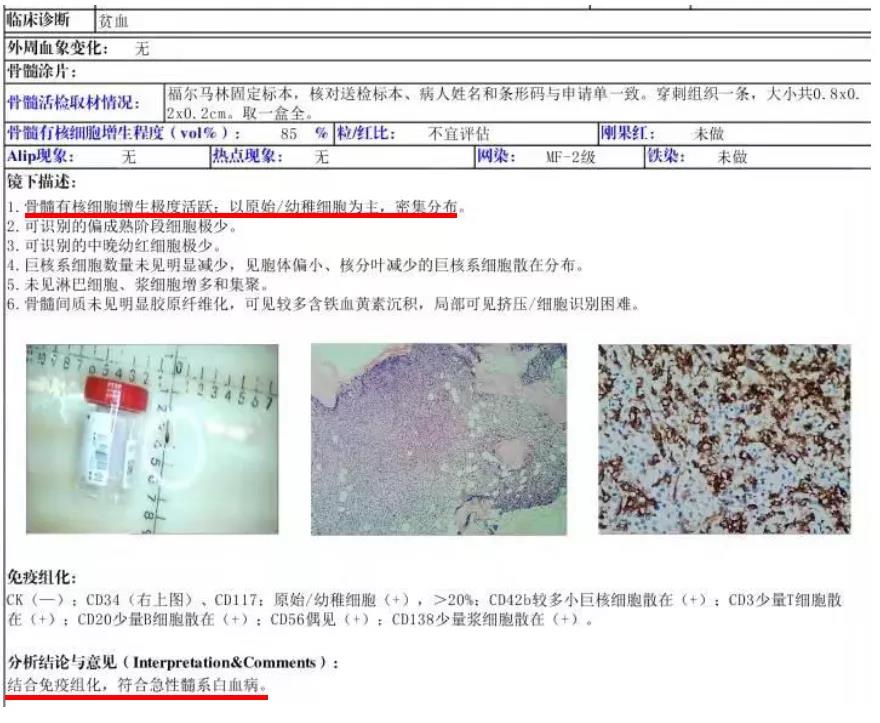
案例分析
患者在7月30日出院后,又辗转了本市另两家三甲医院,但因种种原因未被收治入院,在其中一家医院的推荐下来到我院诊治。记得当时骨穿样本刚送达实验室,患者的主治医生就来电特地强调其贫血原因未明,希望实验室尽快给出诊断意见,以便制定相应治疗方案。
当天临近下班时,形态和流式给出了初步的结果——AML。骨髓涂片的原、幼细胞形态特征接近于单核细胞系,POX、DCE阳性率均低于10%且多为阳性1+,ANAE约56%的原、幼细胞阳性且89.3%可被NaF抑制,形态倾向于单核细胞白血病。
而流式的免疫表型特征为:表达干祖细胞标志(CD34、CD117、CD38、HLA-DR)及髓系标志(CD13、CD33、CD371),跨系表达CD7,其它系列特异性抗原均为阴性,且表型幼稚的单核细胞少见。病理仅提示CD34和CD117抗原阳性,符合AML。因此该患者最终诊断为AML非M3,并于11月21日起采用维柰托克+阿扎胞苷方案化疗。
心得体会
患者在我院很快得到了明确诊断并开始治疗,但令人不解的是距离前次肾内科住院仅4个月,当时已有三系减低和贫血症状,为排除血液系统疾病进行了骨髓涂片和活检检查,检查结果提示粒系比例降低,淋巴比例增高,骨髓增殖性肿瘤(骨髓纤维化)待排,并无白血病的诊断依据。转入我院时白细胞数量翻了5倍,血红蛋白降了一半,血小板进一步减少,短期内进展为AML,其AML究竟是原发性还是继发性?
文献报道中原发性AML中JAK2V617F突变阳性率很低,德国和韩国学者分别报道1.1%和2.7%,王生梅等在121例AML中发现2例(1.65%),另一个研究中222例AML仅检测到4例JAK2V617F突变,其中3例AML继发于MPN。
JAK2V617F阳性的MPN进展为AML却不少见,目前公认的二次打击模型支持AML的发病机制是多步骤的,JAK2V617F属于I类突变,单纯发生I类突变如果未影响造血细胞的分化则不足以引起AML。
有研究表明初诊时如果存在JAK2V617F以外的突变,如ASXL1、TP53、SRSF2、IDH1/2和RUNX1,其向AML转化的可能性显着增加。本病例同时检测到TP53突变和缺失,且之前存在MF的证据,因此原发性JAK2V617F阳性AML可能性不大。
查阅病史发现患者在2018年接受过6个月环磷酰胺+强的松治疗,WHO2016的“治疗相关髓系肿瘤(t-MNs)”章节里指出烷化剂、拓扑异构酶II抑制剂和电离辐射是t-MNs的主要诱因,但发生通常要在暴露后5-10年。这类t-MNs大多表现为伴有骨髓衰竭的MDS特征,包括一系或多系血细胞减少,涉及5号、7号的异常或复杂核型,通常与TP53突变有关。虽然本病例发现MF证据距离烷化剂使用仅3年,但是不能完全排除t-MNs。此外,患者的JAK2V617F突变VAF值很高(87.93%),有否可能为PMF呢?
仔细分析我院住院期间的检验结果:FISH显示5q缺失、20q缺失、三体8及TP53缺失,虽然细胞遗传学异常应以核型分析为准,但是FISH至少提示了存在5号、20号和8号染色体上有部分基因片段缺失,涉及此3个位点的异常在MDS中最常见,但在部分PMF中也可见。
NGS检出JAK2V617F突变和TP53突变,JAK2V617F是PMF的驱动基因突变,是PMF的主要诊断标准之一,但JAK2V617F突变并非只在PMF中出现,在MDS、MDS/MPN以及AML中也有报道。TP53突变则是恶性肿瘤中最普遍的分子学异常,可见于各种实体肿瘤和血液恶性肿瘤。
PMF主要特征为肝脾肿大,实验室异常通常为贫血,呈中、重度贫血,成熟红细胞大小不一、异形红细胞和泪滴状红细胞,还可见有核红细胞及嗜多色性红细胞,血小板和白细胞计数结果差异较大,可以增高或减低,血片中出现幼红、幼粒细胞为PMF的特征之一。
MDS继发MF的特征性表现为全血细胞减少,轻度或无脾大,骨髓明显纤维化,髓内无原始细胞弥漫性增生,骨髓象出现病态造血,预后不良等。PMF和MDS均有向白血病转化的高风险。
本病例7月份住院期间体征上无肝、脾肿大,有三系减少、骨髓涂片稀释或凝固,骨髓活检提示增生活跃,无异形红细胞和病态造血,转入我院后骨髓涂片显示粒系病态改变,但粒系的病态改变在白血病中也会出现。
患者的细胞遗传学结果缺如,FISH只能提供参考,髓系突变检测到JAK2和TP53突变,但无MDS相关的高频基因突变。我们已尽可能追溯了患者前次住院的相关检验及影像学结果,但由于缺乏其他实验室结果的佐证,难以鉴别其究竟为原发性JAK2V617F阳性AML还是t-MDS继发MF或PMF进展为AML。
结 语
当临床上高度怀疑MDS或MPN类疾病,骨髓形态未能提供有价值线索且病理活检诊断不明确,应及时加做流式免疫分型、核型分析以及基因突变检测。流式对于异常原幼细胞敏感度高,能发现小克隆异常群体,细胞遗传学的结果不仅能辅助诊断,还能对患者进行危险度和预后分层,某些具有诊断价值的基因突变则能提供诊断依据。
必须强调同时兼顾MICM-P结果对于血液系统恶性肿瘤诊断的重要性,因为明确诊断、及时选择合理有效的治疗方案,有利于最大限度恢复骨髓的造血功能,避免过强化疗引起造血功能衰竭,满足患者的基本生存需要,并可能影响疾病转归。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言