陈小兵教授:DESTINY-Gastric06研究惊艳亮相2023 ESMO Asia,T-DXd在华获批指日可待
2023-12-20 医悦汇 医悦汇 发表于上海
本次ESMO Asia大会首次公布了其中国桥接注册性试验—DESTINY-Gastric06研究成果,为中国HER2阳性晚期胃癌患者带来了新的治疗希望。
编者按:随着胃癌分子分型的深入研究,以HER2为靶点的新型靶向治疗逐渐成为HER2阳性晚期胃癌的主要探索方向。ADC药物兼具单克隆抗体的特异性靶向和细胞毒药物的强效杀伤作用,已经成为抗肿瘤治疗的明星药物,在胃癌治疗领域同样备受关注。
2023年欧洲肿瘤内科学会亚洲年会(ESMO Asia)于12月1日-3日在新加坡盛大召开。新型ADC药物德曲妥珠单抗(T-DXd)的DESTINY-Gastric06研究(摘要号:172P)重磅揭晓[1],T-DXd为HER2阳性晚期胃癌患者带来中位无进展生存期(PFS)为5.7个月,中位总生存期(OS)为10.2个月,且总体安全性良好,任何级别间质性肺病(ILD)发生率仅为3.2%,该研究结果与DESTINY-Gastric01研究具有一致获益趋势,进一步验证了T-DXd在国内外HER2阳性晚期胃癌患者中的治疗价值。值得一提的是,2023年11月6日,中国国家药监局药品审评中心(CDE)官网公示,注射用德曲妥珠单抗新适应证拟纳入优先审评,单药适用于治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者。其适应证在中国获批指日可待。医悦汇特邀河南省肿瘤医院陈小兵教授深入解读该研究成果及其重要意义,以供交流。
正文如下
研究背景
根据最新GLOBOCAN数据,2020年全球胃癌新发病例约109万,排名第五,死亡病例77万,排名第四。中国的新发病例和死亡病例均占全球40%以上,居世界第一[2]。HER2过表达或基因扩增与胃癌的发生发展密切相关,大约12%-18%的胃癌患者会出现HER2过表达或基因扩增[3,4]。曲妥珠单抗的问世显著改善了一线HER2阳性晚期胃癌的获益,但是患者仍面临耐药进展,尤其是经标准治疗后进展的患者,目前仍存在较大未被满足的治疗需求。
近年来,ADC药物在HER2阳性晚期胃癌领域取得了突破性进展,开创了胃癌抗HER2 ADC药物治疗的新时代。T-DXd是一种靶向HER2的新型ADC药物,由特异性抗HER2单克隆抗体、稳定的基于GGFG四肽可裂解连接子、高活性拓扑异构酶I抑制剂载药偶联而成,其药物抗体比(DAR)达到理论高值8,且具有旁观者效应,能最大程度克服胃癌HER2异质性。基于创新结构设计和独特作用机制,T-DXd表现出优秀的抗肿瘤活性,在HER2阳性晚期胃癌治疗领域积累了丰富的循证证据。基于DESTINY-Gastric系列研究成果,T-DXd先后在日本、美国、欧盟、韩国和新加坡等多个国家和地区获批用于既往接受过基于曲妥珠单抗的治疗方案的局部晚期或转移性HER2阳性胃或胃食管交界处腺癌患者。
既往DESTINY-Gastric01研究表明,T-DXd相比标准化疗显著改善日韩HER2阳性晚期胃癌患者的生存获益,本次ESMO Asia大会首次公布了其中国桥接注册性试验—DESTINY-Gastric06研究成果,为中国HER2阳性晚期胃癌患者带来了新的治疗希望。
研究设计
II期DESTINY-Gastric06研究旨在评估T-DXd在既往接受过≥2种抗肿瘤治疗(包括氟尿嘧啶和铂类药物)的HER2阳性晚期胃癌或胃食管交界处腺癌中国患者中的疗效和安全性,主要终点是独立审查委员会(ICR)评估的经确认的ORR(cORR)。次要终点包括研究者(INV)评估的cORR;ICR评估的PFS和缓解持续时间(DOR);OS;以及安全性和耐受性。

图3. DESTINY-Gastric06研究设计
研究结果
基线特征
截至2023年6月16日,95例意向治疗人群入组,其中73例经中心实验室确认为HER2阳性(IHC 3+或IHC 2+/ISH+)晚期胃癌的患者被纳入全分析集(FAS)。从基线特征上看,IHC 3+患者比例为72.6%;中位治疗线数为3;约30%的患者既往接受过新型抗HER2治疗[RC48(15.1%)、KN026(8.2%)、ARX788(4.1%)],这意味着DESTINY-Gastric06研究入组患者的既往治疗情况更加复杂。且与DESTINY-Gastric01研究相比,DESTINY-Gastric06研究纳入的胃食管交界处腺癌(30.1%)、ECOG PS 1分(63%)、可测量病灶直径≥5(60.3%)的患者比例相对更高,总体基线入组情况更差。
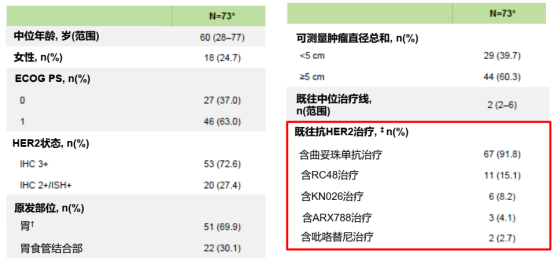
表1. DESTINY-Gastric06研究基线特征
疗效结果
在73例FAS人群中,中位随访时间为8.0个月,ICR评估的cORR为28.8%,其中IHC 3+和IHC 2+/ISH+组的ORR分别为32.1%和20.0%;INV评估的cORR为35.6%。中位PFS和中位OS分别为5.7个月和10.2个月,中位DOR为7.9个月。
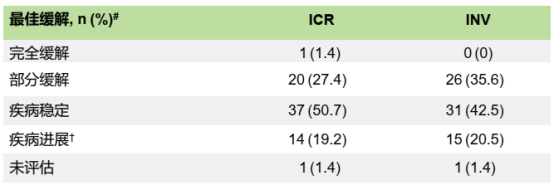
表2. DESTINY-Gastric06研究缓解情况
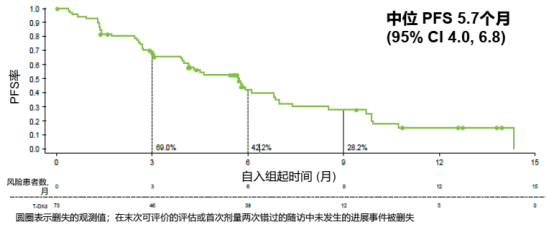
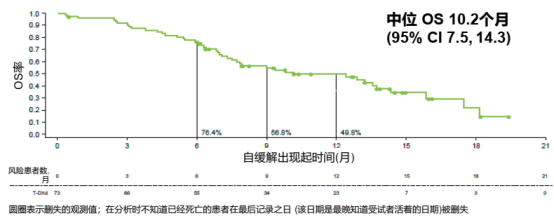
图2和3. DESTINY-Gastric06研究中FAS人群的PFS和OS结果
安全性结果
T-DXd的中位治疗持续时间为3.4个月,总体安全性特征可管理。最常见的不良事件(AEs)包括贫血(78.9%),白细胞减少(71.6%)和中性粒细胞减少(61.1%)。25.3%的患者发生COVID-19相关TEAEs,5.3%的患者因COVID-19相关TEAEs导致停药。此外,仅3.2%的患者发生由独立委员会判定的间质性肺病(ILD)/肺炎,且均为1、2级。
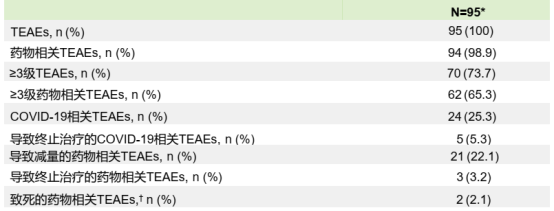
表3. DESTINY-Gastric06研究中安全性特征
研究结论
DESTINY Gastric06研究表明,T-DXd在接受过两种或两种以上抗肿瘤方案治疗的中国HER2阳性晚期胃癌患者带来具有临床意义且持久的缓解,以及可控的安全性。其总体疗效与安全性结果与DESTINY Gastric01研究结果一致。
专家点评
晚期胃癌抗HER2治疗探索并非一帆风顺,亟待新型治疗策略
中国是胃癌大国,其发病率和死亡率均位居全球前列。5年生存率仅为35.9%,远低于日韩国家[5]。并且相较于日本、韩国,中国早期胃癌仅占19.7%,30%-40%的患者确诊时已无根治性手术指征,以内科治疗为主[6]。大量临床研究证实靶向治疗可以改善包括胃癌在内的实体瘤患者的预后。HER2是胃癌最早明确、最成熟的生物标志物,也是目前胃癌中炙手可热的治疗靶点。近年来,以HER2为靶点的抗肿瘤治疗药物在HER2阳性晚期胃癌中展开了积极探索,但总体结果存在较大差异。
既往ToGA研究[7]表明,在化疗基础上联合曲妥珠单抗能显著改善HER2阳性晚期胃癌的生存获益,研究结果不仅奠定了曲妥珠单抗+化疗的一线标准治疗地位,还确立了胃癌领域HER2阳性定义(IHC3+或者IHC2+且FISH+)和HER2检测标准,使得HER2检测结果成为晚期胃癌临床指导用药的必要条件。随后KEYNOTE-811研究[8]结果支持帕博利珠单抗+曲妥珠单抗+化疗作为PD-L1阳性且HER2阳性晚期胃癌新的标准治疗推荐。
曲妥珠单抗成功开启了胃癌抗HER2治疗时代,但是其他抗HER2靶向药物包括拉帕替尼、T-DM1、帕妥珠单抗等以及曲妥珠单抗跨线和高剂量探索研究均以失败告终,近十多年间HER2阳性胃癌的二线及以后治疗陷入瓶颈,患者的治疗选择及生存获益均有限,亟需探索新的治疗策略以满足未尽之需。
新型ADC药物破解HER2阳性晚期胃癌后线治疗困局
新型ADC药物的问世打破了这一困局,T-DXd是全球首个获批上市的治疗HER2阳性晚期胃癌的新型ADC药物,在其关键II期DESTINY-Gastric01研究[9](日本、韩国)中,T-DXd相比医生选择的化疗(TPC,伊立替康或紫杉醇)具有显著获益,ORR达到42%,中位OS(12.5个月 vs 8.4个月)以及中位PFS(5.6个月 vs 3.5个月)均显著高于TPC组,并且刷新了既往晚期胃癌后线治疗的OS获益记录。在II期DESTINY-Gastric02研究[10](比利时,英国,意大利,西班牙,美国)中,T-DXd二线治疗HER2阳性晚期胃癌同样取得了优异成果,其ORR为41.8%,中位OS达12.1个月,显示出具有临床意义的持久缓解。基于这两项研究成果,T-DXd已经在全球30多个国家和地区获批HER2阳性晚期胃癌适应症。并获得NCCN、ESMO、ASCO国际权威指南的共同推荐(≥2线)。但由于药物可及性问题,目前CSCO指南仅在注释中对T-DXd进行了说明。随着DESTINY-Gastric06研究成果的重磅发布,或改写时局。DESTINY-Gastric06研究入组中国人群的基线特征相比DESTINY-Gastric01研究的日韩患者更差,且既往治疗情况更加复杂,但是T-DXd后线治疗HER2阳性晚期胃癌仍获得具有临床意义且持久的疾病缓解,并且安全性可管理。该研究结果与DESTINY-Gastric01研究总体一致,不仅再次验证了T-DXd在HER2阳性晚期胃癌中的疗效和安全性,也为T-DXd在中国获批胃癌适应证提供了夯实的循证证据。期待T-DXd早日在国内获批,改写指南推荐,与国际同步,为中国患者带来新的标准治疗选择,重塑中国HER2阳性晚期胃癌治疗格局。
参考文献
[1]Shen L, Chen P, Lu J, et al. Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2-positive locally advanced/metastatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): Primary efficacy and safety from the phase II single-arm DESTINY-Gastric06 (DG06) trial. 2023 ESMO Asia.172P.
[2]Sung H,Ferlay J,Siegel RL,et al.Global Cancer Statistics 2020:GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries.CA Cancer J Clin.2021 May;71(3):209-249.
[3]Van Cutsem E, Bang YJ, Feng-Yi F, et al. HER2 screening data from ToGA: targeting HER2 in gastric and gastroesophageal junction cancer. Gastric Cancer. 2015 Jul;18(3):476-84.
[4]Huang D, Lu N, Fan Q, et al. HER2 status in gastric and gastroesophageal junction cancer assessed by local and central laboratories: Chinese results of the HER-EAGLE study. PLoS One. 2013 Nov 14;8(11):e80290.
[5]Allemani C, Matsuda T, Di Carlo V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. Lancet. 2018 Mar 17;391(10125):1023-1075.
[6]杜彩妨,李慧.晚期胃癌中少见靶点的特征与治疗进展[J].临床肿瘤学杂志, 2021, 26(6):6.
[7]Bang YJ, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010 Aug 28;376(9742):687-97.
[8]Janjigian YY, Kawazoe A, Yañez P, et al. The KEYNOTE-811 trial of dual PD-1 and HER2 blockade in HER2-positive gastric cancer. Nature. 2021 Dec;600(7890):727-730.
[9]Shitara K, Bang YJ, Iwasa S, et al. Trastuzumab Deruxtecan in Previously Treated HER2-Positive Gastric Cancer. N Engl J Med. 2020 Jun 18;382(25):2419-2430.
[10]Van Cutsem E, di Bartolomeo M, Smyth E, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advance.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#T-DXd# #HER2阳性晚期胃癌# #欧洲肿瘤内科学会亚洲年会#
27