JCO:曲妥珠单抗治疗HER2突变型转移性非小细胞肺癌:II期DESTINE-Lung02试验的主要结果
2023-10-08 daikun MedSci原创 发表于上海
该研究报告了曲妥珠单抗T-Dxd5.4 mg / kg和6.4 mg / kg治疗HER2突变转移性非小细胞肺癌的疗效和安全性,T-DXd在两种剂量疗效相当且5.4 mg / kg毒性更低。
大约2%-4%的非鳞状非小细胞肺癌(NSCLC)为人表皮生长因子受体2突变,因此化疗和免疫治疗疗效有限,其他 HER2 靶向治疗在二线治疗的 HER2 突变 (HER2m) 转移性 NSCLC (mNSCLC) 患者中显示出不一致的结果。因此,在这一患者群体中迫切需要有效的HER2靶向治疗。
曲妥珠单抗(T-DXd)是第一个也是唯一一个批准的HER2靶向治疗药物,用于在几个国家接受过治疗的HER2m mNSCLC患者。T-DXd 6.4 mg/kg 的临床获益在 II 期 DESTINY-Lung01 试验中得到证实,其中 HER2m mNSCLC 患者实现了 54.9% 的客观缓解率 (ORR)、中位缓解持续时间 (DoR) 为 10.6 个月、中位无进展生存期 (PFS) 为 8.2 个月和中位总生存期 (OS) 为 18.6 个月。在HER2m队列中,药物相关性间质性肺疾病(ILD)/肺炎的发病率为27.5%,因此需要对 HER2m mNSCLC 患者进行较低剂量的 T-DXd 评估。
DESTINY-Lung02是一项II期试验,评估T-DXd 5.4 mg / kg和6.4 mg / kg每3周一次在HER2m(单核苷酸变异[SNV]和外显子20插入)mNSCLC患者中的有效性和安全性,从而表征T-DXd在该患者群体中的益处/风险状况。DESTINY-Lung02 的中期分析(数据截止 [DCO]:2022 年 3 月 24 日)提供了 HER2m mNSCLC 患者中 T-DXd 5.4 mg/kg 的首次临床数据并作为美国加速批准T-DXd 5.4 mg / kg作为首个HER2靶向治疗的基础,用于患有HER2(ERRB2)突变的不可切除NSCLC或mNSCLC患者。该研究报告了DESTINY-Lung02(DCO:2022年12月23日)的主要结果。

方法:DESTINY-Lung02 是一项随机、多中心、盲法、II 期研究,在北美、亚洲、欧洲和澳大利亚的 47 个地点进行,评估 T-DXd 5.4 mg/kg 和 6.4 mg/kg 每 3 周一次在既往接受治疗的 HER2m mNSCLC 患者中的有效性和安全性。纳入患者年满18岁且患有HER2突变的mNSCLC,既往在转移性/局部晚期接受过 ≥1 次治疗(铂类化疗)。符合条件的患者分别被随机分配2:1至T-DXd 5.4 mg / kg每3周一次或6.4mg / kg每3周一次。主要终点是由BICR根据RECIST v 1.1评估的客观缓解率(ORR)。
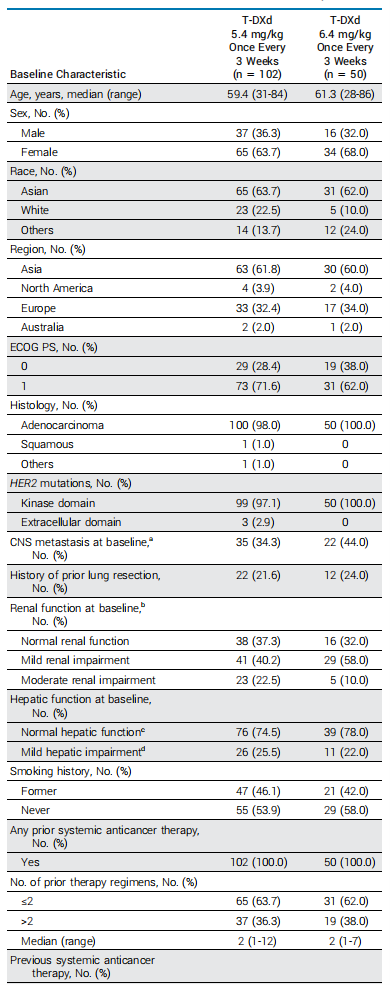
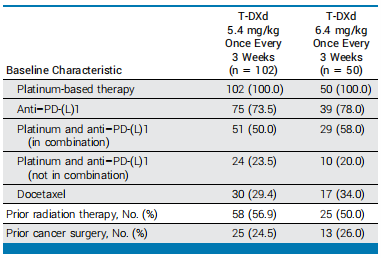
1 人群和基线特征
2021 年 3 月至 2022 年 3 月期间招募了 152 名患者,其中 102 名患者每 3 周随机分配到 T-DXd 5.4 mg/kg,50 名患者每 3 周一次被随机分配到 T-DXd 6.4 mg/kg。
2 ORR分析
在T-DXd 5.4 mg/kg每3周一次的组中,BICR确认的ORR为49.0%(95%CI,39.0至59.1;50名患),其中1名患者(1.0%)和49名患者(48.0%)分别达到CR和PR。在T-DXd 6.4 mg/kg每3周一次的组中,确诊ORR为56.0%(95%CI,41.3至70.0;28名患者),其中2名(4.0%)和26名患者(52.0%)分别达到CR和PR。

3 PFS分析
T-DXd 5.4 mg/kg每3周一次组的中位随访时间为11.5个月(范围,1.1-20.6)。在5.4 mg/kg和6.4 mg/kg组中,BICR评估的中位PFS分别为9.9个月(95%CI,7.4至NE)和15.4个月(95%CI,8.3至NE)。在12个月时,BICR评估T-DXd 5.4mg / kg和6.4mg / kg的PFS率分别为45%(95%CI,33至56)和53%(95%CI,36至67)。5.4和6.4 mg/kg组的中位OS分别为19.5个月(95%CI,13.6至NE)和NE(95%CI,12.1至NE),估计的 12 个月 OS 率分别为 67%(95% CI,56-76)和 73%(95% CI,57-84)。

4 安全性分析
T-DXd 5.4 mg/kg和6.4 mg/kg每3周一次的中位治疗持续时间分别为7.7个月(范围,0.7-20.8)和8.3个月(范围,0.7-20.3)。在治疗组的所有患者中报告了任何级别的TEAEs;T-DXd 5.4 mg/kg和6.4 mg/kg组最常见的是恶心(分别为67.3%和82.0%)、中性粒细胞减少(42.6%和56.0%)、疲劳(44.6%和50.0%)和食欲下降(39.6%和50.0%);最常见的≥3级TEAE是中性粒细胞减少(18.8%和36.0%)和贫血(10.9%和16.0%)。

结论:T-DXd在两种剂量下均显示出具有临床意义的反应。安全性是可以接受的,并且总体可控,其中T-DXd 5.4 mg / kg的毒性更低。
原始出处:
Goto K, et al. 2023. Trastuzumab Deruxtecan in Patients With HER2-Mutant Metastatic Non–Small-Cell Lung Cancer: Primary Results From the Randomized, Phase II DESTINY-Lung02 Trial. Journal of Clinical Oncology:JCO.23.01361.DOI: 10.1200/jco.23.01361.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











签到学习
25
有价值的研究报告。
22