ctDNA在PTCL突变谱分析、肿瘤负荷评估、结局预测和疾病监测的作用
2023-05-05 聊聊血液 网络 发表于上海
ctDNA在PTCL突变谱分析、肿瘤负荷评估、结局预测和疾病监测的作用。
外周 T 细胞淋巴瘤 (PTCL) 是一组相对少见且具有异质性的非霍奇金淋巴瘤(NHL),在我国占所有 NHL 的20%-30%。与 B 细胞 NHL 突飞猛进的进展不同,T细胞淋巴瘤患者的治疗仍需改善,除 ALK 阳性 (ALK + ALCL) 的间变性大细胞淋巴瘤外,大多数类型的侵袭性 PTCL的长期生存率仍明显不足(约30%-40%)。而推进 PTCL 治疗的努力,极大程度上依赖于对生物学行为的更好理解、开发新型疗法和发现更多的肿瘤特异性生物标志物。
一个潜在的生物标志物是循环无细胞DNA(cfDNA),它来自释放 DNA 片段进入循环的濒死细胞。在肿瘤患者中,部分cfDNA 起源于凋亡或坏死的肿瘤细胞,称为循环肿瘤DNA(ctDNA)。循环肿瘤DNA (ctDNA)具有肿瘤特异性基因改变,可以更好地捕获肿瘤内异质性。此外作为一种液体活检,ctDNA是一种非侵入性和更可行的工具,允许连续采样用于疾病监测。二代测序 (NGS) 的发展由于其高通量和更好的灵敏度,促进了遗传变异的鉴定和 ctDNA 的定量。ctDNA已成为跨肿瘤学(包括淋巴瘤)的一种有前景的肿瘤特异性生物标志物。
在淋巴瘤领域,部分研究探索 ctDNA 在确定突变谱和追踪克隆演变中的潜力,而另一些研究则关注 ctDNA 作为肿瘤负荷的替代物和作为风险分层和疾病监测的生物标志物。且大多数 ctDNA 技术的研究集中于DLBCL,少数研究集中于ENKTL,而对 ctDNA 检测在成熟 T 细胞淋巴瘤中的性能知之甚少。
《British Journal of Haematology》近日发表了周道斌教授为通讯作者的一篇前瞻性研究,作者评估了血浆 ctDNA 在确定突变特征、评估肿瘤负荷、预测临床结局和作为 PTCL 患者疾病监测生物标志物中的实用性。


该研究是在北京协和医院开展的前瞻性单中心研究,共入组50例患者并收集相关临床资料,患者入组标准包括:年龄≥18岁;新诊断为成熟 T 细胞和 NK 细胞肿瘤并在协和医院接受治疗;根据2016年世界卫生组织造血和淋巴组织肿瘤分类,病理学结果为PTCL,NOS、ALK+ 和ALK−ALCL、AITL、nTFHL或ENKTL。
ENKTL 患者接受 GDP-ML 方案(吉西他滨、顺铂、地塞米松、甲氨蝶呤和培门冬酶)联合序贯放疗治疗局部病灶。ENKTL 以外的病理亚型患者主要接受CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松)方案为主的化疗,其中5例患者参加西达本胺联合CHOEP(环磷酰胺、多柔比星、长春新碱、泼尼松和依托泊苷)方案治疗初治 PTCL的 1b/2 期试验,18例患者参加西达本爱、阿扎胞苷联合 CHOP 与 CHOP 方案治疗既往未经治疗的 PTCL 的3期试验。
所有患者接受cfDNA 采集管采集样本和提取 DNA,并进行文库构建、靶点富集和 NGS 测序。
患者特征
入组的50例患者中有48例可获得cfDNA,2例患者由于在血浆样本提取前开始治疗而未取得 cfDNA,领有1例由于 cfDNA 量较低导致文库构建失败,无法评估突变特征,因此最终在47例新诊断为成熟 T 细胞和 NK 细胞淋巴瘤的患者中评估了突变特征。47例患者的基线特征和治疗列于表1。诊断时中位年龄55 岁,男:女为2.6:1。多数患者临床分期为Ⅲ-Ⅳ期 (38/47,80.9%)。17/44例 (38.6%) 患者检出血清EBV-DNA(≥500拷贝/mL)。诊断时15例伴 (31.9%) 骨髓受累,23例 (48.9%) 患者有≥1个结外受累部位。IPI 评分 > 2分的患者比例为30/47(63.8%)。组织学亚型包括ENKTL(n = 11)、PTCL、NOS(n = 12)、AITL(n = 14)、nTFHL(n = 3) 和ALCL(n = 7)。

通过血浆cfDNA评估的突变特征
47份血浆 cfDNA 样本中共鉴定出279个体细胞突变,涉及149个基因。在45/47例 (95.7%) 患者的治疗前血浆样本中检测到ctDNA。每个样本的中位突变数量为5.9。图 1A 为47个血浆 cfDNA 样本的突变谱。ctDNA 基因分型最常突变基因为 TET2(35.6%),RHOA(26.7%),IDH2和 STAT3(分别15.6%)。与典型突变谱一致,AITL和 nTFHL 的表观遗传学失调程度最高,包括15/17(88.2%) 的AITL 或 nTFHL 患者存在 TET2 突变,12/17(70.6%) 存在 RHOA 突变,7/17(41.2%) 存在 IDH2 突变,5/17(29.4%) 存在DNMT3A突变。

在FFPE组织活检中验证突变
为验证 cfDNA 中检测到的突变,对36例可用患者配对 FFPE 组织样本的肿瘤 gDNA (基因组DNA)进行基因分型,其余11例病例无法进行基因分型。36例组织样本均发现突变,每个组织样本的中位突变数量为7.5,平均 VAF 为15.4%。比较了血浆 cfDNA 基因分型和配对肿瘤 gDNA 基因分型的结果。肿瘤 gDNA 的基因分型确定了271个突变,涉及147个基因(突变谱如图 1B 所示),而血浆 cfDNA 的基因分型在配对的36个血浆样本中共确定了253个体细胞突变,涉及137个基因。
在血浆 cfDNA 和肿瘤 gDNA 中均发现了大多数 (N=191) 突变(图2A)。如果将肿瘤 gDNA 基因分型作为金标准,cfDNA发现活检证实突变的灵敏度为73.9%,特异性为99.6%。在不同的病理亚型中,ALCL在发现组织证实的突变方面表现出 cfDNA 最高的平均灵敏度(平均灵敏度95.0%),而 ENKTL 表现出最低的平均灵敏度(平均灵敏度34.9%)(图2C)。
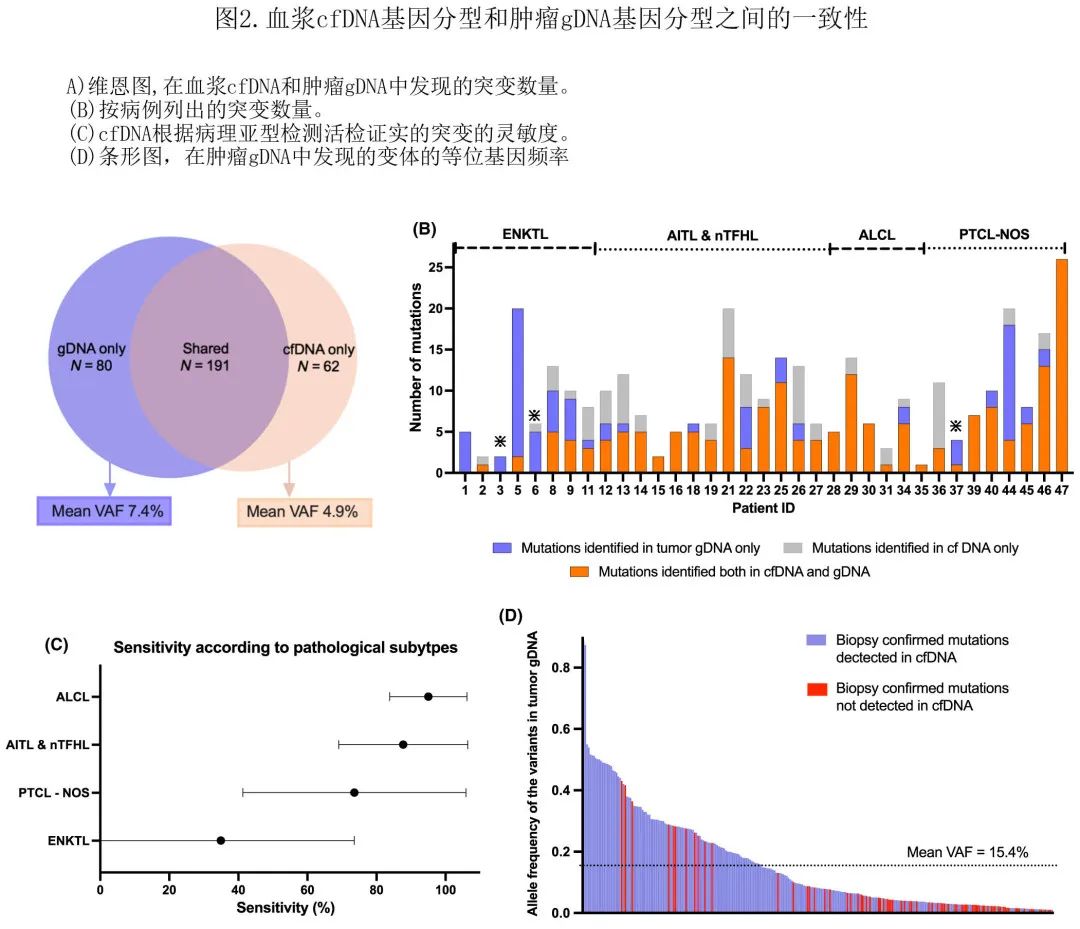
在肿瘤 gDNA 中发现但在 cfDNA 中未发现的突变通常为较低VAF(平均VAF = 7.4%)(图2D)。排除肿瘤活检中的低 VAF 突变 (VAF<5%) 后,cfDNA发现活检证实突变的灵敏度增加至81.9%。值得注意的是,在3例接受原发性肿瘤切除活检的患者中cfDNA基因型的敏感性较低,可能导致 cfDNA 采样前肿瘤减瘤(图2B)。此外,血浆 cfDNA 基因分型揭示了组织 gDNA 中检测不到的另外62个体细胞突变,这些突变也为低VAF(平均VAF = 4.9%)。
治疗前ctDNA与基线临床因素的相关性
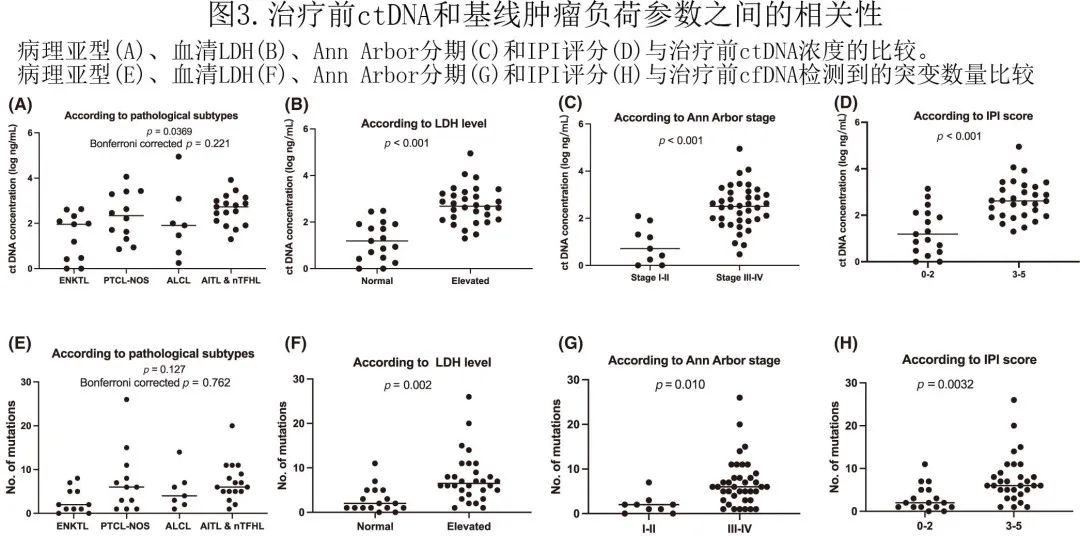
进一步比较治疗前 ctDNA 参数(包括 ctDNA 浓度和突变数量)与按不同临床因素的相关性(包括LDH、Ann Arbor分期和 IPI 评分)。治疗前 ctDNA 的平均浓度为2.18 log ng/mL。LDH 升高、Ann Arbor晚期和 IPI 评分>2分的患者治疗前 ctDNA 浓度和突变数均明显增高(所有病例p<0.05)(图3B—D、F—H),而两种治疗前 ctDNA 参数均与 Bonferroni 校正后的病理亚型无明显相关性(图3A,E)。
治疗前ctDNA的预后价值
作者进一步评估了治疗前 ctDNA 预测治疗反应的性能,其中43例患者中可评估缓解。达到 CR/PR 缓解的患者的治疗前 ctDNA 浓度显著低于 PD/SD 缓解患者(平均 ctDNA 浓度,2.6 ng/mL vs. 1.8 ng/mL,p=0.015)。使用受试者工作特征分析确定了治疗前 ctDNA 的优化阈值,以分层治疗反应、PFS和OS(图4A–C)。当使用1.9 log ng/mL的阈值将 ctDNA 分为低水平和高水平时,治疗前 ctDNA 水平高的患者的 CR 率和客观缓解率 (ORR) 低于 ctDNA 水平低的患者(CR率,20.0% vs.46.2%,p=0.079;ORR,26.7% vs.76.9%,p=0.002)(图4D)。

作者最后评估了 ctDNA 预测生存结局的能力。中位随访时间19个月,治疗前 ctDNA 水平高的患者1年PFS (17.9% vs. 51.6%,p=0.004) 和 OS 率显著低于水平低的患者 (46.6% vs. 84.6%,p=0.007)(图4F,G)。单变量分析纳入了已确定的 PTCL 风险因素,包括年龄、ECOG体能状态、LDH水平、结外部位数量和 Ann Arbor 分期以及治疗前 ctDNA 水平,发现治疗前高ctDNA 是 OS 的不良预后因素(HR=4.895,p=0.015)(图4E)。将单变量分析中p<0.05的因素纳入多变量分析,包括 ECOG 体能状态、LDH水平、结外部位数量和治疗前 ctDNA 水平,结果仅 ECOG 体能状态>1为 OS 的独立风险因素。由于 IPI 评分系统是 PTCL 常用的预后模型,进一步将 IPI 评分和治疗前 ctDNA 水平纳入多变量分析,发现控制 IPI 后,治疗前高 ctDNA 水平保持其对 OS 的独立预后价值 (HR=4.895,p=0.015)。
通过cfDNA进行纵向监测
为探索 ctDNA 在监测疾病中的表现,对14例患者进行 ctDNA 纵向分析并作为初步探索,需要至少在治疗前和治疗后进行动态采样。在缓解患者(PR或 CR 缓解)(N=7) 中,治疗结束时从基线样本测定的单个突变的 VAF 和 ctDNA 浓度几乎均检测不到(图5A,C);而在无缓解患者(SD或 PD 应答)(N=7) 中,基线突变的 VAF 和 ctDNA 浓度在治疗结束时仍可检测到较高水平(图5B,C)。图D和E是两名典型AITL患者。

本研究表明 ctDNA 是 PTCL 突变谱分析的可靠工具,还可作为估计肿瘤负荷、预测生存期和实时跟踪治疗反应的有用工具,可作为PET 影像学的补充手段。
参考文献
Chong Wei, Wei Wang, Yan Zhang ,et al. Mutation profiling, tumour burden assessment, outcome prediction and disease monitoring by circulating tumour DNA in peripheral T-cell lymphoma.Br J Haematol . 2023 May 3. doi: 10.1111/bjh.18824.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







