【Leukemia】诊断后两年内复发的DLBCL患者的遗传学和转录组学分析
2024-01-02 聊聊血液 聊聊血液 发表于上海
为进一步了解耐药和疾病进展的机制,并开发用于识别发生早期R/R风险患者的分子学工具,天津医科大学肿瘤医院张会来教授团队联合瑞典卡罗林斯卡医学院、乌普萨拉大学和华大基因共同开展一项研究。
早期复发DLBCL的遗传学
大部分弥漫性大B细胞淋巴瘤(DLBCL)患者在标准R-CHOP或类似方案治疗下可实现治愈,但也有大约1/3的患者经历难治或复发性(R/R)疾病,且大多数复发发生于最初的几年内。对于DLBCL患者,迫切需要在诊断后的最初几年内识别出可能发生R/R的患者,从而从CAR-T、双抗、抗PD1抗体、抗CD19抗体和抗体-药物偶联物等新型疗法中获益,以进一步改善DLBCL患者的总体预后。
IPI是临床常用预后模型,而更先进的预后工具则包含一系列临床参数、生物标志物和基因表达谱,并结合免疫组化或分子学技术。这些工具包括通过基因表达谱基于细胞起源(COO)鉴定出两种主要DLBCL亚型——GCB和ABC;双/三打击”淋巴瘤;根据基因改变(突变、拷贝数变异(CNV)和选择性易位)确定与患者不同结局相关的分子亚型;R/R肿瘤的直接测序表明,部分基因突变可能与治疗耐药相关,但预后价值有待证实;基于转录组学分析的基因表达签名或肿瘤细胞状态和生态系统可用于预测DLBCL患者的总生存期(OS)。但迄今为止,在评估患者预后时仍缺乏对比或整合遗传学和转录组特征的研究。
为进一步了解耐药和疾病进展的机制,并开发用于识别发生早期R/R风险患者的分子学工具,天津医科大学肿瘤医院张会来教授团队联合瑞典卡罗林斯卡医学院、乌普萨拉大学和华大基因共同开展一项研究,对2805例接受R-CHOP治疗的DLBCL患者的诊断性(未治疗)肿瘤进行全面的基因组和转录组学分析,包括887例两年内复发的高危患者,并开发了一个可以预测两年R-CHOP治疗效果的模型。研究结果近日发表于《Leukemia》。

研究方法
本文包括作者自己的研究队列和其他6个已发表的具有临床、DNA突变和/或基因表达数据的队列:作者队列纳入2001~2015年在中国(n=88)或瑞典(n=73)诊断的161例接受R-CHOP治疗的DLBCL患者,还纳入6个已发表且有临床/DNA突变/基因表达数据的DLBCL队列进行分析,各队列可获得或预测LymphGen亚型的信息。
作者对两年内发生R/R疾病的887例患者的临床特征、突变谱和基因表达模式进行描述,并将这些数据与两年后仍处于缓解状态的1918例患者的数据进行比较。此外还建立一个能够有效预测DLBCL患者,特别是早期R/R疾病患者的治疗结局的模型。
研究结果
不同DLBCL队列的临床特征
为了研究R-CHOP治疗后发生早期R/R的DLBCL患者的特征,作者最初纳入中国和瑞典的161例DLBCL患者,其中50例(31%)在两年内发生R/R疾病,被归为预后不良,而其余在两年时仍处于缓解状态的患者归为预后良好。正如预期,与预后良好的患者相比,预后不良的患者往往年龄较大、ABC亚型的比例较高、诊断时的疾病较晚期、IPI评分较高。
为验证该发现,作者使用相同的纳入标准汇集了6个已发表队列的数据,该队列包括2644例患者(图1A, B),其中约32%(29% ~ 37%)的患者在2年内发生R/R疾病(图1C),尽管各队列的各项参数存在差异,但患者表现出相似的高危特征。此外,从重叠的生存曲线可以看出,所有队列的PFS无统计学差异(图1D)。
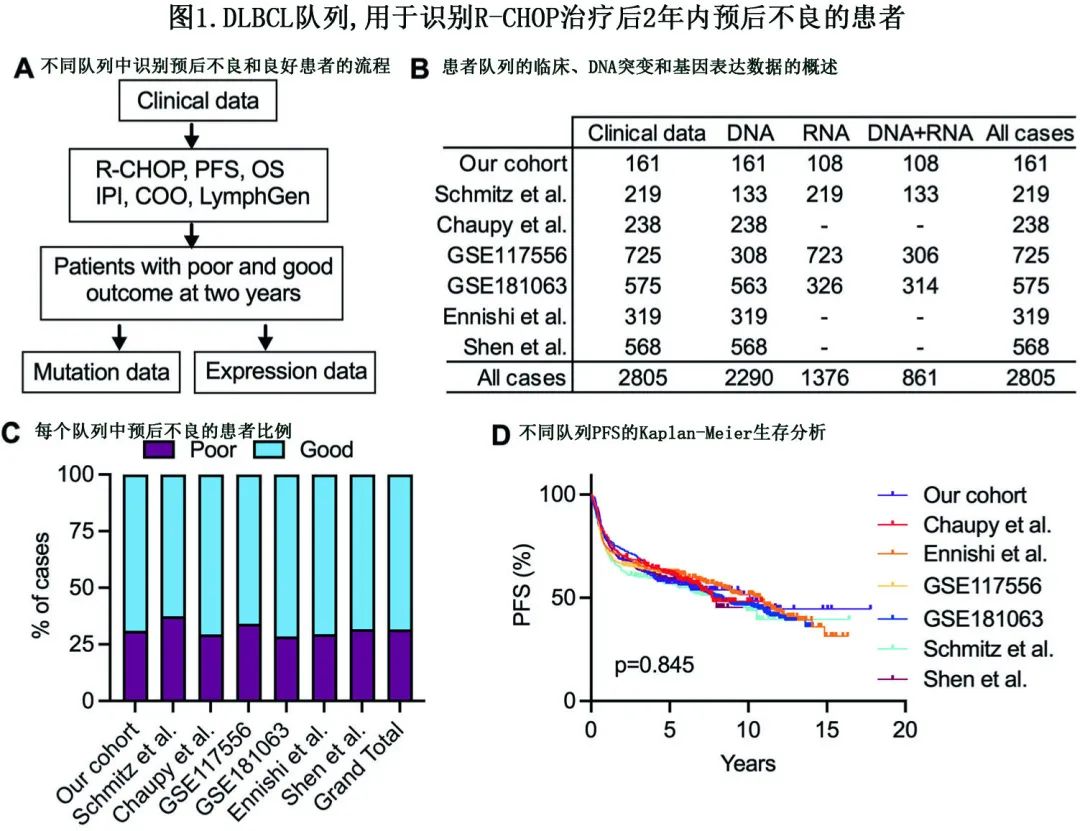
上述结果提示,预后不良的DLBCL患者具有共同的高危特征,并且在不同队列中表现出相似的临床结局。此外该整体分析形成了一个由2805例统一接受R-CHOP治疗的DLBCL患者队列,其中887例在2年内预后不良。此外,作者获得了2290个样本的遗传数据和1376个样本的转录组数据(图1B),其中861个样本同时具有两种数据,因此可以进行全面的整合基因组和转录组分析。
预后不良DLBCL患者的突变谱
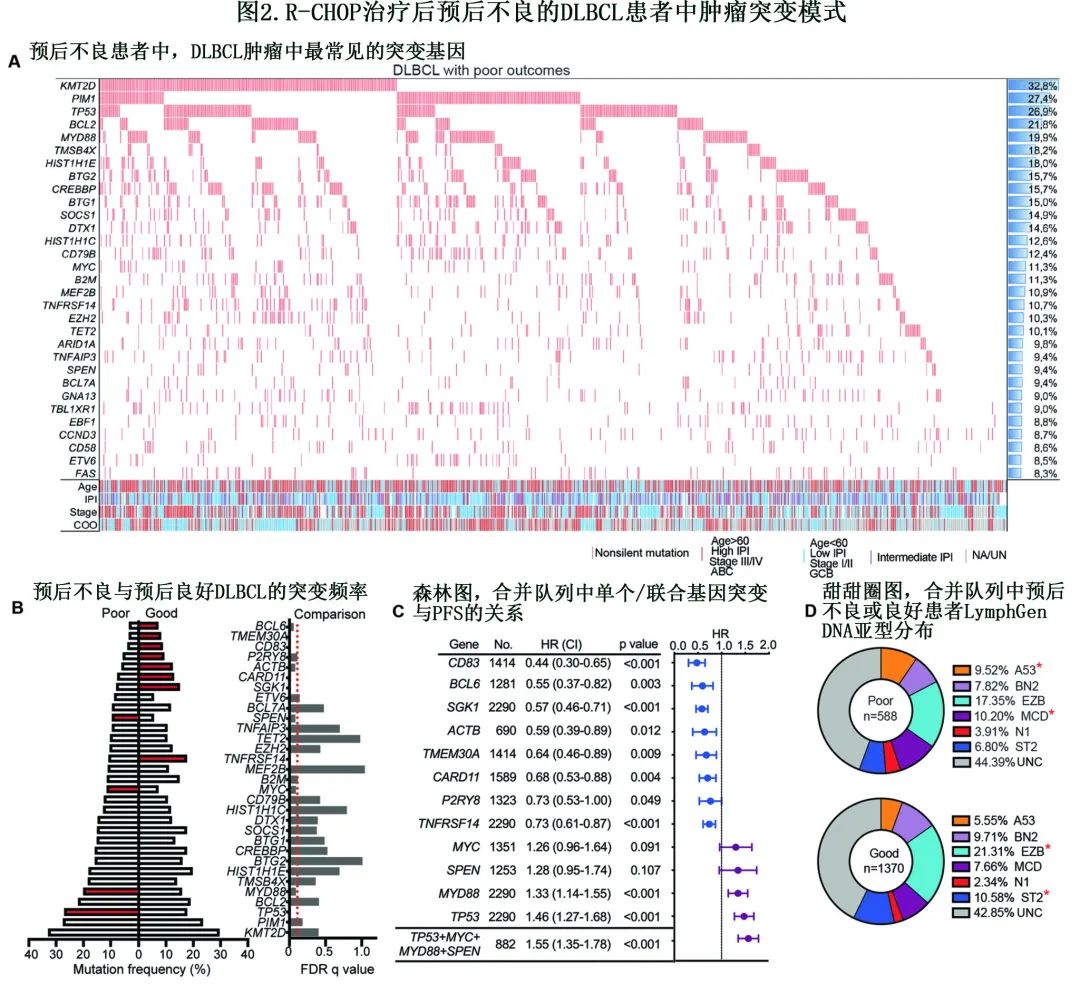
为研究DLBCL 2290个肿瘤的突变谱,重点关注在所有队列中均可测序的基因,并特别检查在≥3个队列中报告的基因,从而确定了99个基因用于进一步分析。在这些突变中,有24种突变在≥10%的DLBCL中发现,包括KMT2D、PIM1、TP53、BCL2、HIST1H1E、MYD88、CREBBP和其他;其中许多基因既往已确定为DLBCL的重要突变靶点。此外,与各队列中的结果一致,这99个基因的突变频率在合并队列中表现出很强的相关性(Pearson′s相关系数;r值:0.863 ~ 0.963),表明不同队列之间的突变模式具有一致性。在7个队列中检查重叠基因的突变频率时,也观察到相似的一致性。
随后对合并队列中预后不良DLBCL患者(包括702例患者)的突变谱进行重点分析,在≥5%的样本中发现57个受非沉默性突变影响的基因,其中20个基因在≥10%的病例中发生突变(图2A)。在预后不良DLBCL中,最常见的突变基因为KMT2D(32.8%)、PIM1(27.4%)、TP53(26.9%)、BCL2(21.8%)、MYD88(19.9%)、TMSB4X(18.2%)、HIST1H1E(18.0%)、BTG2(15.7%)等。然后比较预后不良和预后良好患者的肿瘤突变谱,发现在预后不良的DLBCL中,有4个基因突变(TP53、MYD88、SPEN、MYC) 显著富集(p<0.1)和8个基因突变(CD83、BCL6、SGK1、ACTB、TMEM30A、CARD11、P2RY8、TNFRSF14)显著缺失(图2B)。在各队列中对这些基因进行检查显示,各队列中预后不良组的突变频率趋势基本相似。此外,Cox回归分析表明,4个富集基因的突变与较差的PFS相关,而8个缺失基因的突变与较好的PFS相关(图2C)。4个富集基因(TP53 + MYD88 + SPEN + MYC)的突变联合分析显示,其风险比略高于单个基因(1.55 vs 1.26~1.46;图2 c)。最后,大约53%的样本可分类为已知的LymphGen亚型,显示A53和MCD亚型在预后不良的患者中显著过表达,而EZB和ST2亚型在预后良好的患者中富集(图2D)。这些发现表明,DLBCL患者中独特的突变谱与早期R/R相关。
预后不良DLBCL患者的基因表达谱
为比较预后良好组和预后不良组的基因表达谱,首先对RNAseq数据集(n=327)中的差异表达基因(DEG)进行分析,包括122例预后不良的病例。在该数据集中,与不良预后相关的DEG具有以下特征:一小组上调基因(n=73),包括BCL2、BLNK、CXorf21、CD72、IGLL5、CCND2、TNFRSF8、NME1、BTLA和CD52,以及一大组下调基因(n=1472),其中包括49个在淋巴瘤和免疫检查点基因(CTLA4、TIGIT、CD80)中频繁突变的基因(图3A)。在DEG中,SGK1、CD83、BCL6、P2RY8基因在预后不良DLBCL中突变频率较低,而SPEN基因在预后不良的DLBCL中突变频率较高。随后分析基于微阵列的数据集(n=1049)中的DEG,包括336例预后不良的病例,并进一步将它们与基于RNA测序的数据集的DEG进行比较;发现372个重叠基因(图3B),分别占各自队列中总DEG的24%和39%。值得注意的是,在这些重叠的DEG中,98%以上(367个)在两个队列中均显示一致的上调或下调,提示不同数据集和患者组之间的总体一致性。然后对重叠的DEG进行基因集富集分析(GSEA),并确定了几个显著富集的通路,包括细胞黏附/迁移/增殖、PI3K、T细胞活化、T细胞受体、NF-κB信号和PD-1表达/检查点通路(图3C, D)。

预测早期R/R疾病的风险模型:建立和验证
为建立能够代表早期R/R DLBCL的稳健风险模型,作者采用分位数标准化法整合基于RNAseq的数据集和基于微阵列的数据集,创建了大型标准化数据集(N=1376),该样本随后随机分配为开发队列和验证队列(分别为70%和30%)。
首先进行单变量Cox回归来评估PFS和基因表达水平,从整个队列中识别出656个预后基因,其中242个与372个DEG=重叠(图3B)。使用这242个基因的表达水平和每例患者的两年结局作为输入,随后使用LASSO算法提取开发队列(n=964)中的风险签名。在1000个已建立的组合中,在预测2年结局方面,在测试队列中具有最高AUC值和准确性的24基因panel得以选择作为最佳风险模型/签名(图4A)。值得注意的是,上述基因中有部分在相关细胞过程/通路中发挥作用,包括BCR信号传导(RFTN1)、蛋白激酶(SGK1)、凋亡(FAS)、细胞分化标记物(CD28, CD3E, ITGAX, LY75, TNFRSF13C/BAFFR)、细胞因子和生长因子(PLAU)以及转录因子(LMO2, EGR1, TCF7)。
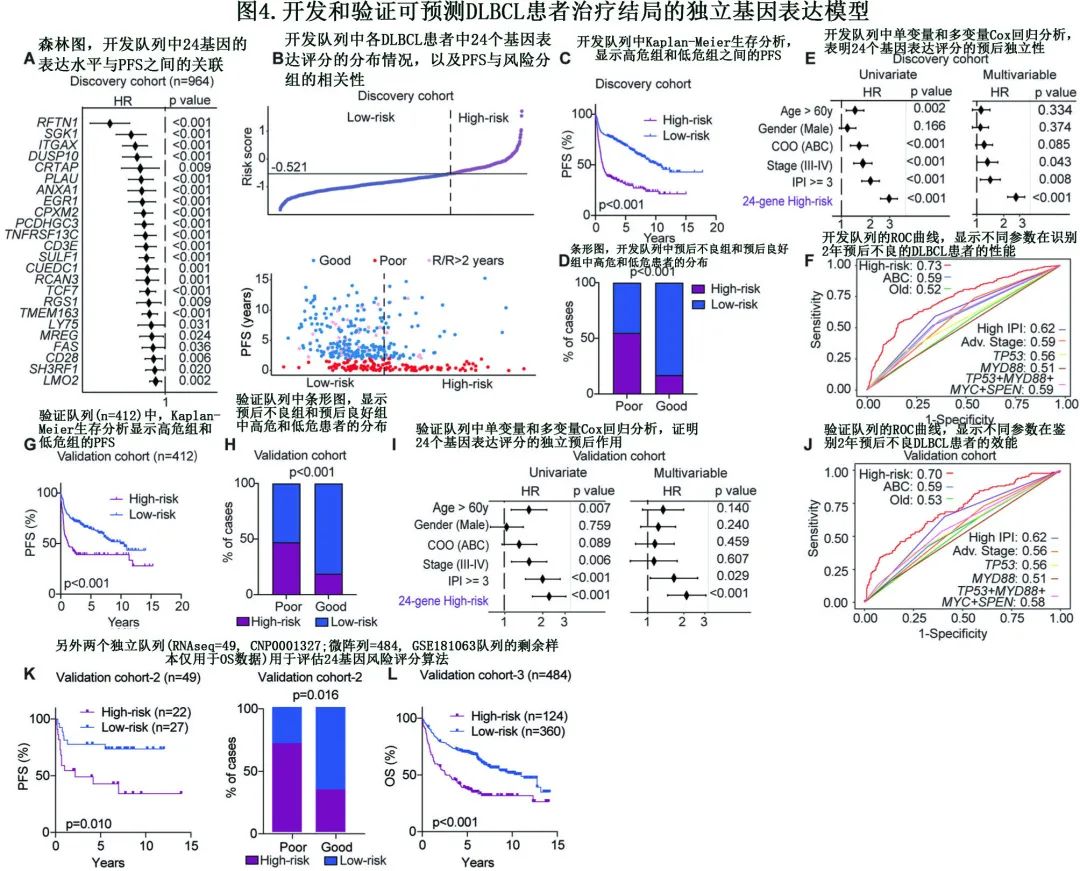
随后,作者利用在每个肿瘤中计算的24基因表达评分,根据在预测2年结局时在敏感性和特异性之间提供最佳权衡的阈值,将患者分为高危和低危组(图4B);高危DLBCL患者的PFS显著较差,并且与低危组的患者相比,高危患者中更高比例在2年内出现不良结局(图4C, D)。此外,在预测2年结局方面,24基因风险评分显示阳性预测值(PPV)为0.61,阴性预测值(NPV)为0.79,总体准确性为74%。多变量分析显示,该24基因风险评分是一个2年预后的独立预测因子(p<0.001),即使在针对关键临床危险因素进行校正后也是如此(图4E)。此外,ROC曲线分析表明,24基因评分分层在预测2年结局方面优于COO亚型、关键临床参数和各种突变状态(TP53、MYD88等)(图4F)。此外,纳入在预后不良患者中发现的4个优先突变基因(单独或联合)的突变状态,并未提高其对早期R/R DLBCL的预测效能。
与开发队列的结果一致,验证队列的高危患者中也观察到较差的PFS和较高比例的不良预后患者(n=412;图4G,H)。验证队列中预测2年结局的PPV、NPV和总体准确率分别为0.55、0.75和70%,略低于开发队列。多变量分析和ROC曲线证实了24基因风险评分的独立预测能力,在验证队列中预测两年结局的AUC值为0.7(图4I, J)。此外,将突变状态(TP53, MYD88, SPEN, MYC)与24基因风险评分相结合也未能提高预测性能。
后续评估(特别是在有双打击和双表达状态的样本中)进一步证实了其独立预后价值。此外,ROC曲线与现有基于基因表达的分层模型的比较表明,24基因风险评分在预测2年结局方面具有最佳性能。此外各个队列的结果显示,24基因表达、PFS差异以及高危组和低危组患者分布的模式相似。最后,24基因评分算法在另外两个不同平台的队列中也得到成功验证(RNAseq, n=49;微阵列,n=484)(图4K-L)。这些发现强调了24基因表达评分作为预测DLBCL早期疾病进展的独立预后工具具有稳健性和普遍适用性。
24基因表达评分与DLBCL COO亚型的相关性
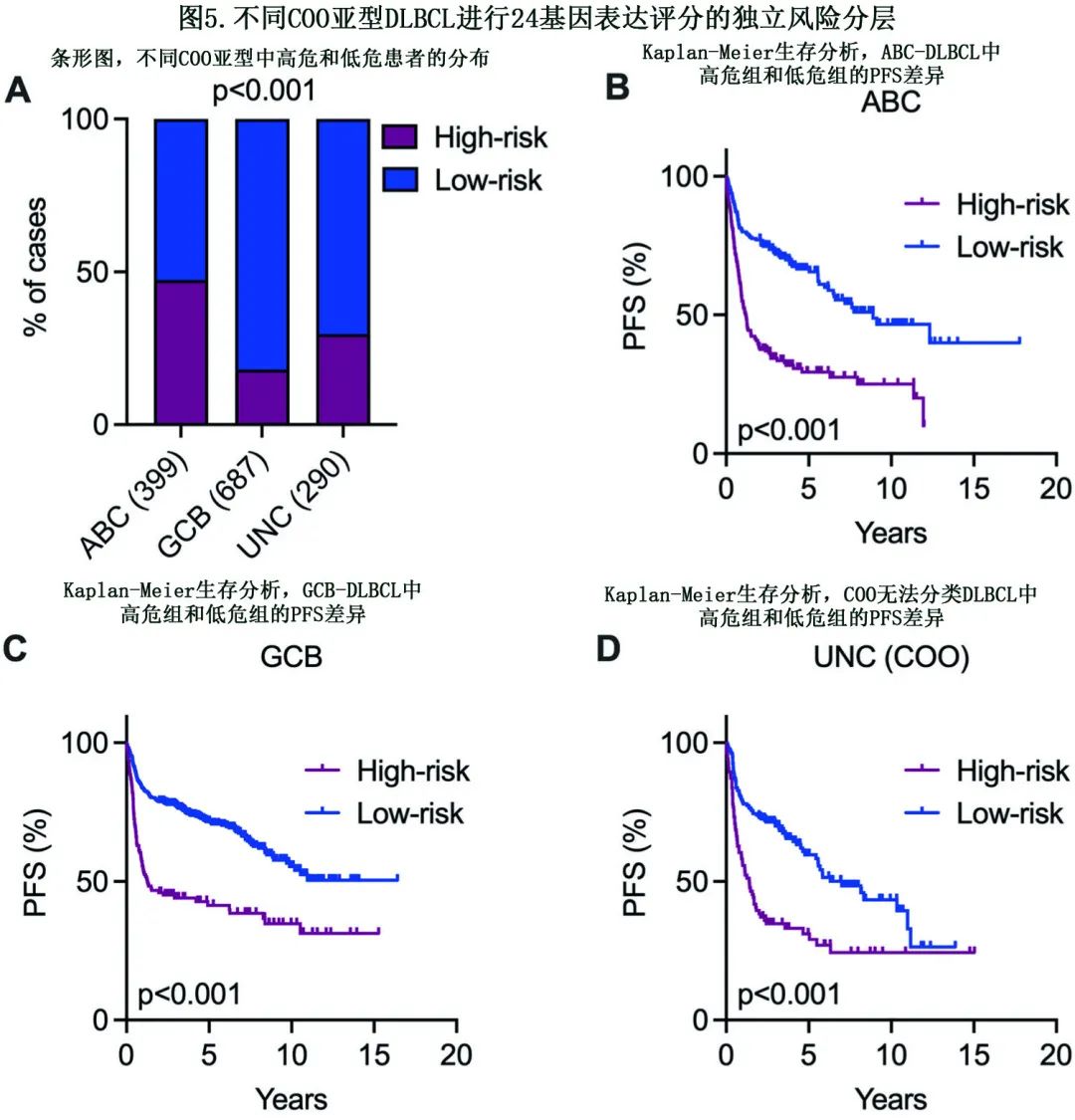
作者接下来评估了24基因表达评分和COO亚型之间的相关性(COO亚型是DLBCL患者结局的已知预测因素)。在整个队列(n=1376)中,ABC-DLBCL患者中归类为高危的比例显著较高,而GCB-DLBCL和无法分类的病例归类为高危的比例较低(图5A)。此外,与低危组相比,被分类为高危的患者在ABC和GCB亚型中均显示出显著较差的PFS(图5B, C)。值得注意的是,24基因风险评分也可有效地在无法分类COO病例中识别出高危患者(图5D)。此外,这些结果在发现、验证和各队列中一致,表明在对合并数据的分析中没有显著的队列相关偏倚。总之,该研究结果表明,24基因表达评分可以进一步在COO亚型中对高危患者进行分层,包括无法分类病例。
使用24基因表达评分对LymphGen亚型中的高危患者进行分层
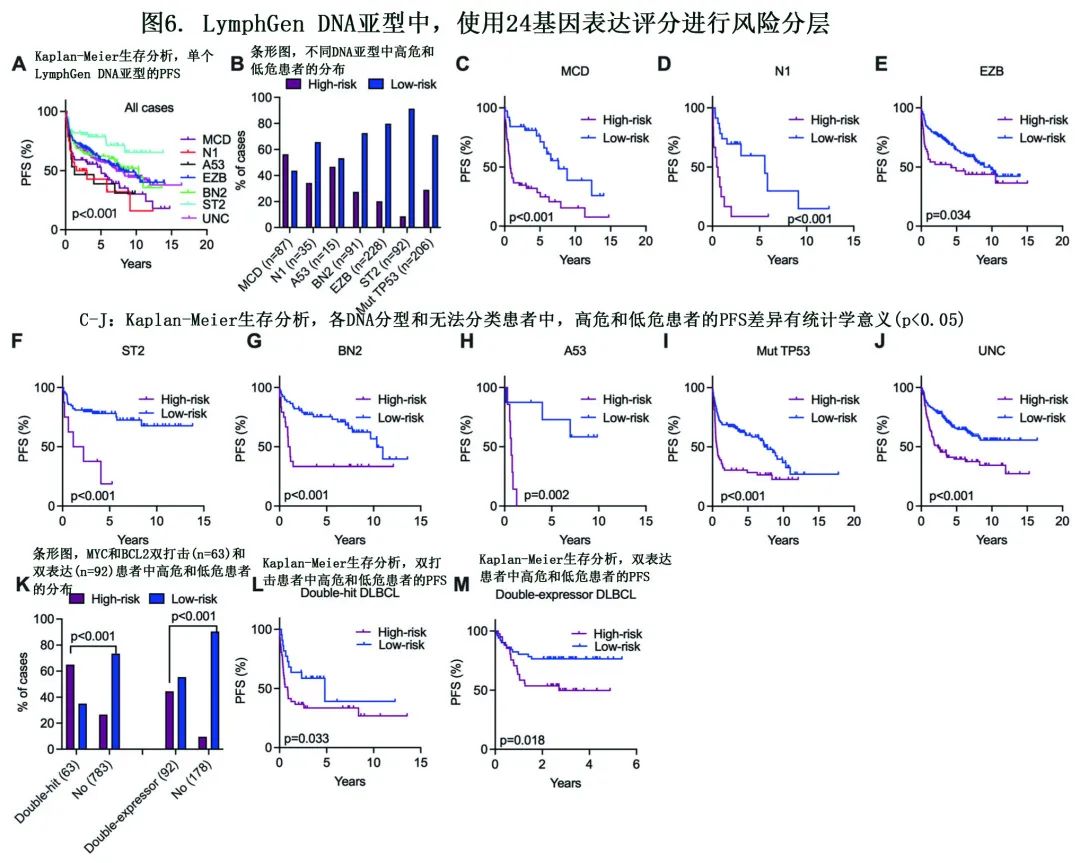
为评估DLBCL中24基因表达评分与DNA分子学亚型之间的潜在关系,作者研究了不同LymphGen亚型之间风险评分的表现。在有转录组学数据的1376例样本中,有956例获得了LymphGen亚型信息。在整个队列中,MCD、N1和A53亚型与较差的生存期相关,而EZB、BN2和ST2亚型的预后良好(图6A)。高危和低危患者在DNA亚型中的分布见图6B, 证实24基因风险评分在所有DNA亚型中可有效进一步分层出高危患者 (图6C-H)。由于淋巴细胞A53亚型主要由TP53突变和CNVs定义,并且由于三个队列(本队列/GSE117556/ GSE181063)中没有CNV数据,作者对有TP53突变的DLBCL进行独立分析(n=206)。值得注意的是,携带TP53突变的患者中,分配至高危组的PFS显著劣于分配至低危组的患者(图6I)。此外,在284个无法分类病例中(未分配LymphGen亚型,也未发生TP53突变), 24基因风险评分仍能够有效地对高危患者进行分层(图6J)。此外,24基因风险评分还显示出其在将双打击和双表达基因分配到高危组中的显著能力(图6K),并进一步识别每个亚型中的高危患者(图6L-M)。此外,该分析在开发队列和验证队列中分别进行,结果显示在合并队列中观察到相对一致的结。因此,24基因表达评分的效用可扩展到各遗传学亚型的风险分层。
总结
为进一步阐明R/R疾病的潜在机制,并开发识别早期疾病进展风险患者的方法,作者整合了来自7个独立队列的2805例R-CHOP治疗患者的临床、遗传和转录组数据;其中887例患者在两年内出现R/R疾病(预后不良),1918例患者在两年后仍处于缓解状态(预后良好)。该研究在预后不良的患者未经治疗的(诊断性)肿瘤样本中发现4个优先突变基因(TP53, MYD88, SPEN, MYC)。此外,转录组学分析揭示了与不良预后相关的独特基因表达模式,可影响细胞黏附/迁移、T细胞活化/调节、PI3K和NF-κB信号通路。此外作者开发并验证了24基因表达评分作为治疗结果的独立预后预测因子。当与现有遗传学或COO亚型(包括这些模型中无法分类的病例)整合时,该评分还证明了在进一步分层高危患者方面的有效性。最后,基于这些发现,作者开发了一个在线分析工具(https:// lymphprog.serve.scilifelab.se/app/lymphprog),可用于DLBCL患者的预后预测。
总的来说,该研究利用来自多个队列的数据确定了与DLBCL患者不良预后相关的突变基因、通路改变和基于基因表达的风险签名。然而,尽管合并了多个队列来获得一个相对同质的数据集,但从单个队列获得的数据类型之间的相当大的异质性(样本来源、测序平台/方法、基因组变异检测[variants calling]、识别预后基因和DEG的阈值)仍可能引入变异性。因此,该研究的发现可能需要在其他队列中进一步验证。为了进一步提高24基因表达评分的预测价值,还可以考虑纳入其他遗传/表观遗传特征,如全基因组突变签名、CNV、非编码驱动基因、RNA编辑和肿瘤微环境,以及补充工具的应用,如蛋白质组学、代谢和单细胞研究。
参考文献
Ren, W., Wan, H., Own, S.A. et al. Genetic and transcriptomic analyses of diffuse large B-cell lymphoma patients with poor outcomes within two years of diagnosis. Leukemia (2023). https://doi.org/10.1038/s41375-023-02120-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#R-CHOP# #弥漫性大B细胞淋巴瘤#
22