心源性休克机械通气策略
2023-10-11 重症医学 重症医学 发表于上海
心源性休克患者经常需要机械通气治疗,本综述目的在于总结和讨论临床医生在设置呼吸机参数时,应考虑的证据和病理生理学机制。
综述目的
心源性休克患者经常需要机械通气治疗,本综述目的在于总结和讨论临床医生在设置呼吸机参数时,应考虑的证据和病理生理学机制。
近期研究
很少有人关注心源性休克患者的机械通气策略。心源性休克出现肺衰竭提示预后不良,也与机械通延迟有关。考虑到心力衰竭的前负荷依赖性,必须确定血流动力学特征和心源性休克的原因,以调节通气设置。
总结
越来越多证据表明,肺衰竭是预后不良因素之一,积极正压通气是心力衰竭一线治疗的一部分。
要 点
@心源性休克所致呼吸衰竭,常需要机械通气
@正压通气可逆转低氧血症,降低跨壁压力,有利于心肌和终末器官灌注,降低左室后负荷
@机械通气设置必须根据心源性休克的病因病理进行调整,特别是在右心室衰竭和/或高度前负荷依赖的情况下。
@心源性休克患者最佳通气策略的数据证据,目前仍存在空白
前 言
尽管心源性休克患者通常需要机械通气,但急性呼吸衰竭(ARF)患者的最佳通气策略仍缺乏大规模流行病学研究和临床数据。此外,与流行病学、病理生理学和治疗相关的数据主要集中在急性心肌梗死相关的心源性休克(AMI-CS)患者。本综述讨论了严重血流动力学不稳定患者心肺交互作用的生理和病理生理机制,以及通气参数的知识,并查阅了最新文献中的相关资料。
心源性休克呼吸衰竭的流行病学研究
在治疗急性低氧血症、呼吸功增加、气道保护和血流动力学或电生理不稳定方面,心源性休克机械通气使用率为43%-88%。此外,在过去的20年中,ARF的入院比例稳步上升,无创通气(NIV)和机械通气的使用频次也越来越高。
机械通气在心源性休克中的广泛应用可以解释为,与临床试验定义相比,以前真实世界登记数据中对心源性休克的定义存在巨大的异质性。最近的一项研究表明,ARF是AMI-CS患者最常见的心外并发症(高达43%的患者),并随着其他器官衰竭数量的增加而呈指数倍增加,这意味着预后不良.
在其他研究中,心源性休克和ARF患者的不良结局也有报道。在未经挑选的心源性休克患者中,AHEAD登记显示,使用NIV、机械通气或两者都有的死亡率分别为69%、72%和68%,显著高于未使用机械通气的患者(即40%)。在个别报道中,经机械通气治疗的AMI-CS患者的总体死亡率约为40%。
心肺交互作用
虽然对心源性休克患者机械通气心肺交互作用生理和病理生理的全面解释超出了本综述范围,并且在杂志上已经发表,但是临床医生应该了解一些基本的生理交互作用。
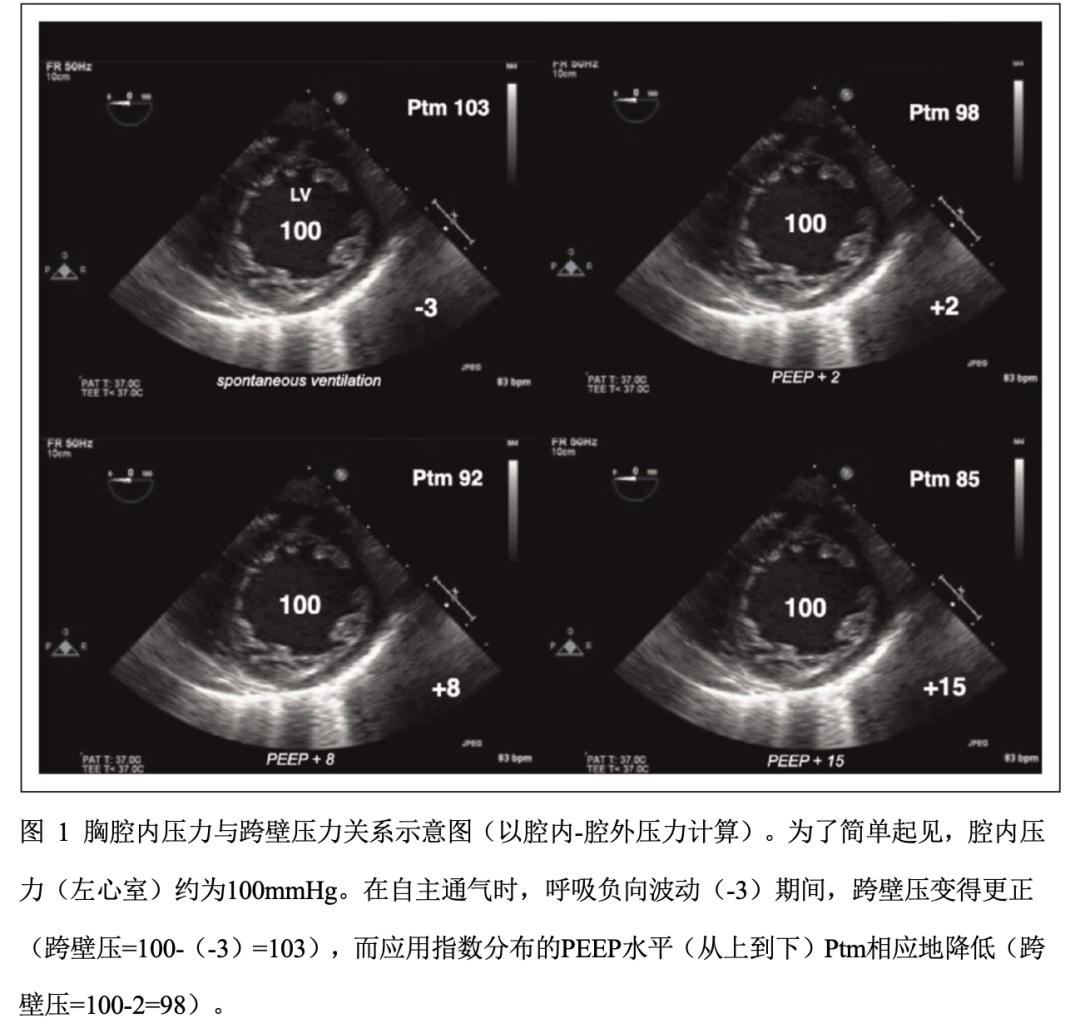
心肺交互作用是基于胸内压力(ITP)和肺体积的变化对静脉回心血量和心室射血的影响。腹腔和右心房之间存在压力梯度,是静脉回心血量的主要决定因素之一。在自主呼吸时,吸气相ITP出现生理性负向波动,静脉回心血量增加,随后右心室(RV)容积增加,导致室间隔向左心室(LV)轻微移动,导致左室舒张末期容积和顺应性的相对降低。对于没有呼吸窘迫和前负荷不足的患者,这些变化与临床无关。相反,在那些呼吸努力(呼吸速率或潮气量增加)和/或前负荷不足的人中,呼吸循环的变化将产生奇脉和发生潜在的显著心脏输出量(CO)改变和血流动力学损伤。需要记住的是,当ITP明显低于大气压时,静脉回心血量受到相当大的负向波动的限制。
当正压通气(PPV) 应用于ITP时,右心室和腹腔之间压力梯度下降,导致静脉回流减少,从而降低右室搏出量。然而随着腹壁肌和膈肌收缩引起腹内压增加,降幅达最小。
与心脏压塞或右室功能不全相关的严重低血容量,以及心源性休克必须考虑这些变化,其中RV具有前负荷依赖性,加上PPV可能会导致静脉回心血量突然减少,以及后负荷增加,使血流动力学急剧恶化。
相反,呼气末正压(PEEP)可能对左心室血流动力学有积极影响。机械通气增加了氧合,降低了充血性心脏前负荷,减少左心室氧需求,改善了心肌缺血,如心内乳酸产生减少,逆转缺氧相关的肺血管收缩,减少呼吸功和整体代谢需求。此外,PEEP还可通过经壁(或经胸)降低肺动脉压力来影响左心室后负荷,从而利于左心室射血(图1)。
心源性休克中呼吸衰竭的病理生理学
心源性肺水肿是心源性休克呼吸衰竭的常见原因。心源性肺水肿(CPE)和心源性休克患者最常表现为湿冷型,其特征是心脏指数低、全身血管阻力和肺毛细血管楔压增加。这种表型占心肌梗死相关心源性休克患者的近三分之二,且大多数处于心力衰竭失代偿期,与无充血(干性)或组织灌注无改变(暖性)的患者相比,死亡率更高。
正常肺泡上皮细胞连接非常紧密,从循环中过滤到肺泡间质的液体和溶质不能进入肺泡,而间质中大部分被过滤的液体通过淋巴管返回体循环。肺微循环液体滤过的静水压约等于肺毛细血管静水压,一定程度上由蛋白质渗透压梯度进行平衡。
左心房和左室舒张末期压力升高(分别为LAP和LV-EDP) ,肺毛细血管静水压快速增加,改变了液体重吸收能力。虽然既往心脏状况可能导致LAP缓慢升高,但LAP超过25mmHg时肺泡将发生破裂。此外并发的炎症反应可能会改变血管通透性,导致肺水肿进一步加重。因此,间质和肺泡中液体的过量蓄积导致换气减少,并伴随发生与肺灌注不足相关的通气-灌注不匹配(分流效应)。由此导致缺氧,加之代谢需氧增加和反射性交感神经过度兴奋,不断发生的心肌缺血,恶性循环导致终末器官灌注不足,中枢性缺氧,最终发生多器官衰竭。在此基础上,如合并慢性阻塞性肺疾病或并发感染或炎症过程,可能会加重或进一步恶化气体交换过程和心肺交互作用。
心源性休克无创通气研究
对急性心源性肺水肿患者的研究表明,与单独吸氧相比,NIV可改善血流动力学,降低急性收缩性心衰和肺水肿患者的插管率,尽管有报道已证实关于死亡率的结果是有争议的。一项针对随机临床试验的荟萃分析显示,与标准治疗相比,持续气道正压通气(CPAP)可降低死亡率(相对危险度(RR)0.64;95%置信区间(Cl),0.44-0.92)和插管率(RR 0.44;95%Cl,0.32-0.66)。然而研究对象是急性心力衰竭伴/不伴心源性休克引起的急性心源性肺水肿。根据临床结果和病理生理获益机制,氧疗和NIV,特别是CPAP,是急性心力衰竭(AHF)和心源性休克院前一线治疗的一部分。
心源性休克机械通气研究
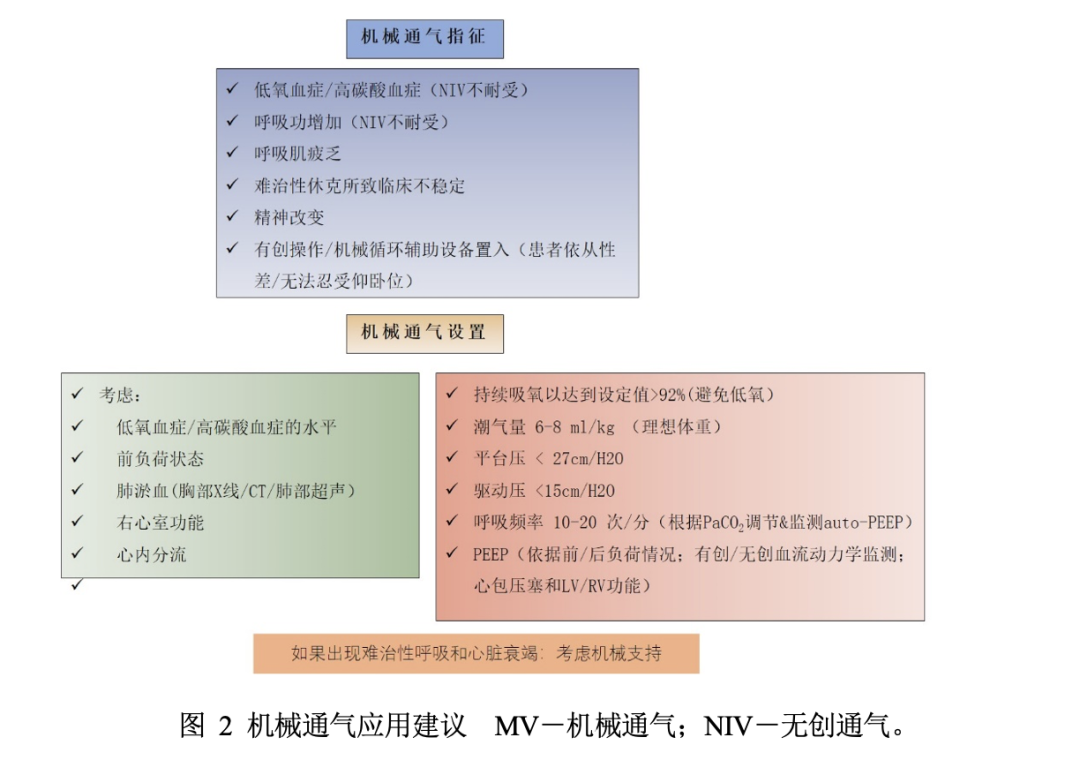
多因素决定是否启动机械通气支持,包括低氧血症(PaO2/FiO2)和高碳酸血症的程度,神经系统状态、血流动力学状态、气道保护能力、右心室功能不全程度以及最终要求的程序(图2)。一些数据表明, 急性冠状动脉综合征如果需要机械通气,是高死亡风险的更敏感指标。
气管插管的最佳时机尚没有确定。然而最近的一项TRIUMPH 试验,将难治性AMI-CS患者随机分为服用一氧化氮合酶抑制剂组或安慰剂组,结果显示在单变量和多变量分析(OR, 1.03; 95% CI,1.00–1.06)、以及敏感度分析 (OR, 1.04; 95% CI, 1.01–1.06)中,心肌梗死后机械通气每延迟1小时,都与死亡独立相关。
目前还缺乏有关诱导(插管)和维持镇静的具体药物的研究数据。考虑到插管期间血流动力学崩溃的高风险,抑制心血管药物(如依他胺、氯胺酮或苯二氮卓)和镇静剂应减少使用(在剂量和时间方面),以尽量减少呼吸机相关事件发生。
最近一项小样本研究(226名患者), 对接受NIV或机械通气患者进行比较,机械通气组意识障碍人数更多(83 vs.31%, P=0.001),乳酸水平更高(3.7 vs.1.7 mmol/l, P=0.001),血压更低,更频繁需要血管活性药物(去甲肾上腺素88vs.69%,P=0.03;多巴酚丁胺61vs.27%,P=0.001)。此外与NIV组相比,接受机械通气治疗的患者更容易出现代谢性酸中毒,低氧血症和高碳酸血症更严重,并在基线时需较高的氧浓度进行治疗。机械通气组的住院死亡率为45%,NIV组为19%(P=0.01),90天的死亡率分别为49%和27%(P=0.03)。然而使用CardShock风险评分相关变量校正疾病严重程度后,通气策略对90天死亡率无影响。机械通气组参数值越高,判断敏锐度更高。
一项关于需要机械通气治疗复杂性心肌梗死患者预测因素和预后的调查研究表明,死亡者心源性休克发生率更高(P<0.0016),需要更多血管活性药物支持(P<0.028),并发生多器官衰竭,包括严重低氧血症(PaO2/FiO2<200)。
一项针对多器官衰竭的IABP-SHOCK试验,亚组研究显示在非IABP组机械通气发生率更高(66.7 vs. 33.8%),尽管未达到统计学差别。此外,一项针对ICU单独IABP或IABP+机械通气治疗的研究显示,后者血流动力学显著改善,所以机械辅助设备撤除率(P=0.04)和出院率(P=0.01)更高。
通气策略和监测
目前还没有关于心源性休克患者最佳通气策略的数据。包括961例非ARDS插管患者使用保护性通气的一项试验,3-6%有心力衰竭,结果显示使用低潮气量(4-6ml/kg)和中等潮气量(10ml/kg)治疗时,在死亡率、ICU治疗时间,或呼吸机并发症方面没有显著差别。
目前还没有“最佳PEEP”策略提出。如果可行的话,在应用PPV之前,必须对心源性休克的潜在原因进行谨慎评估。对于右心室功能障碍患者(前负荷依赖的血流动力学状况,如心包填塞、低血容量、血管收缩),为避免因静脉回心血量过度减少或右心室后负荷增加导致血流动力学状态进一步恶化,应严密监测PEEP。优先考虑最低且有效的PEEP水平(从3到5cmH2O开始),以维护足够氧饱和度和防止肺不张。相反,对于主要有左心室收缩功能障碍的患者,尤其与LAP持续升高相关时,PEEP水平设置可以从5-10cmH2O开始,并需要密切监测气体交换、血流动力学状态(CO和平均动脉压)和床边超声,监测肺复张,避免过度膨胀。(图2)
对正在进行或正在恢复的心源性休克患者,应用机械通气时呼吸功能监测包括对自主活动的评估和控制,特别是在镇静减弱/增强期间,以避免过度的ITP负性波动。
关键步骤是脱机期间正压解除。Lemaire等人的一项开创性研究推断了心肺交互作用重要的病理生理机制,该研究显示,脱机停止PPV,有心脏疾病的患者更易发生脱机失败,食道压和Swan-Ganz导管监测发现与LAP骤升和收缩、舒张功能改变相关。脱机时心血管和心肺交互作用发生重大变化,停用PPV会导致静脉回心血量突然增加,与儿茶酚胺激增相关的交感神经过度活跃,导致心率(HR) 升高和血压升高,氧供减少和呼吸功增加。基于这些原因,尤其是心肺病并存的患者应进行自主呼吸试验,并对脱机失败高风险患者进行适当治疗,包括前后负荷调整和呼吸频率监测。最近已有关于脱机病理生理学和应用方案的综述发表。
机械通气患者的机械循环支持效果研究
过去几十年,难治性心源性休克应用机械循环支持(MCS)越来越多。美国一项针对全国住院患者样本分析中,2004年至2011年间MCS使用率呈指数倍增加,心源性休克成为ELSO登记中静脉-动脉体外膜氧合(VA-ECMO)的第一个适应症。然而本组患者的最佳通气策略,大多数来源于原发性呼吸衰竭患者的经验。一般来说, 当VA-ECMO提供充分帮助时,肺对气体交换的作用就减小;因此,应减少潮气量和分钟通气量,并监测PEEP以减少发生肺不张的风险。此外人工肺的存在,可以维持低平台压和驱动压,降低与“医源性”ITP增加相关的右心室后负荷。
使用VA-ECMO时,左心室后负荷上升导致左心室过度扩张,LV-EDP/LAP增加,形成急性肺水肿的恶性循环。因此除了降低左心室负荷策略外,还应监测PEEP,使动脉血有充足的PO2以便于器官血液灌注。
必须考虑的是,静脉侧的引流和右心室输出量减少,可能会导致肺分流和死腔增加。对于肺泡通气保留,但在整个肺血管树血流量较低的患者,存在局部低碳酸血症的风险,继而肺泡液重吸收受损和潜在支气管收缩。
因此,考虑到血气分析可能不能代表肺功能,尤其是在应用全力支持的情况下,应密切监测VA-ECMO患者的气体交换情况。
结论
心源性休克患者经常需要机械通气治疗。病理生理机制和通气管理数据,源于PPV在非心源性休克患者的广泛应用。根据患者表型,进行最佳通气设置,是一个有前途且有必要填补的空白。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言