Nat Rev Neurosci重要综述:皮质中间神经元突触关键的机制—可塑体(plasticitome)
2023-02-11 brainnew神内神外 brainnew神内神外 发表于安徽省
大脑皮层回路是由发育关键的感觉经验形成的,发育关键期由抑制性控制。在发育小鼠听觉皮层中,人们研究了第4层(L4)PCs上BC突触的尖峰时间依赖性可塑性(STDP)。
长期突触可塑性被广泛理解为学习和记忆以及完善发育回路的基础。Donald Hebb认为大脑的学习是通过加强同时活跃的兴奋性神经元之间的联系来实现的,这些神经元通常被概括为“一起放电的细胞串联在一起(fire together, wire together)”。Hebb提出,为了在大脑中存储信息,编码感知的兴奋性神经元通过关联的长期突触可塑性结合在一起。
在这种观点下,尚不清楚抑制性中间神经元发挥了什么作用(如果有的话)。事实上,一些人认为抑制性中间神经元不是可塑性的。然而,许多最近的研究表明,与兴奋性神经元类似,抑制性中间神经元也经历了长期的可塑性。
近日,加拿蒙特利尔麦吉尔大学健康中心研究所P. Jesper Sjöström实验室在Nature Reviews Neuroscience上发表综述,讨论了在几种类型的皮质抑制中间神经元的输入和输出中发现的多种形式的长期可塑性,包括其内在兴奋性可塑性和稳态可塑性。
在整个过程中,研究人员定义了关键术语:可塑体(plasticitome),它是突触可塑性,相当于连接体或基因组。强调了关键的中间神经元可塑性机制,并指出了对健康大脑功能和神经病理学的影响。
 重温经典Science:骆利群院士教科书级别的综述——神经环路的架构
重温经典Science:骆利群院士教科书级别的综述——神经环路的架构
1、中间神经元(INs)可塑性的来龙去脉
1.1 发育中的IN可塑性
大脑皮层回路是由发育关键的感觉经验形成的,发育关键期由抑制性控制。在发育小鼠听觉皮层中,人们研究了第4层(L4)PCs上BC突触的尖峰时间依赖性可塑性(STDP)。发现I→E去抑制可能会开启可塑性来重塑未成熟的环路。然而,关键时期的感官体验切换了因果I→E STDP从LTD到LTP,因此,无论尖峰顺序如何,成人大脑中成熟的可塑性学习规则都会引发LTP[Fig.1]。因此,感官体验可以重塑可塑性学习规则。
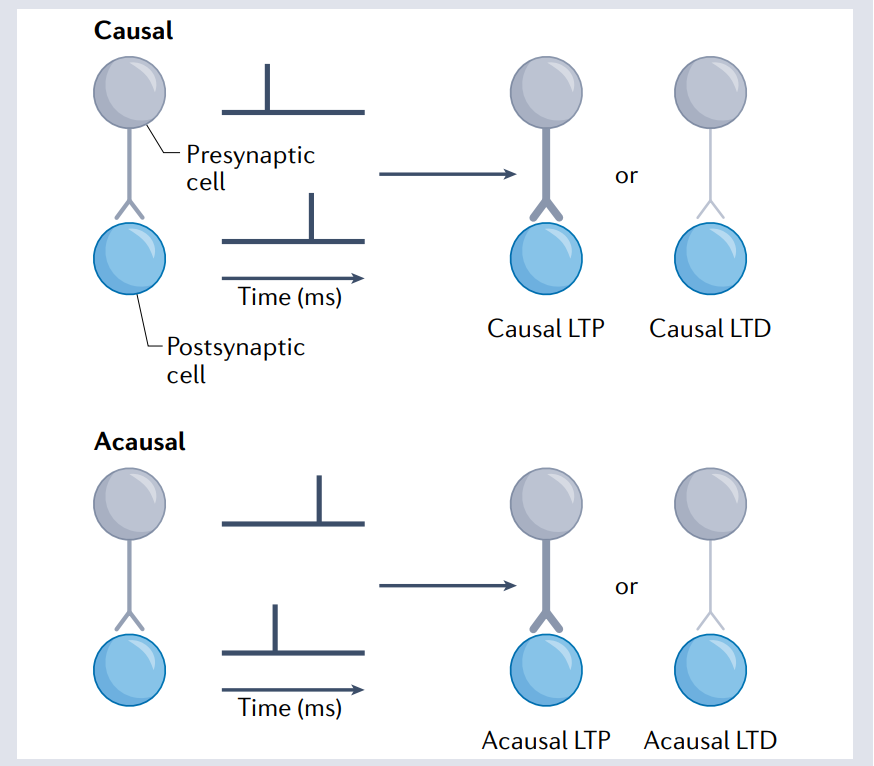
Figure 1 因果活性与非因果活性
在发育中的小鼠听觉皮层的L5 PC的IN输出处STDP诱导后,在L5 PC上的兴奋和抑制输入处还观察到异突触可塑性(heterosynaptic plasticity)[Fig.2]。有趣的是,这种异突触可塑性仅在幼年皮层中发现,这表明它可能对发育回路可塑性很重要。
Figure 2通过结合同突触和异突触可塑性来规范突触权重
IN可塑性具有两个看似冲突的作用,因为它促进了稳定性以及门控关键期可塑性。这些研究还说明了IN输入和输出的可塑性学习规则的多样性,皮质层和突触类型之间存在显著差异。
1.2 E/I平衡和可塑性
保持大脑的E/I平衡对于电路的稳定性和正常运行至关重要,但这种平衡如何实现?在I→ E突触遵循时间对称I→E STDP模型中会引起负反馈,以动态平衡神经环路中的E/I。在这个模型中,I→E突触由于同步的突触前和突触后尖峰而增强,因此当细胞的活动因兴奋性输入的增强而增加时,抑制作用也会增强。
IN可塑性通常有助于维持E/I平衡和正常的大脑功能。因此,IN可塑性也会导致环路重新布线,从而产生较差的性能导致大脑的病理状态。
1.3 单、双、三因素可塑性
单因素可塑性:某些形式的突触可塑性仅由突触前或突触后活动决定,因此被称为单因素可塑性学习规则。单因素法则的一个经典例子是海马CA3锥体细胞(PC)苔藓纤维输入的长期增强(LTP),这主要取决于突触前活动。
双因素可塑性:Hebbian可塑性是一种局部可塑性学习规则,由突触前和突触后神经元的活动决定。因此,神经科学理论家喜欢将Hebbian学习称为双因素学习规则,因为可塑性由两个参数决定。双因素可塑性的另一个例子是依赖于突触前和突触后尖峰的精确时间顺序,即尖峰时间依赖可塑性(STDP)。
三因素可塑性:控制学习的内容和时间,应该需要第三个因素来控制Hebbian学习的开启和关闭,或者调节信息存储。这种形式的可塑性被称为neo-Hebbian三因素可塑性学习规则,其中第三因素可以是更全局的效应器,如神经调节、网络状态或来自更高大脑区域的反馈,以使注意力能够引导学习,例如在深度网络中。此外,还可能涉及三个以上的因素。
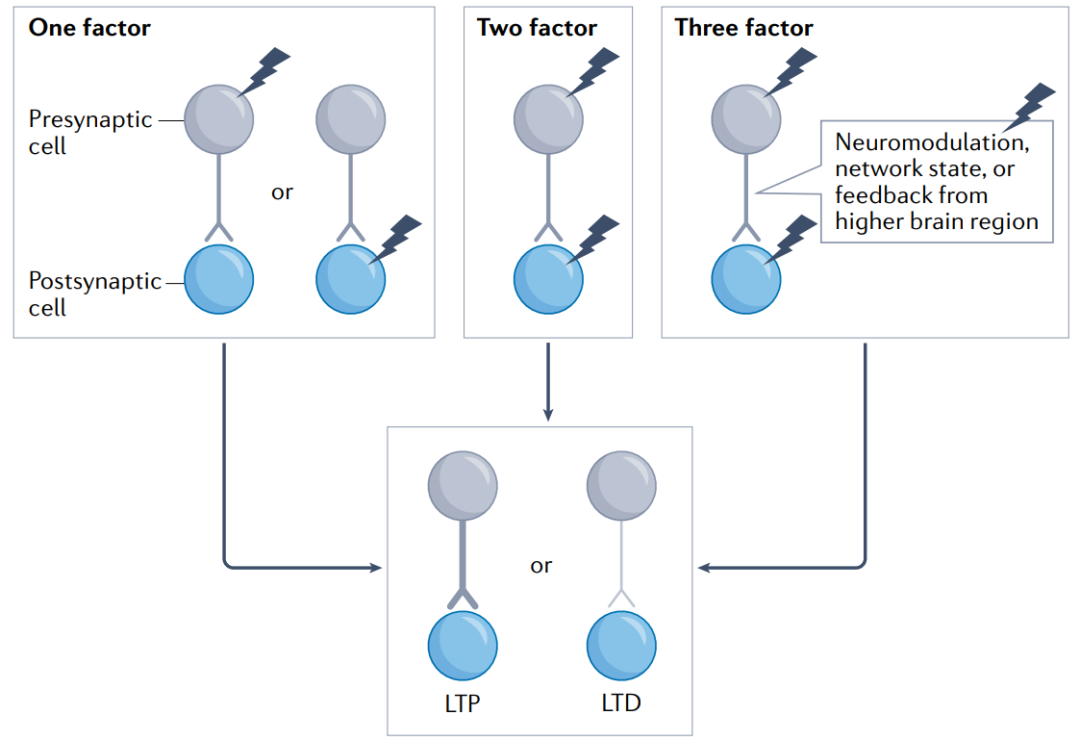
Figure 3 单、双、三因素可塑性
1.4 信息流的重新布局
IN可塑性可以重塑PC细胞体-树突的整合。例如,SST+ INs抑制皮层PC树突,而PV+ BCs抑制皮质PCs的胞体周围。因此,IN可塑性不仅改变了E/I平衡和PC尖峰输出,而且使来自CA3和内嗅皮层对PCs投射输入源的切换成为可能。
IN可塑性也可以改变皮层的信息流。一项单因素研究PV+ IN输入到L5 PCs的I→E LTP发现L5 PCs的抑制增强有效地阻止了从L2/3到L5的信息传递。由于不同层的兴奋性突触输入携带不同的信息,这些研究突出了INs可塑性如何通过影响皮层信息流来影响认知功能。
1.5 去抑制和可塑性
许多IN类型本身受到抑制。因此,增加对抑制性细胞的抑制(称为去抑制)可以通过I→I→E连接来增强网络兴奋性。然而,与E→E兴奋的一个重要区别是I→I→E去抑制需要中间INs是活性的,否则初始去抑制细胞不能影响受体兴奋细胞。因此,去抑制的可塑性有望在调节大脑活动中发挥重要作用,并对癫痫等病理学产生影响。与此同时,在健康的大脑中也会出现去抑制。听觉皮层的联想恐惧学习也依赖于持久的去抑制。
总之,很少有研究直接探讨了长期去抑制可塑性,因此需要更多的研究来阐明长期去抑制可塑性如何有助于学习。尽管如此,从这些研究中得出的一个原则是,去抑制通常与清醒和注意力以及可塑性和学习有关。
1.6 IN可塑性机制
影响因素包括GABA受体,NMDA受体,钙渗透性AMPA受体,mGlu受体(mGluRs),胆碱能受体和内分泌大麻素信号。
2、INs与稳态可塑性
神经活动需要通过大脑的神经元网络传播,而不会消亡或不受控制地增长,这需要精细调整的E/I平衡。神经元活动也应保持在合理的范围内,即在神经元可以动态响应其输入的目标激发区内。因此,神经元和环路需要一个稳定的原理,这就是所谓的稳态可塑性。这种形式的可塑性在12–48的时间尺度上提供负反馈,从而类似于神经元活动的恒温器。
有许多机制协同工作以稳定神经元回路,如短期可塑性、异突触E→E LTD和固有可塑性,但突触缩放(synaptic scaling)是哺乳动物中描述的第一种稳态可塑性。另外,兴奋性突触和抑制性突触以不同方式促进稳态等。
总之,完整大脑中的稳态可塑性比体外稳态可塑性更复杂。尽管INs显然在体内发挥作用,但其作用不仅限于维持体内稳态,还包括其他功能,如重新组织神经环路。
3、INs的内在可塑性
越来越多的证据表明,除了突触可塑性,神经回路中的信息存储还涉及神经元内在兴奋性的调节。内在兴奋性的可塑性[Fig.4]——也称为内在可塑性——通常涉及神经元或突触活动对神经元内在电特性的持续改变。
除了改变突触,可塑性还可以改变细胞内在的生物物理特性。与突触可塑性一样,结果可能是双向的,因为细胞的兴奋性可能上调或下调。事实上,第一项长时程增强研究还报道了除了突触强化外的突触后兴奋性增强,这一概念被称为兴奋性突触后电位(EPSP)-尖峰增强。
事实上,内在可塑性通常可以与突触可塑性同时引发,但内在可塑性也可以在其缺失时触发。此外,内在可塑性可以与Hebbian可塑性一起工作,并提供正反馈以促进细胞学习,但它也可以通过负反馈支持稳态。此外,内在可塑性可以以细胞范围的方式工作,或者可以在空间上局限于树突室的子集。由于内在可塑性影响所有输入(或至少一大组输入),因此会导致输入特异性和信息存储密度的损失。
从机制上讲,内在可塑性通常通过离子通道密度的变化来实现,但增加的活动可以使放电起始区远离胞体,从而使得在某些情况下下调神经元的兴奋性。
总之,内在可塑性规则有相当大的多样性,但在中间神经元中对内在可塑性的研究相对较少。
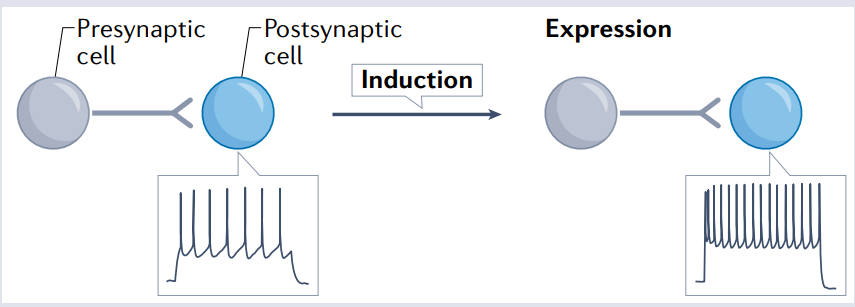
Figure 4 内在兴奋性的可塑性
4、内在可塑性的机制
小鼠桶状皮层L2/3 PV+IN在轴突起始段表达延迟整流器Kv1.1电压门控K+通道,该位置使Kv1.1能够通过调节动作电位阈值强烈影响PV+IN的兴奋性。同时,Er81可以通过控制Kv1.1表达来调节PV+IN的内在兴奋性。Schaffer侧支强直电刺激上调PV+IN内在兴奋性。
与Er81类似,NRG1–ErbB4通路通过Kv1.1通道调节调节动作电位阈值,直接调节PV+ IN的兴奋性。除了Kv1.1延迟整流K+通道外,A型K+通道也通过尖峰阈值调节影响PV+ IN的内在可塑性。
然而,目前尚不清楚在不同的抑制性INs亚型中,树突兴奋性的局部活动依赖性变化在多大程度上发生。然而,内在可塑性永远不能赋予突触可塑性相同程度的输入特异性。这意味着由于内在可塑性而产生的信息存储容量必须大大小于突触可塑性。
然而,IN内在可塑性对学习和记忆的贡献是不可忽略的,因为非突触和突触修饰可能都有助于学习记忆。需要更多的研究来阐明突触和内在形式的可塑性如何相互作用以实现学习,同时保持皮层回路的平衡活动。
结 论
在这篇综述中,一个中心观察结果是,INs可塑性学习规则存在着巨大的多样性,在大脑功能的关键方面发挥着不同的作用。
可塑性特定于细胞和突触类型,导致大量可塑性学习规则[Fig.5]。因此,仅E→ E可塑性映射是不够的,因为它不是孤立的,而是与E→ I,I→ E和I → I可塑性相关。因此,提出了一个相对完整的突触类型、细胞类型和大脑区域可塑性学习规则的数据库,即可塑体。
IN功能障碍也与其他复杂的疾病有关,如自闭症和精神分裂症。总之,迫切需要了解INs可塑性的多样性,以为治疗主要神经病理学的新疗法铺平道路。
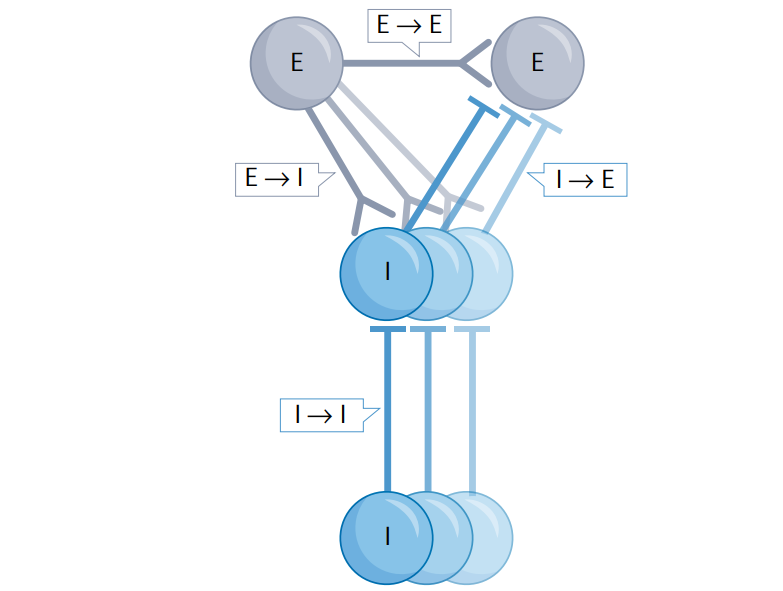 Figure 5 可塑体的概念
Figure 5 可塑体的概念
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言