MET扩增致EGFR-TKI耐药困局:规范检测与「双靶」疗法并行攻坚
2023-10-12 e路新干线 e路新干线 发表于上海
本文主要从EGFR-TKI耐药机制出发,根据相关专家共识和最新进展梳理了EGFR-TKI耐药后MET扩增的检测和治疗策略,以期为该类NSCLC患者的诊疗提供参考。
前言
自2003年表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)吉非替尼获批以来,非小细胞肺癌(NSCLC)靶向治疗在近20年有了长足的发展,但是,靶向治疗后的耐药是难以避免的临床和科学问题。对于经靶向治疗耐药后疾病进展的患者,规范的分子检测和个体化治疗方案有望改善该类患者的生存。
本文主要从EGFR-TKI耐药机制出发,根据相关专家共识和最新进展梳理了EGFR-TKI耐药后MET扩增的检测和治疗策略,以期为该类NSCLC患者的诊疗提供参考。
EGFR-TKI疗效优异MET扩增引发耐药成难题
EGFR-TKI已经成为EGFR突变NSCLC患者的标准治疗选择,伴随着EGFR-TKI的研发迭代,与一/二代EGFR-TKI相比,以奥希替尼为代表的三代EGFR-TKI凸显出更优的疗效和安全性。基于FLAURA 研究,奥希替尼目前已是EGFR突变晚期NSCLC患者的首选一线治疗药物。然而,使用EGFR-TKI治疗后不可避免地会发生耐药,使得EGFR突变晚期患者的长期生存受限,如何克服耐药已成为一个关键问题。
EGFR-TKI耐药机制主要包括EGFR依赖性耐药(on-target)和非EGFR依赖性耐药(off-target)1:
EGFR依赖性耐药主要是指经EGFR-TKI治疗后发生EGFR基因其他位点的二次突变,例如EGFR基因第20号外显子发生错义突变(即T790M突变)是一/二代EGFR-TKI耐药突变中最主要的类型。据统计,接受吉非替尼(一代)、厄洛替尼(一代)或阿法替尼(二代)治疗的患者中50-60%会发生T790M突变。
非EGFR依赖性耐药是指EGFR通路之外的致癌途径异常激活,可分为旁路激活途径、下游信号通路激活、组织学或表型转化。
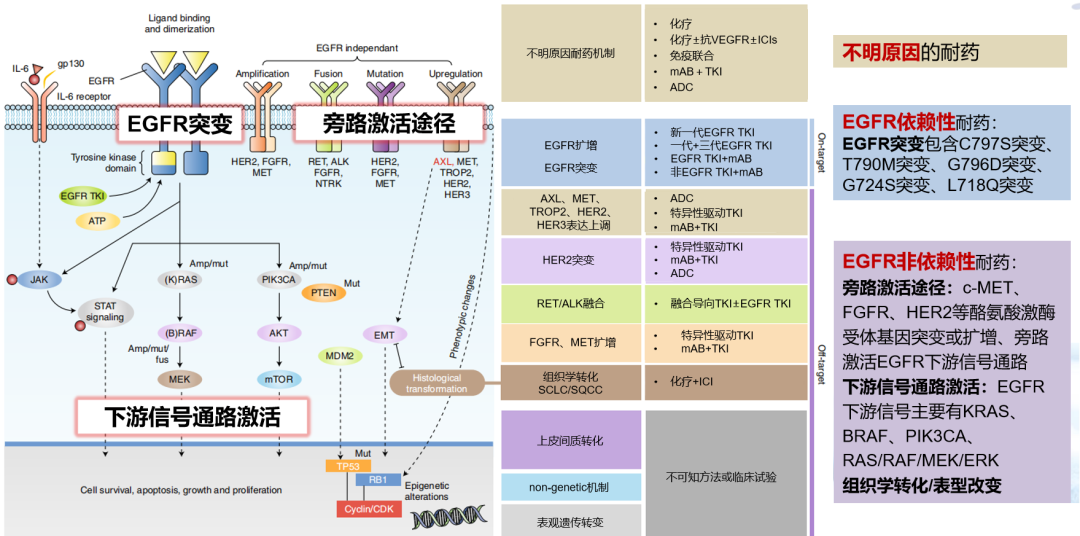
EGFR-TKI耐药机制
MET扩增是EGFR-TKI治疗耐药后旁路激活途径中常见的耐药机制。MET通路与表皮生长因子超家族成员间存在广泛的相互作用,MET扩增通过持续激活EGFR下游的信号通路(如PI3K-AKT-mTOR通路、RAS-RAF-MEK-ERK通路),进而促进肿瘤细胞的增殖,抑制其凋亡,这些独立于EGFR的激活和信号传导,属于旁路激活。除EGFR-TKI外,MET扩增也是ALK-TKI耐药机制之一。
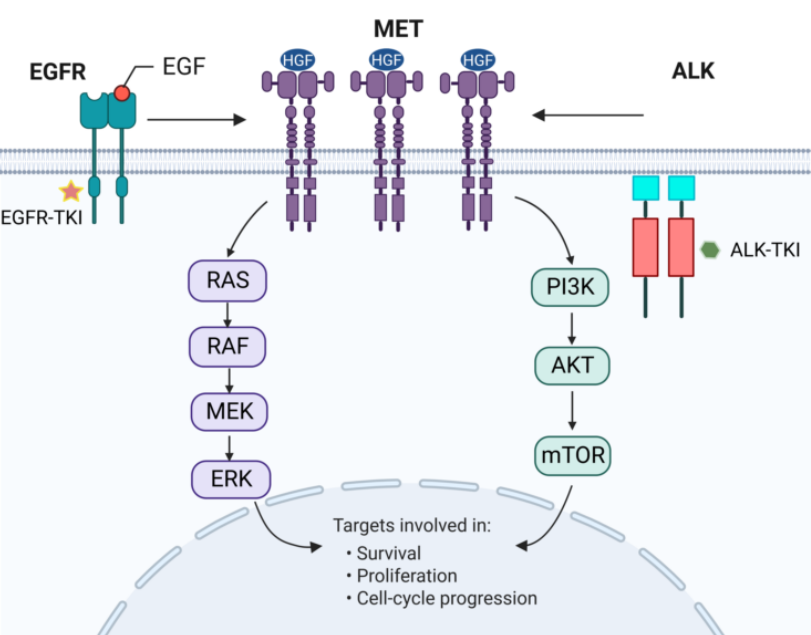
MET扩增介导的耐药机制
MET基因扩增是指MET基因拷贝数(gene copy number,GCN)增加,包括多倍体(polysomy)和局部扩增(amplification)两种形式。多倍体是指整条染色体的拷贝数增加;局部扩增是指MET基因(或合并周围区域)的拷贝数增加,而位于染色体其他区域的基因的拷贝数没有明显变化。两种形式都可能导致MET mRNA水平上调,进一步增加MET蛋白表达,从而增加激活状态的MET通路信号。
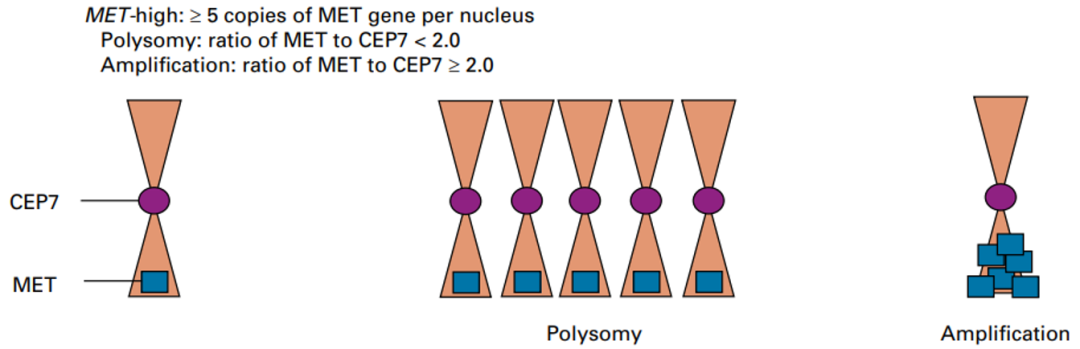
MET多倍体和局部扩增
据文献报道,MET扩增在一/二代EGFR-TKI耐药后的发生率为5%-22%2,在三代EGFR-TKI奥希替尼一线耐药后的发生率为7%-15%,二线耐药后的发生率更是高达5%-50%3,4。2023 ASCO一项研究报道了亚洲患者奥希替尼一线耐药后MET扩增的发生率为43.6%5。
立足前沿规范检测助力实现精准诊疗
MET扩增作为EGFR-TKI常见的耐药机制,是靶向治疗的可能标志物,多项指南和共识已将MET扩增列入常规检测推荐。

MET扩增检测指南共识推荐
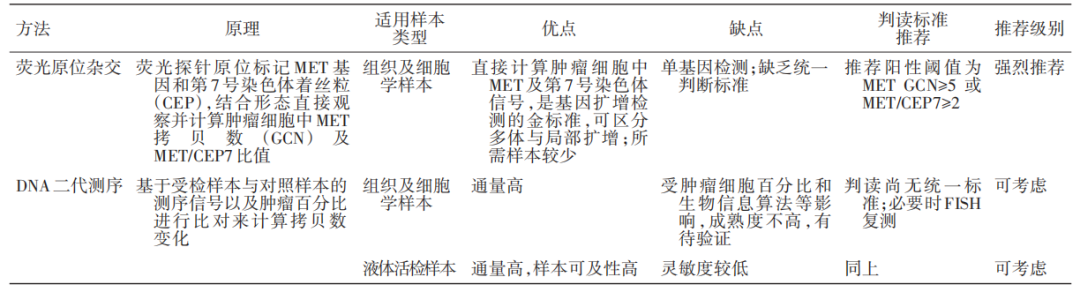
目前针对MET扩增的检测方法主要包括荧光原位杂交(FISH)和DNA二代测序(DNA NGS)。
FISH采用组织及细胞学样本,通过计算肿瘤细胞中MET GCN或者通过标记MET基因和第7号染色体着丝粒(CEP7),计算MET/CEP7比值来判断扩增情况,其优点在于可区分多倍体与局部扩增,所需样本较少,缺点是缺乏统一的判读标准。《非小细胞肺癌MET临床检测中国专家共识》推荐MET GCN≥5或MET/CEP7≥2作为判读参考阈值5。
DNA NGS作为一种高通量测序分析方法已成为中国肿瘤医生常用的检测手段,该方法基于测序深度和特定位点变异频率等信息对检测MET GCN变异进行计算,可采用组织及细胞学样本或者液体活检样本,其优点在于通量高,液体活检样本的可及性高,但受肿瘤细胞百分比和生物信息算法等影响,成熟度不高,结果有待验证,并且同样缺乏统一的判读标准。
《非小细胞肺癌MET临床检测中国专家共识》6和《MET异常NSCLC的诊断和治疗亚洲胸部肿瘤研究小组(ATORG)专家共识》7共同指出,FISH是检测MET扩增的金标准,NGS检测MET扩增尚需进一步优化和验证。若应用NGS,首选肿瘤组织样本或细胞学样本,在无法进行组织活检时可采用液体活检。
MET扩增常见检测方法
然而在晚期二线以后的患者中仅10%-30%的患者能再次组织活检,二线之后血液样本的检测是常用手段,那么与FISH金标准相比,液体活检结果的可靠性如何?该问题在国际肺癌前沿研究中进行了探索。
2023 ASCO公布了一项大型综合分析5奥希替尼一线治疗后使用组织活检(TBx)FISH和/或液体活检(LBx)NGS检测的MET扩增结果。TBx FISH扩增(FISH+)标准定义为:MET GCN≥5或MET/CEP7≥2;LBx NGS扩增(LBx NGS+)标准定义为:MET GCN≥2.3。TBx FISH和LBx NGS组中可进行评估的患者分别有314例和436例。
TBx FISH组:159/314例(50.6%)患者检测为FISH+ ,中位GCN为11.8,中位MET/CEP7为2.3。
LBx NGS组:51/436例(11.7%)患者检测为LBx NGS+。
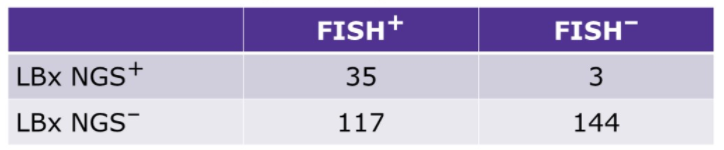
299例患者同时进行了TBx FISH和LBx NGS检测,其中152例(50.8%)为FISH+,38例(12.7%)为LBx NGS+。3/38例(7.9%)为LBx NGS+但FISH-,117/152例(77.0%)为FISH+但LBx NGS-。
FISH和LBx NGS结果的一致性(n=299)
该研究结果表明,相比于FISH,LBx NGS检出率低,具有高特异性低灵敏度,因此阴性NGS MET扩增结果必要时考虑FISH复测。FISH可最佳识别奥希替尼一线治疗后的MET扩增,可能使更多患者从口服MET抑制剂中获益。
注:特异性:指没有患病的人中试验阴性者所占比例,对应假阳性率;灵敏度:指患者中试验阳性者所占比例,对应假阴性率。
除了液体活检NGS之外,组织样本也可以进行NGS检测,那与FISH金标准相比,组织学NGS结果如何?
2023 WCLC报道了一项四川大学华西医院梁宗安教授团队的研究8,该研究评估了组织样本NGS和FISH检测的一致性以及循环肿瘤DNA(ctDNA)NGS的灵敏度。研究纳入了EGFR-TKI耐药患者,进行了组织样本NGS和FISH检测MET扩增,患者的血浆样本用于进行ctDNA NGS检测MET扩增。
研究共纳入67例EGFR-TKI耐药患者进行组织活检,其中有21例(31.3%)患者经FISH检测为MET扩增,其中7例为多倍体,14例为局部扩增。组织样本NGS与FISH检测的一致性为83.6%(56/67),灵敏度和特异性分别为85.7%和91.3%,其中检测局部扩增的灵敏度和特异性分别为78.6%和100.0%,多倍体的灵敏度和特异性分别为42.9%和91.3%;而ctDNA NGS的灵敏度和特异性分别为14.3%和100%。
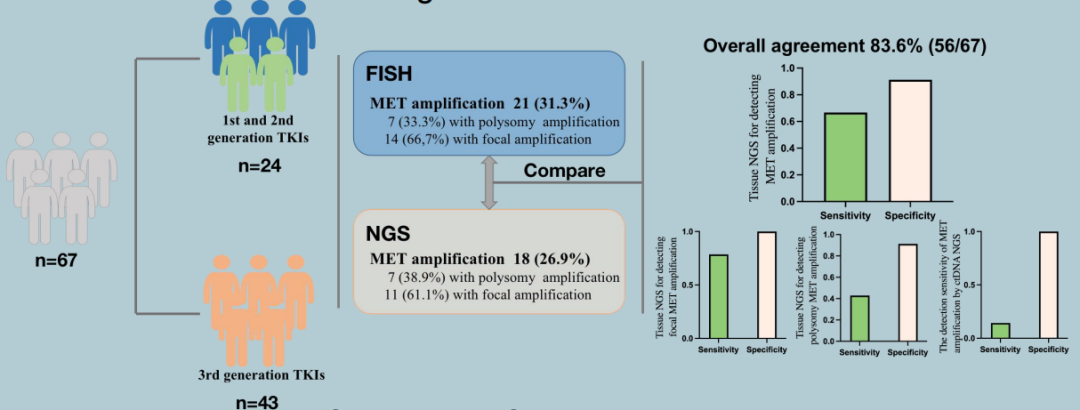
研究设计和结果
该研究结果表明,组织样本NGS与MET扩增检测的金标准FISH之间具有良好的一致性以及较高的灵敏度和特异性,且对于MET局部扩增的检测效果更佳。ctDNA NGS在MET扩增检测方面的灵敏度仍需要进一步优化和提高。
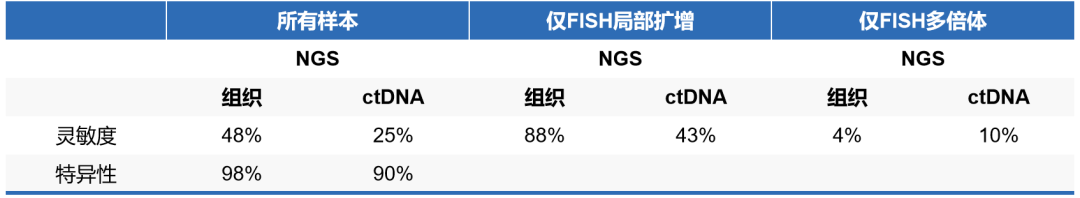
无独有偶,2019 AACR报道的一项研究9也得到了类似的结果。与ctDNA NGS相比,组织样本NGS的灵敏度和特异性更高,但是存在漏检多倍体的可能性,尚需要进一步方法学优化。
FISH与组织或ctDNA NGS的MET扩增检测比较
另有TATTON研究10对MET蛋白过表达(采用IHC方法检测)与MET扩增的相关性进行了探索,结果显示EGFR-TKI耐药后发生MET蛋白过表达(≥50%肿瘤细胞3+)的患者中有80%同时检测到MET扩增(MET GCN≥5或MET/CEP7≥2),可见IHC检测的MET蛋白过表达在NSCLC MET抑制剂的临床治疗中具有潜在的指导价值,但是否可以作为MET扩增生物标志物因目前证据较少,与MET扩增的相关性需要更多研究来进一步探索。
破局耐药「双靶」联合方案疗效优异
既往EGFR-TKI耐药后MET扩增的NSCLC患者治疗以化疗为主,但获益有限。随着小分子抑制剂在MET异常NSCLC患者中展示出良好活性,在EGFR-TKI基础上联合针对MET扩增的靶向药物进行双靶治疗或可发挥协同抗肿瘤作用,相关研究总结如下表。
针对EGFR-TKI耐药后MET扩增的临床研究

《第三代EGFR-TKI耐药后诊疗策略专家共识》11指出,对于经第三代EGFR-TKI治疗耐药后出现广泛进展的患者,针对不同的耐药机制,推荐给予相应的联合治疗如双靶联合治疗等手段;《MET异常NSCLC的诊断和治疗ATORG专家共识》7指出,MET扩增与EGFR突变NSCLC患者对EGFR-TKI的耐药性相关,因此,需要同时抑制EGFR和MET来克服对EGFR-TKI的耐药性。
谷美替尼是一款口服强效、高选择性小分子MET抑制剂,2023年3月8日,国家药品监督管理局正式批准其用于MET 14号外显子跳跃突变(METex14跳变)的局部晚期或转移性NSCLC患者,成为国内首个获批全线治疗METex14跳变晚期NSCLC患者的药物。除了在METex14跳变领域具有良好的表现外,该药物联合奥希替尼治疗EGFR-TKI耐药后MET扩增NSCLC患者也产生了有希望的疗效。
一项Ⅰb/Ⅱ期研究12评估了谷美替尼(研发代号:SCC244)联合奥希替尼治疗既往接受EGFR-TKI单药治疗且MET扩增的局部晚期或转移性NSCLC患者的疗效和安全性。
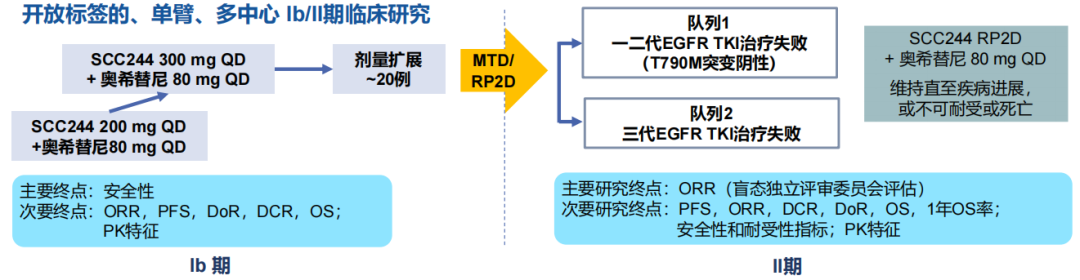
研究设计
研究结果显示谷美替尼联合奥希替尼针对一/二代EGFR-TKI治疗失败、无T790M突变且未接受过三代EGFR-TKI的患者,疗效尤为显著,19例患者中14例达到PR,ORR为73.7%(14/19),中位PFS为7.0个月,中位DoR为6.2个月。接受三代EGFR-TKI治疗后进展患者中,ORR为36.4%。安全性方面,最常见的TRAE为水肿(63.3%),最常见的≥3级TRAE为血小板减少(16.7%)和中性粒细胞减少(16.7%)。
研究结果显示,谷美替尼联合奥希替尼在EGFR-TKI耐药后MET扩增NSCLC患者中显示出临床活性,安全性是可耐受的和可控的。
总结
EGFR-TKI治疗后耐药是阻碍EGFR突变晚期NSCLC患者长期生存的原因,而MET扩增是非EGFR依赖性耐药机制中常见的旁路激活途径,目前指南推荐检测MET扩增的金标准是FISH,NGS法尚需进一步优化和验证,若应用NGS,首选肿瘤组织样本或细胞学样本。
针对EGFR-TKI耐药后MET扩增的NSCLC患者,指南推荐的治疗方案为EGFR-TKI基础上联合针对MET扩增的靶向药物进行双靶治疗。谷美替尼是一款口服强效、高选择性小分子MET抑制剂,其联合奥希替尼治疗MET扩增介导耐药患者产生了有希望的疗效,为该类患者提供了新的治疗选择,同时也期待后续更多相关循证医学证据的产出。
参考文献
1.Passaro Antonio, et al. Nat Cancer. 2021, 2(4):377-391.
2.Matikas Alexios, et al. Clin Lung Cancer, 2015, 16(4): 252-261.
3.Leonetti Alessandro, et al. Br J Cancer, 2019, 121(9): 725-737.
4.Qiming Wang, et al. J Hematol Oncol. 2019, 12(1):63.
5.Helena Alexandra Yu, et al. 2023 ASCO Poster #9074.
6.非小细胞肺癌MET临床检测中国专家共识(2022年版).
7.MET异常NSCLC的诊断和治疗亚洲胸部肿瘤研究小组(ATORG)专家共识(2022年版).
8.Zongan Liang, et al. 2023 WCLC Poster #1.22-11.
9.Hartmaier Ryan, et al. 2019 AACR Abstract #4897.
10.Hartmaier Ryan, et al. Cancer Discov. 2023, 13(1):98-113.
11.第三代EGFR-TKI耐药后诊疗策略专家共识(2023年版).
12.Yongfeng Yu, et al. 2022 ESMO-Asia. Abstract #607.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言