【AJH】优化CAR-T治疗安全性:B细胞淋巴瘤CAR-T治疗中病毒感染预防和治疗
2024-01-15 聊聊血液 聊聊血液 发表于陕西省
该文汇总了CAR-T治疗B细胞非霍奇金淋巴瘤(B-NHL)患者中病毒感染的当前文献,并提出预防病毒感染的预防措施及策略。
CAR-T治疗中的病毒感染
CAR-T细胞疗法是一种极具前景的新型治疗方式,对于复发性/难治性(R/R)大B细胞淋巴瘤患者具有较高及持续的缓解率,然而目前对病毒感染导致的特异性毒性的理解仍然有限,现有的建议通常来自其他血液学治疗手段。CD19 CAR-T细胞免疫治疗对患者免疫功能有多方面影响,但仍缺乏对其病毒感染相关并发症的全面研究,而这对于深入了解病毒感染对细胞因子释放综合征(CRS)的影响及总体预后和原发性疾病的结局至关重要。
识别并有效治疗病毒感染,包括CAR-T细胞治疗前和治疗后可能出现的病毒感染风险,对于成功的CAR-T治疗和降低死亡率至关重要。基于此,华中科技大学同济医学院附属同济医院隗佳教授团队于血液学国际知名期刊《American Journal of Hematology》发表综述,汇总了CAR-T治疗B细胞非霍奇金淋巴瘤(B-NHL)患者中病毒感染的当前文献,并提出预防病毒感染的预防措施及策略。

CAR-T细胞治疗相关病毒感染的高危因素和机制
接受CAR-T免疫治疗的B细胞恶性肿瘤患者中大多数存在免疫功能受损,其源于整个CAR-T过程不同阶段的多种因素,包括基础血液恶性肿瘤、既往治疗干预、预处理化疗、CRS、免疫效应细胞相关神经毒性综合征(ICANS)、持续性B细胞再生障碍、低丙球蛋白血症以及NK细胞和T细胞耗竭(见图1)。随着对病毒感染的易感性相应增加,这些感染中有相当一部分可以通过预防措施或适当的治疗干预得到有效纠正。
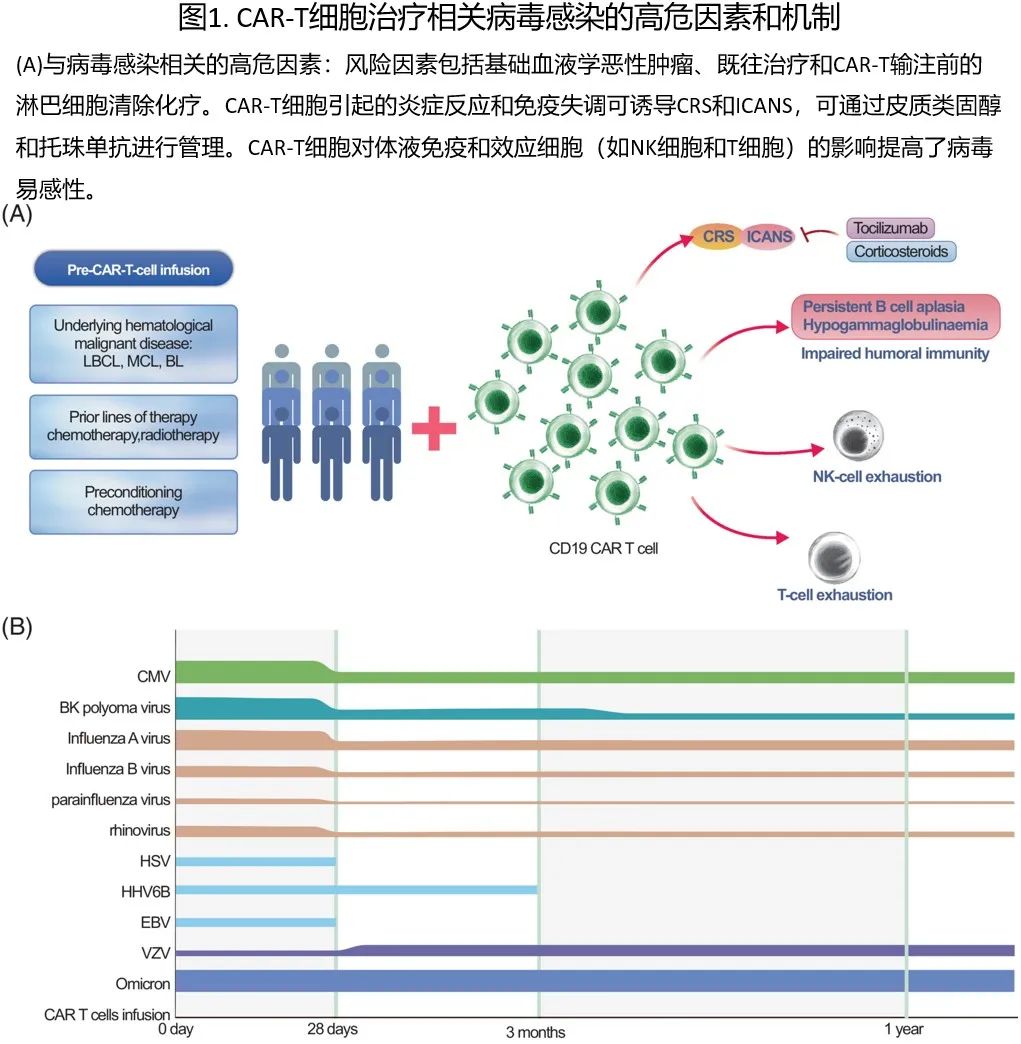
CAR-T细胞输注(CAR-T-cell infusion,CTI)前
在CTI前,感染风险增加与基础血液恶性肿瘤相互交织。多线治疗也是导致恶性肿瘤感染易感性的公认风险因素。此外,CTI前的预处理化疗通常包括氟达拉滨和环磷酰胺,可损害粘膜完整性并可能导致早期感染。
早期(CTI后<30天)
CTI后,患者会进入相对较长的病毒感染易感期,包括早期、中期和晚期。在CAR-T回输后的早期阶段,CAR-T细胞治疗所特有的两种主要并发症(CRS和ICANS)会加重免疫抑制并增加感染风险。尽管糖皮质激素和托珠单抗可用于治疗重度CRS,但也可能增加感染风险。虽然糖皮质激素可控制ICANS,但高级别ICANS时给予大剂量糖皮质激素可进一步恶化感染风险。既往研究认为CRS是感染的独立风险因素,尤其是在较高级别CRS (≥3级) 时。用于治疗CRS或ICANS的糖皮质激素可独立升高感染风险并延长住院时间。
中期(CTI后31-90天)
在CAR-T回输后的中期阶段,细胞和体液免疫受损以及长期血细胞减少是感染相关并发症的突出风险因素。感染(包括病毒性呼吸道感染)表明存在免疫缺陷。值得注意的是,CAR-T细胞治疗试验中相当大比例的患者在此阶段出现长期血细胞减少,长期白细胞减少增加感染的易感性,包括重度感染,如人类疱疹病毒6型 (HHV-6) 脑炎。
晚期(CTI后> 90天)
即使在CAR-T细胞治疗后3个月之后,病毒感染的晚期事件仍可持续存在,其中部分事件可导致不良结局。持续性B细胞再生障碍和低丙球蛋白血症(IgG< 400mg/dL)是导致这些感染的关键风险因素,反映出早期治疗期间由于体液免疫受损而观察到的感染风险。此阶段需要重点关注的是病毒再激活,尤其是在停止抗病毒预防后。
病毒感染可激活先天性和获得性免疫系统(见图2)。在先天性免疫应答中,病毒刺激模式识别受体(PRR),促使促炎细胞因子如IL-6、IL-1β、TNF、IL-12、IFN-β和IFN-γ释放。尽管这些细胞因子有助于感染清除,但其失调可能诱发或加重CRS。此外IL-6和超炎症状态可能与病毒过度活化后的NK细胞耗竭有关。
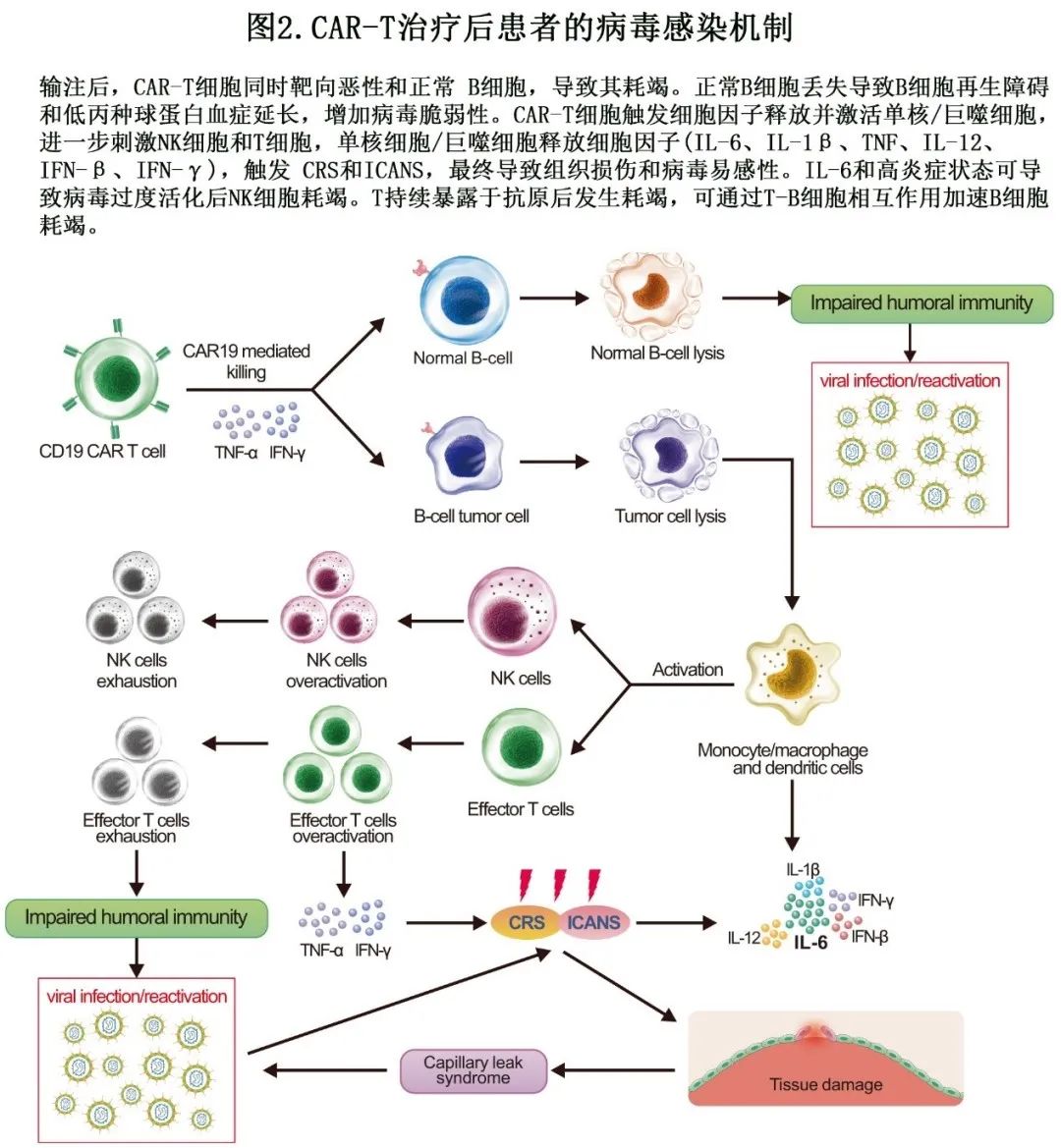
在获得性免疫应答中,靶向CD19的CAR-T细胞可消除正常的CD19+幼稚细胞和记忆B细胞,导致体液免疫缺陷。B细胞耗竭影响CD4+ T细胞活化,损害记忆CD4+和CD8+T细胞应答,而CD8+T细胞直接靶向感染细胞,在细胞免疫中发挥关键作用。CAR-T细胞治疗可阻碍病毒特异性CD8+T细胞的激活,具有重大影响。CAR-T治疗期间,T细胞效应功能和自我更新能力的逐渐丧失会增加患者对病毒感染的易感性。在CTI后晚期,先天和获得性免疫系统的功能减弱可使病毒易感性逐步升级。
CAR-T免疫治疗中的特异性病毒感染
现有数据表明,感染性并发症在接受CAR-T治疗的患者中普遍存在,而早期区分各种病原体对于优化管理和提高临床结局至关重要。为了帮助区分CAR-T治疗期间常见的病毒,作者概述了其属性和感染率,并根据CAR-T输注期间的时间进行分类(表1)。

呼吸道病毒
呼吸道病毒(包括鼻病毒、流感病毒、副流感病毒、呼吸道合胞病毒、人类偏肺炎病毒和冠状病毒)是大多数病毒感染的病原体。常见表现包括疲乏、食欲减退、发热、鼻充血、流鼻涕、咳嗽、喘息和呼吸短促,部分患者可能发生感染性肺炎。
COVID-19在大流行后时代仍持续给CAR-T患者带来相当大的挑战。年龄、体能状态、代谢合并症和COVID-19诊断时未达到完全缓解等因素可导致风险增加。对于CD19 CAR-T治疗,持续性B细胞再生障碍、淋巴细胞减少和低丙球蛋白血症比较常见,可能导致病毒清除延迟。长期病毒流行可能导致出现新的变异株,破坏免疫防御并触发新的爆发。
其他非血源性病毒
巨细胞病毒
巨细胞病毒(CMV)感染可表现为无症状的病毒血症、DNA血症或抗原血症。在免疫受损的个体(如CAR-T患者)中,CMV再激活可导致危及生命的多器官CMV疾病,如肺炎、胃肠炎或视网膜炎。历史上CMV检出率相对较低。CMV 感染的一个标志为持续存在大量 CMV 特异性记忆CD8+ T细胞群,这种记忆细胞膨胀(inflation)可能与免疫受损有关,尤其是在老年人中。随着 CAR-T 患者中 CMV 感染率的增加,了解 CMV 病理学与 CAR-T 细胞之间的关联机制对于未来的研究至关重要。
人疱疹病毒6型
尽管许多人类疱疹病毒6型 (HHV-6) 感染无症状,呈初发感染、再激活或外部来源再感染,但该病毒可影响神经系统并引发严重疾病,尤其是免疫系统受损患者中。实际的 HHV-6 感染率可能被低估。临床实践表明,通过腰椎穿刺对疑似患者的脑脊液进行 PCR 检测或血液 mNGS 可提高 HHV-6 的检出率(见表1)。当血浆 HHV-6 PCR 结果与脑脊液HHV-6 PCR 结果不同时,临床医生必须对 HHV-6 感染保持警惕,并将其与 ICANS 区分。
EBV
虽然 EBV 再激活是干细胞移植患者PTLD (移植后淋巴增生性疾病) 的主要原因,但在接受 CAR-T 免疫治疗的患者中因 EBV 再激活引起临床症状的资料有限。无症状 EBV 感染在所有患者类型中都很常见,只有一小部分免疫功能低下的个体表现出不明原因发热或典型传染性单核细胞增多综合征等临床症状。需要注意的是,EBV在 CD19 CAR-T 细胞治疗后似乎通常不会引起机会性感染。
水痘带状疱疹病毒
水痘带状疱疹病毒 (VZV) 是 CAR-T 免疫治疗后早期病毒感染的常见原因,可通过常规抗病毒预防治(阿昔洛韦或伐昔洛韦)予以缓解。大多数 VZV 感染可控,且结局未恶化。
BK病毒
BK 病毒 (BKV) 常见于儿童,可引起肾小管细胞和尿路上皮的持续性感染。感染的临床影响通常较小,且在具有功能性免疫系统的个体中具有自限性。而免疫功能低下者,尤其是接受造血干细胞移植的患者,可能会发生 BKV 再激活,导致严重并发症,如 BKV 相关肾病 (BKVAN)、输尿管狭窄或出血性膀胱炎。接受 CAR-T 治疗的患者也容易发生 BKV 再激活,不容忽视。
血源性病毒
相当比例的寻求CAR-T治疗的患者处于免疫功能低下状态,使他们更容易受到HBV、HCV等血源性病毒再激活的影响。最近的数据开始证明CAR-T治疗在慢性或已消退的 HBV 感染患者以及活动性HCV感染患者中的安全性,前提是这些患者接受持续的抗病毒预防(见表2)。

作者团队曾开展一项重要的研究,说明HBV 感染后的 CAR-T 治疗相关风险。1例有慢性 HBV 感染的 r/r DLBCL病例,尽管接受恩替卡韦预防治疗26个月,但该患者在接受 CD19/22 CAR-T 细胞连续输注后1个月停止治疗,随后HBV迅速重新激活,虽然重新给予恩替卡韦后 HBV-DNA 拷贝数下降,但临床状况没有改善。既往研究中的病例强调了恩替卡韦连续预防乙肝病毒激活的重要性,其随后纳入89例 r/r B 细胞恶性肿瘤患者,尽管持续进行恩替卡韦预防治疗,但1例患者在 CTI 后4个月HBV 再激活。这些结果共同强调了持续进行恩替卡韦或其他抗HBV药物预防治疗在确保CAR-T细胞治疗安全性方面的重要性。
在接受 CAR-T 免疫治疗的患者中,关于HCV再激活的数据相对较少,主要是由于将HCV 感染患者从大多数临床试验中排除。相比之下,其他免疫治疗(如CTLA-4和PD-1/PD-L1 免疫检查点阻断治疗)证实,HCV再激活的频率似乎低于 HBV 再激活,且通常与更有利的结局相关。
人类免疫缺陷病毒 (HIV) 携带者方面,患者参加临床试验的机会有限,只有少数 HIV 伴淋巴瘤患者接受CAR-T治疗,在已发表的文献中记录很少。Hattenhauer等汇编了目前发表的有限数据,显示共9例 DLBCL HIV 患者在临床试验中接受 CD19 CAR-T 治疗和抗逆转录病毒治疗 (ART)。在这些患者中,3例数据不足,3例达到完全缓解 (CR),1例达到部分缓解 (PR),1例在CAR-T输注后15天显示难治,1例CR但在4个月后疾病进展 (PD)。
综上所述,对于准备CAR-T免疫治疗的患者,尽管存在免疫功能受损的潜在风险以及 HBV/HCV再激活和暴发性肝炎的可能性,但目前的数据通常表明,通过持续、长期的抗病毒预防,CAR-T免疫疗法在慢性/已消退的HBV患者中具有可靠的安全性。
CAR-T 细胞治疗期间预防病毒感染的建议
随着商品化CAR-T细胞产品的激增以及临床试验和新型CAR-T设计研究的不断进展,也相继发表了各种指南和建议,包括选择合适患者、给予CAR-T免疫治疗和管理毒性作用。虽然许多关于感染的建议是从异基因和自体造血干细胞移植的早期数据外推而来,但2019年由著名协会发布的三个文件中的抗菌预防建议确实存在差异,尤其在抗病毒预防方面。相关差异可能是由于免疫功能低下人群中某些预防策略的疗效和安全性数据不足,其他促成因素则包括不同地区的发病率、耐药模式和流行病学差异。
区分病毒感染
感染预防的主要和关键问题在于早期识别与病毒感染相关的高危因素。如前所述,这些风险因素包括宿主因素,如年龄、既往治疗、感染史、B淋巴细胞减少、低水平丙种球蛋白、CRS和ICANS。在回输后第二阶段发生的感染中,呼吸道病毒占病例的58%。应用以下药物的患者特别容易感染:>1 dose托珠单抗、7天内有3天需要大剂量糖皮质激素(每日≥10 mg地塞米松)、甲泼尼龙≥1g或anakinra(IL-1 受体拮抗剂)。还应考虑机会性感染,包括 CMV 等潜伏性病毒感染的再激活。部分研究探索了非侵入性血清学标志物,以区分单纯CRS和CRS伴感染事件。作者中心的既往数据表明,CRS患者中出现“IL-6双峰”与危及生命的感染相关,还设计了一个包含3种细胞因子(IL-8、IL-1β和γ-干扰素)的预测模型,有助于鉴定感染;但该研究规模有限且大多数感染病例为细菌感染。
CAR-T受者的抗病毒预防与治疗
在整个临床过程中,病毒预防对于接受CAR-T治疗的患者至关重要,尤其是对于感染风险较高的患者。在CAR-T免疫治疗之前,患者必须按照EBMT指南和专家意见的建议进行HIV、乙型肝炎(HBsAg、抗 HBs 和抗HBc)和丙型肝炎血清学筛查(见图5)。如果任何血清学检测呈阳性,则还需要进行病毒载量检测。如果患者出现发热或可疑症状,应使用PCR检测、血清学检测、胸部 x 线和/或高分辨率CT胸部筛查呼吸道病毒。对于不明原因发热的患者,可使用其他筛查方法包括宏基因组二代测序、腰椎穿刺和脑部MRI。

EBV和CMV在一生中容易引起潜伏性或既往感染,因此必须考虑这些感染的再激活。CMV和EBV的血清学抗体检测是常规实践。建议高危感染患者在停止免疫抑制治疗后每周进行一次血清学检测,持续30天。根据自体干细胞移植受者的指南,如果血清学结果超过CMV病毒载量阈值,则可以在医院开始抢先抗病毒治疗;但该预防方法的成本效益和临床效用仍需研究。
关于抗病毒预防,其方法因临床经验、现行指南和当地流行病学而异。根据EBMT/EHA,不应延迟给予基于症状和机构方案的经验性抗菌治疗。专家意见建议在CAR-T治疗前的预处理化疗期间开始阿昔洛韦400 mg口服每日两次或伐昔洛韦500 mg口服每日两次,并在 CAR-T输注后继续该方案治疗6个月以上。
对于预防单纯疱疹或水痘-带状疱疹病毒,伐昔洛韦或阿昔洛韦可给药至CAR-T输注后12个月,或至CD4+计数超过200个细胞/mm3。乙型肝炎表面抗原或乙型肝炎核心抗体筛查阳性的患者应服用恩替卡韦或替诺福韦,特别是可检测到HBV DNA时。这些患者应在 CAR-T 治疗前接受抗病毒治疗,并在HBV再激活时持续治疗6个月以上,HBV再激活可能导致接受B细胞靶向药物治疗的患者出现严重后果。应在预防阶段和停药后12个月内每月监测一次乙型肝炎DNA。
接受CAR–T细胞治疗的患者中很少报告慢性HCV感染。建议定期监测病毒载量,慢性HCV感染患者应转诊至专科医生处讨论抗HCV治疗选择。通常来说抗病毒预防的决策更依赖于经验治疗而非病因学证据。CAR-T治疗中抗病毒预防的管理还需要更多设计良好、大规模、多中心研究。
HIV 阳性个体应在整个CAR-T期间维持 高效抗逆转录病毒治疗。应监测基线CD4+ T细胞计数和 HIV 病毒载量,每2或3个月重复一次。
支持治疗
对于接受CAR-T细胞治疗的淋巴瘤患者,早期监测和识别风险因素通常有助于使用支持疗法来增强免疫力、增加对感染的抵抗力和改善营养状况。免疫球蛋白补充是一种主要的支持方法(见图6),但由于成本效益考虑、低丙种球蛋白血症值的变异性以及不同国家和地区的不同规定,使用预防性免疫球蛋白补充剂进行CAR-T治疗管理仍不明确。普遍认为以下患者应接受免疫球蛋白:儿童或CAR-T输注前和CAR-T细胞治疗后90天内免疫球蛋白G水平≤400mg/dL。对于中度低丙球蛋白血症 (400–600 mg/dL) 伴复发性和重度感染,也建议使用免疫球蛋白替代治疗。
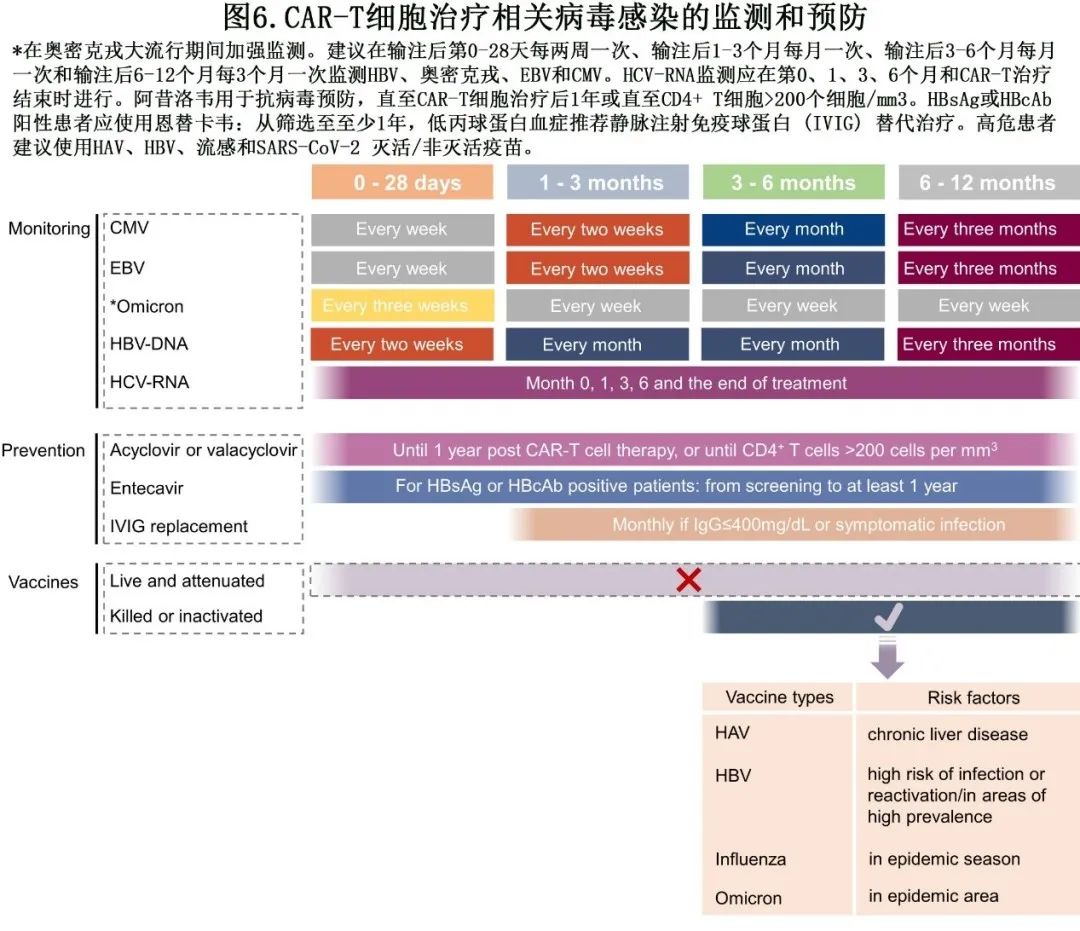
长期血细胞减少是 CAR-T 免疫治疗后的常见事件,而中性粒细胞减少是化疗后的常见事件,两者都会增加感染的易感性。因此在临床实践中,这些患者经常使用粒细胞巨噬细胞集落刺激因子 (GM-CSF) 和粒细胞集落刺激因子 (G-CSF)。但GM-CSF和 G-CSF 在 CAR-T 免疫治疗中的作用仍有争议。
另一种支持策略(CAR-T细胞治疗后疫苗接种)的作用也仍不确定,尚缺乏可靠的数据来指导疫苗接种方法,包括适当的患者、时间和疫苗类型。专家建议在流感季节预处理化疗前至少2周完成流感疫苗接种。对于 CD19 CAR-T 细胞治疗后≥6个月和末次免疫球蛋白治疗后≥2个月的患者,建议使用灭活疫苗。CD19 CAR-T 细胞治疗后≥1年的患者建议接种活疫苗和非活疫苗。在接种疫苗的情况下,应评估特异性抗体应答。还需要进一步的研究为疫苗接种建议提供指导,包括 COVID-19。
COVID-19后疫情时代的特殊考虑
在COVID-19的后疫情时代,对其特别考虑也至关重要。建议在CAR-T细胞治疗前进行 COVID-19核酸检测。对于重度COVID-19风险高的患者应加强警惕。如果患者在CAR-T治疗前诊断为SARS-CoV-2感染,则应延迟CAR-T治疗的开始时间,并在必要时转换为小分子靶向药物。
对于住院的COVID-19 患者,地塞米松是降低死亡率的主要治疗,但它可能导致SARS-CoV-2清除延迟,因此强烈建议糖皮质激素联合抗病毒治疗,以减少病毒载量,联合治疗也有利于管理 CTI 后潜在的活化CRS。在重度COVID-19病例中使用免疫调节剂,如IL-6 抑制剂(如托珠单抗)和巴瑞替尼(选择性JAK抑制剂)仍有争议,需要慎重考虑,尤其是在B细胞缺陷患者中。恢复期血浆的应用需要在COVID-19 CAR-T受者中仔细评估。对照试验表明,在门诊早期使用瑞德西韦、莫诺拉韦胶囊和奈玛特韦/利托那韦可显著降低住院或死亡的风险。尽管免疫功能受损患者的数据有限,但由中和性单克隆抗体和抗病毒药物组成的联合给药方案可能是减少与病毒载量和预防单药治疗相关耐药性的策略。
对于接受过 CAR-T 治疗的患者,建议在CAR-T输注后至少3个月才接种COVID-19灭活疫苗;此外CAR-T治疗后第一年内应避免接种活疫苗和减毒疫苗(见图6)。建议在COVID-19大流行期间使用 Tixagevimab/cilgavimab 进行暴露前预防,特别是对于CAR-T 治疗1年内的患者;它可以降低突破性感染患者的重度感染和死亡风险,但奥密克戎变异株可能对Tixagevimab/cilgavimab的敏感性降低。
结论和未来前景
目前对 CAR-T 治疗期间感染的理解主要来自回顾性研究,通常参照其他血液学治疗方法,如造血干细胞移植,而CAR-T细胞治疗后B细胞恶性肿瘤中病毒感染的系统评价仍然很少,因此更深入地了解 CAR-T 输注后的免疫重建至关重要。随着对药物相互作用、毒性和抗菌药物耐药性认识的提高,有必要将预防策略建立于证据的基础上。对 CAR-T 免疫治疗中病毒筛查和预防的影响进行全面和彻底的研究,对于在临床环境中提供明确的指导至关重要。
关于 CAR-T 治疗和感染的多个问题,还需要进一步的临床研究来澄清。例如,目前获批的 CAR-T 细胞治疗适应症主要限于复发性/难治性血液恶性肿瘤,即原发性 B 细胞恶性肿瘤。随着 CAR-T 免疫疗法适应症的扩展,关于CAR-T治疗中感染风险的理论可能会发生转变,例如用于治疗其他自身免疫性或感染性疾病的患者。此外,随着 CAR-T 产品和治疗策略的进步,联合使用其他免疫调节药物(如 BTK 抑制剂、西达本胺或检查点抑制剂),评估这些药物(与既往产品相比)是否会改变感染风险变得至关重要。同时,既往对 CAR-T 疗法有显著影响的临床试验往往排除了近期或持续性感染的患者,有必要重新评估真实世界的经验,以确定部分感染是否仍是 CAR-T 免疫治疗的绝对禁忌。mNGS作为一种灵敏的病毒检测方法的出现,进一步提高病毒检出率。鉴于 COVID-19 和 HBV 再激活的发病率升高,也是更广泛人群中亟需关注的问题。针对病毒疫苗接种达成共识还需要更多的支持性证据。考虑到不同地区流行病学和医疗保健可及性的差异,来自更广泛来源的共识和实践指南至关重要。总之,解决这些问题需要全面整合更多的临床数据、生物标志物筛选以及设计良好的研究的开发和验证。
参考文献
Qian H, Yang X, Zhang T, et al. Improving the safety of CAR-T-cell therapy: The risk and prevention of viral infection for patients with relapsed or refractory B-cell lymphoma undergoing CAR-T-cell therapy. Am J Hematol. 2024;1‐17. doi:10.1002/ajh.27198
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#B细胞淋巴瘤# #CAR-T治疗#
22