JIC:CD3/GD2双特异性抗体标记T细胞靶向治疗复发/难治性神母和骨肉瘤
2024-04-08 儿童肿瘤前沿 儿童肿瘤前沿 发表于陕西省
研究结果支持了在更大规模的II期和III期临床试验中对GD2BATs疗效的进一步研究。
GD2蛋白在几乎所有的神经母细胞瘤和80%的骨肉瘤上均有高表达,是抗体依赖性细胞毒性类药物的靶点。目前已有抗GD2单克隆抗体在临床应用,但有10%-20%的高危神经母细胞瘤患者未能获得缓解,50%-60%的干细胞移植后接受免疫治疗的患者出现复发。因此用携带抗CD3和抗GD2双特异性抗体(GD2Bi)的自体T活化细胞(GD2BATs)靶向神经母细胞瘤和骨肉瘤可能是一种可行有效的方法。
近日,来自美国的 Maxim Yankelevich 和 Nai-Kong V Cheung 等组成的研究团队,在Journal for the immunotherapy of Cancer 发表题为 Targeting refractory/recurrent neuroblastoma and osteosarcoma with anti-CD3×anti-GD2 bispecific antibody armed T cells 的文章,展示在美国多个儿童医院和儿科中心开展临床研究评价GD2BATs安全性和疗效的结果。

在该I期临床研究中入组12例患者(7例神经母细胞瘤、3例骨肉瘤和2例结缔组织增生性小圆细胞瘤),其中9例完成了治疗。12例神经母细胞瘤患者进入II期治疗,10例完成了方案治疗。具体治疗流程和生存曲线图见图1。
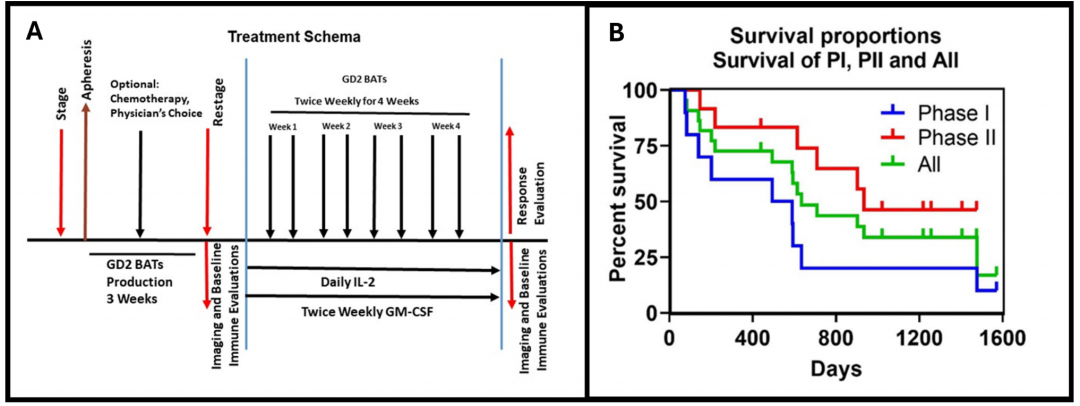
图1:(A)治疗流程示意图。它显示了I/II期研究的治疗方案。(B)I期和II期临床研究的生存曲线。它显示了I期(蓝色,OS=18.0个月)、 II期(红色,OS=31.2个月)和所有患者(绿色,OS=21.0个月)的Kaplan-Meier总生存曲线。GM-CSF,粒细胞巨噬细胞集落刺激因子;OS,总生存率。
不良反应评价
在I期研究中,9例患者共接受了72例次GD2BATs输注。没有患者因不良反应而停止治疗。所有患者均出现轻度细胞因子释放综合症,伴有1-3级发热、寒战、头痛、恶心(9/9例患者),偶尔出现1-2级低血压(3/9例患者)。最常见的2级和3级毒性反应(各55%)为发烧和寒冷,从输注后开始,持续72小时。其次是头痛和低血压。低血压较轻,不需要升压治疗。罕见缺氧(一个病人有一次发作),但不需要吸氧治疗。9例患者中有8例(任何级别)出现恶心伴或不伴呕吐。3例(33%)患者出现2级下肢疼痛,并服用布洛芬治疗,持续时间3天。未观察到剂量限制性毒性(DLT),也未达到最大耐受计量(MTD)。II期研究观察到的毒性反应与I期相似,也未观察到剂量限制性毒性。所有毒性反应均在72小时内降低到3级以下。
临床疗效评价
在I期患者中,未观察到基于影像学的治疗反应。9例患者中有6例(3/5神经母细胞瘤、2/3骨肉瘤、1/1结缔组织增生性小圆细胞瘤T)为疾病进展,3例(2/5神经母细胞瘤、1/3骨肉瘤)为疾病稳定。9例患者中有5例(1例骨肉瘤,4 例神经母细胞瘤)在GD2BATs治疗后存活1年,中位总生存期为18个月。
虽然I期患者IT20111和IT20115没有观察到治疗客观反应,但他们的临床病程值得关注。编号为IT20111的患者,神经母细胞瘤浸润骨髓并伴有进行性转移性骨和软组织疾病,接受了剂量为40×10^6 GD2BATs/kg/次的治疗。治疗产生了完全的骨转移反应(图2A ),并在其他转移部位转移灶稳定持续约6个月。研究治疗后6个月,再次采用之前治疗失败的化疗方案患者(拓扑替康和环磷酰胺),产生了MIBG反应,跛行和疼痛得到改善。该患者在接受GD2BAT治疗36个月后病情进展,47个月后死亡。
在剂量为60×10^6 GD2BATs/kg/次的治疗中,标号为IT20115患者在鼻咽部表现出早期代谢性PET反应,第六次输注GD2BAT后FDGPET摄取显著降低(图2B)。鼻软组织肿块的活检显示大量CD8+细胞浸润(图2C)。根据RECIST标准,患者病情稳定,开始使用帕佐帕尼,并保持稳定,延长其缓解期一年。该患者在GD2BAT治疗14个月后出现进展。
在II期10例可评估的神经母细胞瘤患者中,1例(IT0001 3)根据INRC标准达到PR,5例为SD,4例为PD。值得注意的是,在一些整体SD患者中观察到额外的临床疗效反应,包括一个软组织肿块缩小患者和另一个骨髓肿瘤细胞消失患者。II期组的中位总生存期为31.2个月。PR患者在没有额外治疗的情况下进行监测,6个月后进展。所有5名SD患者均开始接受额外的治疗。
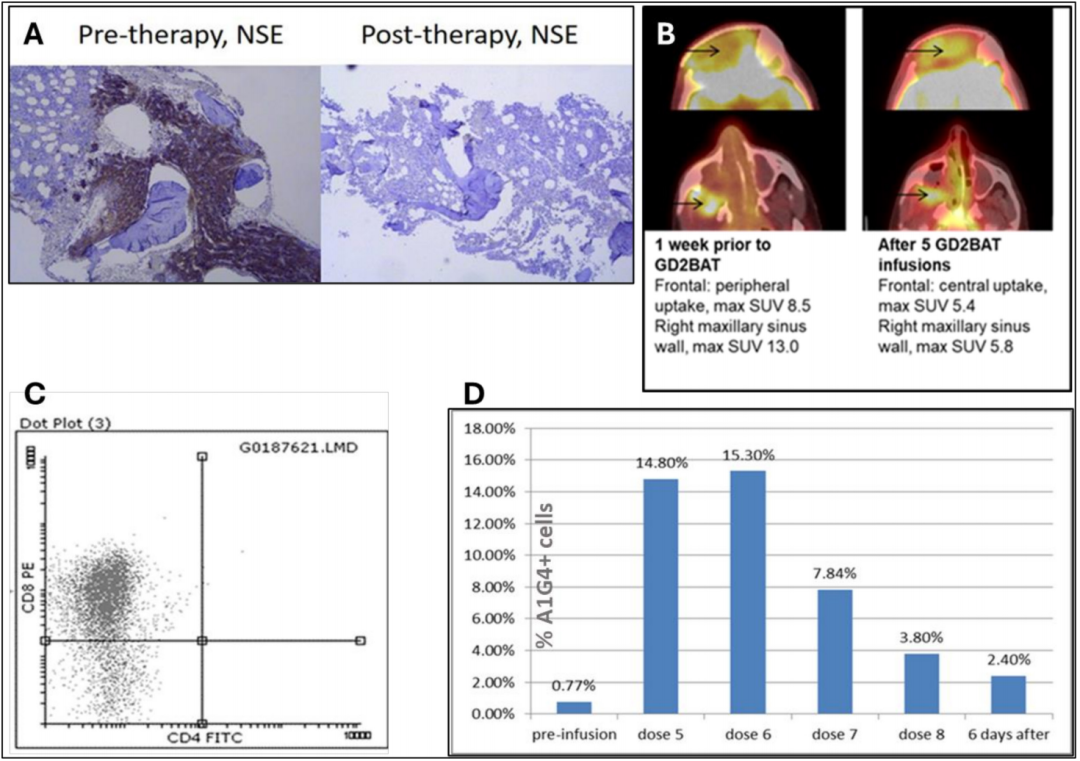
图2(A)一名编号为IT20111神经母细胞瘤患者在输注8次GD2(A)后,观察到骨髓中神经元特异性烯醇化酶(NSE)阳性肿瘤细胞被清除的骨髓反应。(B)在一名编号为IT2011骨肉瘤患者中,5次注射GD2BAT后代谢性PET的变化。箭头标记GD2BATs前后颅内额、右上颌窦肿瘤延伸。(C)流式细胞术染色检测CD4+和CD8+细胞,以评估编号为20115患者的肿瘤中是否存在肿瘤浸润淋巴细胞。鼻内肿瘤浸润淋巴细胞多为CD8+细胞(用CD3+细胞设门,FITC阳性表示CD4T细胞和PE阳性表示CD8T细胞)。(D)8号患者输注前及GD2BATs期间和之后不同时间外周血单个核细胞中CD3+A1G4+细胞的比例,CD3的%+A1G4+细胞显示外周血中GD2BATs的持续存在。CD3+A1G4+使用抗cd3和A1G4抗独特型抗体hu3F8对淋巴细胞进行门控流式细胞仪进行检测。PET,正电子发射断层扫描;SUV,标准化吸收值。
在II期研究中,编号为IT00013患者伴有复发性神经母细胞瘤和胸腹多发软组织肿块,在GD2BAT输注后的所有病灶均出现部分缓解(图3A),并伴有MIBG扫描的改善。虽然该患者按照INRC标准评价为疾病进展,但在硬脑膜颅内软组织肿块中达到了部分缓解(图3B)。编号为IT00033患者在GD2BAT治疗后表现为疾病稳定,随后重新开始先前的挽救性化疗(拓扑替康和环磷酰胺),在GD2BAT后1年MIBG扫描为阴性。患者在GD2BAT后存活4年。编号为IT000040患者虽然达整体评价为的疾病稳定,但骨髓中的肿瘤细胞被清除。
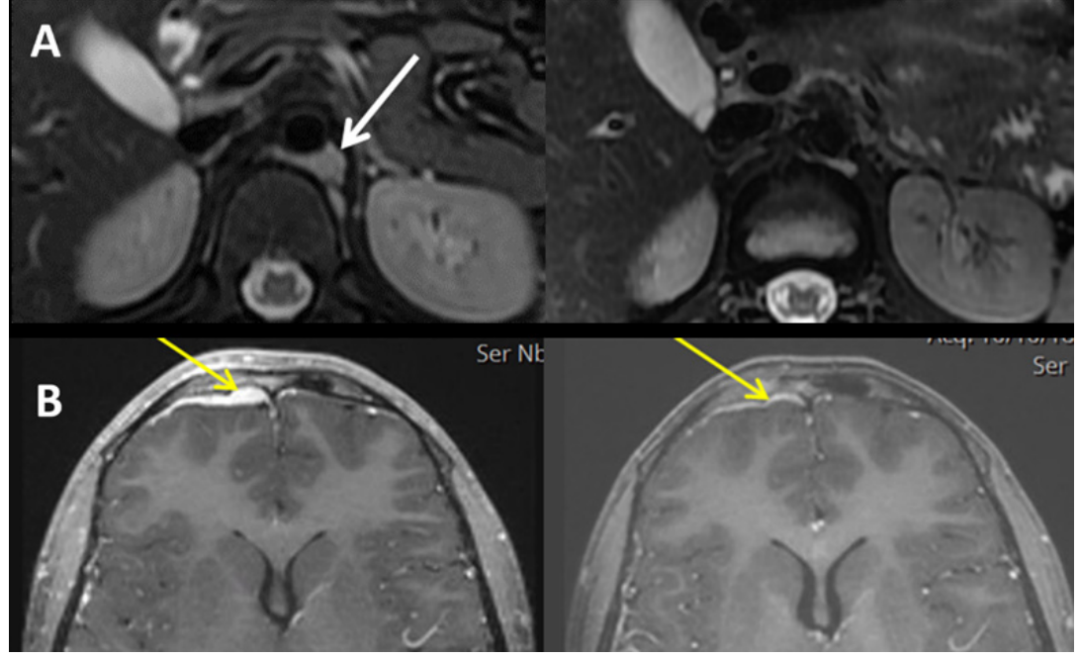
图3(A)患者IT00013(左图)前后腹膜后软组织肿块(白色箭头标记)。(B)患者IT00031颅内硬脑膜0031肿块(黄色箭头标记)(左图)前后(右图)8次输注GD2BATs。
结论
本研究表明GD2BATs每次输注高达160×106细胞/kg安全性,虽然在I/II期研究中缺乏客观疗效数据,但有病例显示输注GD2BATs可以“免疫敏感”肿瘤,使它们对随后的化疗更敏感。研究结果支持了在更大规模的II期和III期临床试验中对GD2BATs疗效的进一步研究。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#骨肉瘤# #神经母细胞瘤# #T细胞靶向治疗#
16