【专家述评】| 21世纪以来胃癌治疗进展及未来展望
2024-04-11 中国癌症杂志 中国癌症杂志 发表于陕西省
本文总结21世纪以来胃癌防治领域中的重要研究进展,并对未来进行展望,期待在胃癌早期筛查、诊断和精准治疗方面取得更大进步和突破,进一步提高患者的总生存率,将胃癌转变为可以控制的“慢性病”。
[摘要] 胃癌作为中国发病率及死亡率均位居前列的恶性肿瘤,具有异质性高、预后差等特点。进入21世纪,随着基因组学、腹腔镜微创技术、靶向治疗及免疫治疗的迅速发展,胃癌诊疗水平取得了长足进步。本文总结21世纪以来胃癌防治领域中的重要研究进展,并对未来进行展望,期待在胃癌早期筛查、诊断和精准治疗方面取得更大进步和突破,进一步提高患者的总生存率,将胃癌转变为可以控制的“慢性病”。
[关键词] 胃癌;微创治疗;肿瘤分期;D2根治术;围手术期治疗;靶向治疗;免疫治疗;进展;展望
[Abstract] Gastric cancer, a malignant tumor with high morbidity and mortality in China, has characteristics such as high heterogeneity and poor prognosis. With the advent of the 21st century, significant progress has been made in gastric cancer diagnosis and treatment due to the rapid development of genomics, laparoscopic minimally invasive techniques, targeted therapy and immunotherapy. This article summarized the important research progress in the field of gastric cancer prevention and treatment since the 21st century, and looked forward to the future. We hope to make greater progress and breakthroughs in early screening, diagnosis and precise treatment of gastric cancer, further improve the overall survival rate of patients, and transform gastric cancer into a controllable “chronic disease”.
[Key words] Gastric cancer; Minimally invasive treatment; Tumor staging; D2 radical surgery; Perioperative treatment; Targeted therapy; Immunotherapy; Progress; Prospect
胃癌是中国常见的恶性肿瘤之一,国家癌症中心发布的最新全国癌症统计数据[1]显示,胃癌新发病例数和死亡病例数均位居恶性肿瘤的第3位,其中新发病例数39.7万例,死亡病例数28.9万例。中国胃癌患者具有分期晚、异质性强及预后差的特点,严重威胁着患者的生命健康。进入21世纪,胃癌领域取得了多方面的突破性进展。本文拟回顾和总结21世纪以来胃癌治疗领域的突破性研究进展,为未来临床研究的深入开展、临床实践的方案制订拓展思路。
21世纪以来胃癌治疗进展大致分为以下几个阶段:2001—2010年主要是全球胃癌的分期方法走向统一,以及进展期胃癌D2手术方式的统一;2011—2023年主要是胃癌治疗进入微创治疗、靶向治疗和免疫治疗时代;2024年以后胃癌研究的发展方向包括预防、早期诊断,以及基于大数据和人工智能(artificial intelligence,AI)进行分子分型的精准化、个体化治疗,进一步降低胃癌的发病率,提高患者的生存率。
1 2001—2010年:全球在分期和治疗方面求同存异
1.1 胃癌分期统一
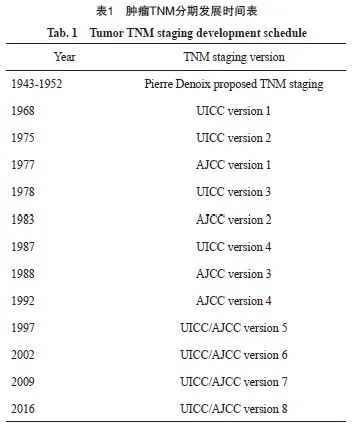
对肿瘤进行分期治疗的理念已被广泛接受。TNM分期是目前国际上应用最广泛的肿瘤分期方法,最早由法国学者Pierre Denoix于1943—1952年提出[2]。后来,国际抗癌联盟(Union for International Cancer Control,UICC)和美国癌症联合会(American Joint Committee on Cancer,AJCC)建立了国际性的TNM分期标准,并分别于1968年和1977年出版了第1版《恶性肿瘤TNM分类法》手册[3-4]。此后,UICC和AJCC负责颁布和修订恶性肿瘤TNM分期标准(表1)[4]。
在胃癌的治疗方面,日本一直是全球治疗方案的引领者,其制定了完善的《胃癌治疗指南》和《胃癌治疗规约》,成为世界各国参照的标准。1962年,日本胃癌协会(Japanese Gastric Cancer Association,JGCA)首次制定了《胃癌处理规约》[5],并提出了分期的概念,旨在帮助外科医师进行淋巴结清扫。JGCA的N分期是根据受累淋巴结的部位进行划分。前4版UICC和AJCC的TNM分期中,N分期与日本N分期方法一致,都是根据淋巴结转移的解剖学位置来划定。1997年,UICC和AJCC修订并统一了TNM分期(即第5版UICC/AJCC分期),自该版开始不再使用第4版的N分期方法,而是使用转移淋巴结数量来代替位置进行N分期。与JGCA的N分期相比,第5版UICC/AJCC的N分期更加简洁、可重复,对预后的判断更为敏感。
自此之后,胃癌领域一直存在着UICC/AJCC的TNM分期系统与JGCA分期系统长期并存的复杂局面。为了促进世界范围内的交流与协作,2008年8月,AJCC、UICC和国际胃癌协会(International Gastric Cancer Association,IGCA)在美国召开了1次旨在修订和统一胃癌分期的会议,并首次邀请日本的胃癌专家参与胃癌TNM分期的制定工作。随后,为实现国际标准化,第14版日本《胃癌处理规约》[6]采用了UICC/AJCC的TNM分期标准,与同时期修订的第7版UICC/AJCC的TNM分期进行了一致性修订,首次实现了UICC、AJCC和JGCA 3个分期系统的统一。这为全球范围内横向评价胃癌治疗效果提供了权威的标准,对促进胃癌诊治的国际交流和临床研究具有不可估量的作用。
1.2 局部进展期胃癌D2手术统一
在胃癌根治术中,切除肿瘤的同时进行胃周淋巴结清扫已成为公认的手术方式,但对于淋巴结清扫的范围究竟应该多大,一直存在争议。在东亚国家如日本,推崇D2淋巴结清扫,而西方国家则更多采用D1淋巴结清扫。针对这个问题,研究者们进行了许多探讨。
英国MRC试验[7]结果显示,接受D1术和D2术患者的5年总生存(overall survival,OS)率差异无统计学意义(33% vs 35%,P=0.43),胃癌相关死亡率和无复发生存(recurrence-free survival,RFS)率差异也无统计学意义(P>0.05)。同年,荷兰Dutch试验[8]结果发布,初步证实了MRC试验的结论:接受D1术和D2术患者的5年OS率和复发风险差异无统计学意义,但D2术的术后并发症和围手术期死亡率明显升高。基于上述研究,西方国家更多采用D1术。直到2010年,Dutch研究[9]的15年随访结果发布,发现D2术可以显著降低胃癌相关死亡率(37% vs 48%,P=0.01)、远期局部复发率(12% vs 22%)和区域复发率(13% vs 19%),从而奠定了D2淋巴结清扫在胃癌根治术中的标准地位。
比D2范围更广的淋巴结清扫是否能使患者进一步获益一直存在争议。日本的JCOG-9501试验[10]对此进行了探讨。该研究纳入了523例T2b、T3或T4期胃癌患者,263例接受D2手术,260例在标准D2术的基础上,增加腹主动脉旁淋巴结清扫(para-aortic lymph nodes disp,PAND)。结果显示,两组间的5年OS率、无复发生存(progression-free survival,PFS)率和复发风险均未见显著差异,但D2+PAND组手术时间、失血量和并发症发生率显著增加。因此,目前不推荐将D2+PAND作为进展期胃癌根治的标准手术方式。
基于上述Dutch研究和JCOG-9501试验提供的证据,D2根治术作为局部进展期胃癌的标准手术方式在世界范围内已逐渐趋于统一。
1.3 全球围手术期治疗的不同模式
目前研究表明,围手术期辅助治疗可延长胃癌患者术后的生存时间。然而,胃癌围手术期的治疗模式在全球各个地区还不太一致。目前主要有3种主流的模式:以北美为主的手术+术后同步放化疗模式,以欧洲为主的术前新辅助化疗+手术+术后辅助化疗模式,以及以东亚人群为主的D2根治术+术后辅助化疗模式。
INT-0016研究[11]证明了术后放化疗的优势,其结果显示,接受术后同步放化疗对比单纯手术可提高生存率(36个月 vs 27个月,P=0.005),为在北美采取手术结合辅助放化疗奠定了基础。
胃癌术前新辅助化疗的相关研究早期主要在欧洲进行。2006年,英国的MAGIC研究[12]结果显示,ECF方案(表柔比星+顺铂+5-氟尿嘧啶)术前化疗较单纯手术可明显降低肿瘤大小和分期,提高患者的OS率和PFS率,为新辅助化疗在欧洲胃癌患者中广泛使用提供了强有力的证据。随后,德国的FLOT4研究[13]证实术前FLOT方案(5-氟尿嘧啶+亚叶酸钙+奥沙利铂+多西他赛)方案优于ECF方案,因此欧洲将围手术期化疗的推荐方案改为FLOT方案。术前新辅助治疗的研究随后也在亚洲开展,包括PRODIGY研究[14]、RESOVLE研究[15]和JCOG0501研究[16]。韩国的PRODIGY研究[14]对比了新辅助DOS方案[多西他赛+奥沙利铂+替吉奥(S-1)]化疗+手术+术后S-1辅助化疗和手术+术后S-1辅助化疗用于治疗可切除晚期胃癌患者的疗效,结果显示,DOS方案新辅助化疗作为围手术期化疗的一部分可提高患者的PFS率和OS率。中国的RESOLVE研究[15]结果表明,与手术+术后XELOX方案(卡培他滨+奥沙利铂)辅助治疗相比,术前SOX方案(S-1+奥沙利铂)+手术+术后SOX方案辅助治疗可显著地改善胃癌患者的生存。然而,日本的JCOG0501研究[16]却发现,与手术+术后S-1辅助化疗相比,增加术前CS方案(S-1+顺铂)新辅助化疗并没有改善Borrmann Ⅳ型胃癌或大的(直径超过8 cm)Ⅲ型胃癌患者的生存。因此,日本胃癌指南中不推荐对此类患者行术前新辅助治疗。
与新辅助治疗的争议不同,在胃癌辅助化疗方面,全球逐渐达成了共识。近年来,在亚洲进行的几项临床试验,证实D2术后加以辅助化疗,可以进一步提高患者的生存率,从而奠定了D2根治术+术后辅助化疗用于治疗胃癌的模式。日本的ACTS-GC试验[17]是第1个探索胃癌D2术后是否需要辅助化疗的研究,共纳入1 059例Ⅱ~Ⅲ 期胃癌患者,其中530例仅接受D2手术治疗, 529例在D2术后接受S-1辅助治疗1年,D2+S-1组的3年OS率和RFS率均显著高于单纯D2手术组。2011年,该研究的5年随访结果[18]发布,进一步证实了上述结论。胃癌术后S-1单药辅助治疗成为Ⅱ~Ⅲ期胃癌患者术后辅助治疗的标准方案。JACCRO GC-07试验[19]则证实在胃癌D2根治术后辅助治疗中,对于病理学分期为Ⅲ期的患者,S-1联合多西他赛双药组对比S-1单药组,3年RFS率和OS率表现更优。与上述ACTS-GC试验类似,韩国主导的CLASSIC试验[20]结果也显示,无论3年无病生存(disease-free survival,DFS)率还是OS率,XELOX组较单纯手术组都显著获益。
既然术后辅助化疗有益,那么在此基础上增加放疗,能否给亚洲的胃癌患者带来生存获益呢?答案是否定的。韩国的ARTIST-Ⅰ研究[21]结果显示,术后放化疗组(卡培他滨联合顺铂2个周期后卡培他滨同步放化疗再化疗2个周期)和术后化疗相比,并未提高3年DFS率(74.2% vs 78.2%,P=0.086 2)。针对D2术后淋巴结转移阳性胃癌患者的ARTIST-2试验[22]也显示,与S-1单药相比,SOX或SOXRT方案辅助治疗可提高DFS率,而SOX组和SOXRT组之间DFS率差异无统计学意义,提示对于接受了D2根治术的胃癌患者,在化疗基础上联合放疗并不能进一步提高患者的生存率。究其原因,可能主要与放化疗的原理有关,放疗本质上与手术类似,都是一种局部治疗手段,如果胃癌患者的D2手术开展比较成熟,则放疗难以进一步发挥作用。而化疗是一种全身性治疗模式,与手术可以互为补充。
导致目前全球在胃癌围手术期治疗模式差异的原因,主要还是手术方式存在差异。由于西方国家的患者肥胖、胃癌发病率低等客观因素,导致D2手术在西方国家做的相对较少,大部分做的是D1手术,只能以化疗和(或)放疗进行弥补。尽管生存期相对于手术治疗有所延长,但与亚洲国家相比,患者的生存时间还不够长。这说明手术是整个治疗的核心,对于以手术为根治手段的肿瘤来讲,手术质量是最重要的。在评价围手术期辅助治疗模式时,在手术同质化的前提下进行比较才有意义。随着D2手术在西方国家中逐渐普及,相信全球围手术期的治疗模式也会最终走向融合。
2 2011—2023年:微创治疗、靶向治疗及免疫治疗的新理念异彩纷呈
2.1 胃癌腹腔镜技术突飞猛进
目前,胃癌治疗的核心仍然是以手术为主的综合治疗。1994年,日本的Kitano等[23]报告了世界上第1例使用腹腔镜辅助进行远端胃癌根治术的病例,开启了腹腔镜用于胃癌治疗的新时代。在过去的10余年里,胃癌腹腔镜手术得到较大发展,尤其是在中、日、韩等胃癌高发的东亚国家中。来自这些国家的大型临床研究为胃癌腹腔镜手术的推广和实践提供了高级别的循证医学证据。
对于早期胃下部癌,韩国的KLASS-01研究[24]比较了开放式远端胃切除术(open distal gastrectomy,ODG)和腹腔镜远端胃切除术(laparoscopic distal gastrectomy,LDG)的远期效果,结果显示,接受LDG和ODG的患者的5年OS率和肿瘤特异性生存率相似,表明LDG用于早期胃癌治疗是一种安全的选择。与KLASS-01研究类似,日本JCOG0912研究[25]结果也表明,LADG组的5年RFS率与ODG组接近。上述两项研究为早期胃下部癌的腹腔镜手术提供了可靠的循证医学证据。
对于发生于胃上1/3的早期胃癌,腹腔镜全胃切除术(laparoscopic total gastrectomy,LTG)的长期安全性及疗效仍然缺乏相关的大型前瞻性临床试验。回顾性研究[26]结果表明,LTG对于早期胃癌切除具有良好的可行性和安全性。中国的CLASS-02研究[27]比较了早期胃癌患者接受LTG和OTG术后30 d内的并发症发生率和死亡率,结果显示,LTG组和开放式全胃切除术(open total gastrectomy,OTG)组间的并发症发生率和死亡率差异均无统计学意义。
对于腹腔镜手术用于局部进展期胃癌的安全性及有效性,目前已有三项大规模随机对照试验结果发布。其中,中国李国新等牵头的CLASS-01研究[28-29]是首个针对腹腔镜手术治疗进展期胃癌的多中心随机对照试验,该研究比较了接受LDG和ODG的进展期胃癌患者的长期生存,结果显示,LDG组和ODG组的3和5年OS率差异均无统计学意义,证实腹腔镜下D2淋巴结清扫远端胃切除术与ODG患者远期预后相似。另两项大型临床试验分别是韩国的KLASS-02研究[30]和日本的JLSSG0901研究[31],该两项研究结果均显示,LDG组和ODG组患者的5年OS率和术后并发症发生率差异无统计学意义。上述三项大型前瞻性研究结果均表明,对于局部进展期胃癌患者,在由合格的外科医师进行LDG联合D2淋巴结清扫治疗时,其安全性和有效性不逊于ODG。
2.2 早期胃癌内镜治疗迅猛发展
早期胃癌内镜下切除术主要包括内镜下黏膜切除术(endoscopic mucosal rep,EMR)和内镜黏膜下剥离术(endoscopic submucosal disp,ESD)。与EMR相比,ESD具有更高的整块切除率、病理学意义上的完全切除率及更低的原位复发率[32-33]。最初内镜切除的适应证为直径≤2 cm且不伴溃疡的黏膜内癌。随着ESD技术的发展,直径>2 cm的非溃疡分化型和直径≤3 cm的有溃疡分化型黏膜内癌,以及直径<2 cm的无溃疡未分化型黏膜内癌在第3、4版日本《胃癌治疗指南》中被纳入为扩大适应证[34-35]。2018年,随着一项多中心、前瞻性研究(JCOG0607)[36]结果的发布,第5版指南将适应证适当扩大,直径>2 cm的非溃疡分化型和直径≤3 cm的有溃疡分化型黏膜内癌纳入为ESD的绝对适应证[37];而第6版指南则基于JCOG1009/1010研究[38],将直径<2 cm的无溃疡未分化型黏膜内癌纳入为绝对适应证[39]。综上所述,经过第5版及第6版指南对适应证的扩展,目前早期胃癌内镜治疗的绝对适应证包括:
⑴ EMR和ESD绝对适应证:直径≤2 cm的无溃疡分化型黏膜内癌。
⑵ ESD绝对适应证:直径>2 cm的无溃疡分化型黏膜内癌;直径≤3 cm的有溃疡分化型黏膜内癌;直径≤2 cm的无溃疡未分化型黏膜内癌。
2.3 靶向治疗发展较慢
2010年,ToGA研究[40]首次证实在标准化疗的基础上加用曲妥珠单抗,可显著延长人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性晚期胃癌患者的生存期,宣告了胃癌靶向治疗时代的到来。此后10年,血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR-2)抑制剂雷莫芦单抗从晚期胃癌三线治疗艰难进入二线治疗,抗血管生成药物阿帕替尼也开始用于晚期胃癌三线治疗。然而,这10年里更多的是众多胃癌靶向治疗研究(包括mTOR抑制剂、 cMET抑制剂等)的失败。用于治疗HER2阳性乳腺癌的有效靶向药物在胃癌的临床研究中也屡遭失败:拉帕替尼一线联合化疗在LOGiC研究[41]中未能延长OS;拉帕替尼二线治疗HER2阳性胃癌在TyTAN研究[42]中也未能延长OS;帕妥珠单抗+曲妥珠单抗双靶+化疗在JACOB研究[43]中仍未能延长OS;有“生物导弹”之称的抗体药物偶联物(antibody-drug conjugate,ADC)类药物T-DM1在GATSBY研究[44]中亦未能取得生存获益。
近年来,新型抗HER2药物(如新型ADC类药物)登场,突破了传统靶向药物瓶颈,为胃癌治疗带来新希望。DESTINY-Gastric 01和DESTINY-Gastric 02研究[45-46]初步证实了DS-8201(T-DXd)在HER2阳性晚期胃癌或食管胃连合部(esophagogastric junction,GEJ)腺癌后线治疗中OS率和客观缓解率(objective response rate,ORR)的改善。除了DS-8201,中国首个自主研发的ADC类药物维迪西妥单抗(RC-48)获批上市,在既往接受过二线化疗的HER2阳性胃癌患者中表现出优异的抗肿瘤活性和良好耐受性[47],标志着新型抗HER2治疗药物正逐渐应用于胃癌治疗中。此外,针对新型靶点(如CLDN18.2)药物的出现也为晚期胃癌治疗带来了曙光。SPOTLIGHT研究显示,与仅接受mFOLFOX6方案化疗相比,加上CLDN18.2靶向药物唑贝妥昔单抗能够显著改善患者的PFS和OS[48]。GLOW研究[49]也显示出相似结果,与仅接受CAPOX方案化疗相比,加上唑贝妥昔单抗能够显著改善患者的PFS和OS。基于这两项研究,唑贝妥昔单抗成为CLDN18.2阳性、HER2阴性晚期胃癌或GEJ腺癌患者新的一线治疗方案。
2.4 免疫治疗曙光初现
正如之前所述,过去10年里晚期胃癌一线治疗的重要进展只有针对HER2阳性患者的靶向药物曲妥珠单抗联合化疗取得了OS获益,而其他HER2靶向药物则均未能取得成功。在程序性死亡蛋白-1(programmed death-1,PD-1)/程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)抑制剂突破之前,胃癌的创新治疗进展有限。
2017年的ATTRACTION-2研究[50]表明,纳武利尤单抗用于至少二线治疗失败的胃癌患者,显示出明显的OS获益,使其成为全球首个获得晚期胃癌治疗适应证的PD-1抑制剂。2020年9月,Checkmate 649研究[51]的初步结果在欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)年会上震撼发布,给HER2阴性晚期胃癌一线治疗带来了第1个可能延长生存期的PD-1抗体纳武利尤单抗(O药),研究结果显示,纳武利尤单抗联合化疗相比于单纯化疗具有显著的近期疗效和远期生存获益。基于这项研究,纳武利尤单抗联合化疗已经成为HER2阴性晚期胃癌和GEJ腺癌的一线标准治疗方案。然而,对于CheckMate 649研究的种种问题仍需要进一步考虑,例如,该研究中,所有人群显示出临床获益是否因其中综合阳性评分(combined positive score,CPS)≥5的患者比例较高(达60.4%,远高于其他研究报告中的比例,KEYNOTE-061研究[52]中CPS≥5的比例为31%)而掩盖了CPS<1甚至CPS<5的患者相对较差的疗效。实际上,几乎与该研究同时公布的ATTRACTION-4研究[53]针对没有标志物选择的晚期胃癌一线治疗就未能在最关键的OS方面取得成功。上述研究提示,与靶向治疗一样,免疫一线治疗需要进行严格的标志物筛选,否则很难取得良好结果。
CheckMate 649研究开创了晚期胃癌一线免疫治疗的先河。随后,一系列关于其他PD-1单抗在胃癌一线治疗中的研究也取得良好的结果。ORIENT-16研究[54]结果显示,无论是在全人群还是CPS≥5的人群中,信迪利单抗联合化疗均可显著延长患者的OS和PFS,支持信迪利单抗联合化疗作为晚期胃癌标准一线治疗方案,信迪利单抗也成为首款国产的用于治疗晚期胃癌的PD-1抗体类药物;RATIONALE 305研究[55]证实另一款国产PD-1抗体替雷利珠单抗联合化疗能显著延长肿瘤区域阳性评分≥5%患者的中位OS和PFS,此方案已被2023年中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)胃癌指南列为ⅠA级推荐。KEYNOTE-859研究[56]证实,帕博利珠单抗(K药)联合化疗在HER2阴性晚期胃癌/GEJ腺癌一线治疗中能够显著提高OS,标志着帕博利珠单抗成功进入胃癌治疗领域。
从上述多项临床研究结果来看,患者对免疫治疗的反应与PD-L1的表达密切相关,表达水平越高,OS获益趋势越明显。如KEYNOTE-859研究[56]中,在PD-L1 CPS≤1的人群,K药联合化疗组的中位OS在总人群中仅延长1.5个月,在CPS>1的人群中延长1.6个月,而在CPS≥10的人群中延长近4.0个月。
此外,对于HER2阳性晚期胃癌患者的免疫治疗,2021年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会上发布的KEYNOTE-811研究的首次中期分析结果[57]显示,在曲妥珠单抗联合化疗基础上加入免疫治疗可以进一步提高ORR。基于该研究结果,美国食品药品管理局(Food and Drug Administration,FDA)于2021年5月批准了帕博利珠单抗和曲妥珠单抗联合化疗用于HER2阳性晚期胃癌/GEJ腺癌患者的一线治疗。2023年ESMO年会上发布了KEYNOTE-811研究的第3次中期分析结果[58],与安慰剂相比,帕博利珠单抗联合曲妥珠单抗加化疗可显著改善所有人群的中位PFS,其中CPS≥1人群的PFS获益更多。然而,另一个主要终点OS的差异无统计学意义。基于该结果,目前美国MRK公司正在与美国FDA讨论将帕博利珠单抗+曲妥珠单抗+化疗三联方案的适应证更新为PD-L1阳性(CPS≥1)和HER2阳性的“双阳性”胃癌或GEJ腺癌。
随着免疫治疗逐步向前线推进,将免疫治疗继续前移作为胃癌围手术期治疗,能否提高疗效,让更多患者获益?2023年ASCO年会上,中国中山大学肿瘤防治中心开展的一项探索特瑞普利单抗联合化疗用于局部晚期胃癌患者新辅助治疗的研究结果[59]公布,结果显示,围手术期特瑞普利单抗联合化疗可明显改善患者的病理学退缩。天津医科大学肿瘤医院开展的PERSIST试验结果[60]显示,围手术期信迪利单抗联合SOX方案获得了令人鼓舞的病理学完全缓解率和主要病理学缓解率。2022年ASCO年会上发布的DANTE试验结果[61]证实阿替利珠单抗联合FLOT对比单用FLOT方案能够提高患者的病理学缓解率,同时提高R0切除率。然而,对于备受关注的术后辅助免疫治疗的ATTRACTION-5研究却未获得阳性结果,同样被寄以厚望的新辅助免疫治疗联合化疗的KEYNOTE-585研究也以失败告终。因此,围手术期胃癌的免疫治疗探索仍然任重而道远。
3 2024年以后:继续推进胃癌防治与分型
3.1 预防是最好的治疗:美国胃癌发病变迁的启示
胃癌曾经在美国高居癌症发病率的首位,给社会带来了巨大的疾病负担。然而,近年来美国胃癌的发病率逐年下降[62]。究其原因主要有两点:首先是实施了分餐制度,使幽门螺杆菌(Helicobacter pylori,Hp)感染率大幅下降。Hp感染是胃癌的Ⅰ类致癌因子,主要通过粪、口和密切接触传播。为了预防Hp传染,美国采用分餐制度,避免了Hp交叉感染。其次是冰箱的普及,随着工业化和社会经济的发展,冰箱在美国等发达国家得到了普及,许多食物可以得到有效的保鲜,腌制食品的摄入减少,各种蔬菜和水果的摄入量也相对增加[63]。这些措施都极大地降低了胃癌的发病率。美国胃癌发病率变迁提示我们要推广健康饮食和生活方式,少吃腌制食物,不吃剩饭剩菜,提倡聚餐时使用公筷,以减少胃癌的发生。
3.2 早诊早治:日、韩的启示
胃癌的预后与诊治时机密切相关,早期胃癌的5年生存率超过90%,而进展期胃癌则低于20%,早期发现和治疗可以显著提高胃癌患者的生存率。同样是胃癌高发国家,日本胃癌的5年生存率高达60%,远高于其他国家,这与日本对胃癌的筛查普及率较高有关。早在1963年,日本就提出了“早期胃癌”的概念,全民科普,提高了大众对胃癌的认识。到了1994年,将胃癌筛查纳入国民癌症筛查计划,政府要求企业每年的常规体检中必须包含胃镜。2013年,日本又提出了根除Hp的计划,将Hp感染的筛查和根除治疗作为国家胃癌预防项目并纳入医保[64-65],使得日本从2013年到2017年,胃癌的死亡人数下降了9.2%。韩国胃癌协会也早在2001年就与国家癌症中心联合发布了国家级的胃癌筛查指南[66],指南规定凡大于40岁的人群都应每2年进行1次内镜筛查或上消化道钡餐检查。正是因为日、韩对胃癌预防的重视,使得这两个国家的早期胃癌检出率分别升高到60%和55%(2005年数据),明显高于中国的15%,因而胃癌死亡率明显降低。
近年来,中国部分地区开展了胃癌筛查的实践和探索,但仍处于小范围的初级阶段,胃癌预防意识仍然不强,医保政策对胃癌早筛的覆盖尚不完善。因此,为了提高中国胃癌早期筛查水平,推荐以下措施:一是加强胃癌的科学普及,提高公众对胃癌的认知,增强患者自我管理和早期筛查的意识;二是寻找更具特异性的胃癌早期筛查指标,提高Hp检出率及根除率;三是完善医保政策,加强国家财政支持,改进和完善胃癌防控策略。
3.3 发掘新靶点,分型治疗:肺癌治疗的启示
随着分子生物学的发展,肿瘤治疗模式发生了变化,未来的肿瘤治疗应该是分子分型指导下的精准治疗。例如,在肺癌领域,根据是否存在驱动基因的突变,将肺癌治疗大致分为驱动基因阳性的治疗和驱动基因阴性的治疗。前者主要采用靶向治疗,后者则以全身化疗和免疫治疗为主。驱动基因指导下的精准靶向治疗成为了肿瘤诊疗的典范。
随着胃癌分子分型和发病机制研究的深入,胃癌治疗可借鉴肺癌,通过某些关键驱动基因将胃癌分为不同亚型,给予个体化的精准治疗。目前已经有HER2阳性、微卫星不稳定性、PD-L1及Claudin18.2等分子标志物被用于指导胃癌的临床用药,但与非小细胞肺癌、乳腺癌等靶向治疗较为成熟的肿瘤相比,仍存在明显的局限性。随着对胃癌现有靶点的探索与整合,以及对罕见靶点的深入挖掘和研究,胃癌靶向、精准治疗将取得更多成果,为胃癌患者的药物选择及方案制订提供更多借鉴,改善其临床结局。
3.4 AI在肿瘤领域前景无限
AI作为一种新兴技术,正在深刻改变各个行业,包括肿瘤领域。首先,辅助诊断是AI在肿瘤领域中的应用之一。由于肿瘤的形态各异,传统的人工判读容易存在主观性和误诊的问题。而AI技术通过学习大量的医学图像和病例数据,能够辅助医师更快速、准确地进行肿瘤的诊断[67]。其次,AI可以根据患者的个体特征和基因信息,提供个体化的治疗方案。例如,通过对患者基因组数据的分析,AI可以预测患者对某种药物的反应,从而帮助医师选择最适合患者的治疗方案。此外,AI有望加快药物筛选和研发。众所周知,蛋白质结构是开发分子靶向药物的基础。过去,一个团队需要花费数年时间才能解析出一个蛋白质的结构。然而,AlphaFold的出现改变了这一进程,其能够快速准确地预测人类蛋白质组的结构,极大地节约了时间和成本[68]。未来,AI有望在疾病预测、手术辅助及个性化健康管理等方面发挥更大的作用。同时,AI还将与互联网、大数据等技术相结合,构建起更完善的医疗服务体系,为患者提供更好的医疗体验。
4 未来展望
21世纪以来,随着腹腔镜及机器人技术的应用及发展,胃癌靶点的发掘及免疫治疗的开展,AI在胃癌领域中的应用,以及基因组学等方面不断取得突破,胃癌诊治取得了长足的进步。下一个10年,我们期待胃癌的发病率继续下降,早期胃癌诊断率得到提升,晚期胃癌患者的中位生存期尽早迈过24个月的门槛,从而使胃癌逐渐成为一种可以控制的“慢性病”。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
许永虎:文献收集和汇总,文章撰写和校对;
徐大志:文章选题构思、结构起草和修改。
[参考文献]
[1]郑荣寿, 张思维, 孙可欣, 等. 2016年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2023, 45(3): 212-220.
ZHENG R S, ZHANG S W, SUN K X, et al. Cancer statistics in China, 2016[J]. Chin J Oncol, 2023, 45(3): 212-220.
[2]DENOIX P. Ongoing investigation in cancer centers[J]. Bull Inst Natl Hyg, 1946, 1: 12-7.
[3]吴怀申, 何雍毅. 恶性肿瘤的TNM分类法[J]. 癌症, 1999(1): 104-105.
WU H S, HE Y Y. TNM classification of malignant tumors[J]. Chin J Cancer, 1999(1): 104-105.
[4]RAMI-PORTA R. Future perspectives on the TNM Staging for lung cancer[J]. Cancers (Basel), 2021, 13(8): 1940.
[5]日本胃癌学会. 胃癌处理规约[M]. 1版. 东京: 金原出版株式会社, 1962.
Japanese Gastric Cancer Association. Gastric cancer management protocol[M]. 1 edition. Tokyo: Kanehara Publishing Co., LTD, 1962.
[6]日本胃癌学会. 胃癌处理规约[M]. 14版. 东京: 金原出版株式会社, 2010.
Japanese Gastric Cancer Association. Gastric cancer management protocol[M]. 14 edition. Tokyo: Kanehara Publishing Co., LTD, 2010.
[7]CUSCHIERI A, WEEDEN S, FIELDING J, et al. Patient survival after D1 and D2 reps for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group[J]. Br J Cancer, 1999, 79(9/10): 1522-1530.
[8]BONENKAMP J J, HERMANS J, SASAKO M, et al. Extended lymph-node disp for gastric cancer[J]. N Engl J Med, 1999, 340(12): 908-914.
[9]SONGUN I, PUTTER H, KRANENBARG E M, et al. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial[J]. Lancet Oncol, 2010, 11(5): 439-449.
[10]SASAKO M, SANO T, YAMAMOTO S, et al. D2 lymphadenectomy alone or with para-aortic nodal disp for gastric cancer[J]. N Engl J Med, 2008, 359(5): 453-462.
[11] MACDONALD J S, SMALLEY S R, BENEDETTI J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction[J]. N Engl J Med, 2001, 345(10): 725-730.
[12] CUNNINGHAM D, ALLUM W H, STENNING S P, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. N Engl J Med, 2006, 355(1): 11-20.
[13]AL-BATRAN S E, HOMANN N, PAULIGK C, et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial[J]. Lancet, 2019, 393(10184): 1948-1957.
[14] KANG Y K, KIM H D, YOOK J H, et al. Neoadjuvant docetaxel, oxaliplatin, and s-1 plus surgery and adjuvant s-1 for resectable advanced gastric cancer: final survival outcomes of the randomized phase 3 PRODIGY trial[J]. J Clin Oncol, 2023, 41(16_suppl): 4067.
[15] ZHANG X T, LIANG H, LI Z Y, et al. Perioperative or postoperative adjuvant oxaliplatin with S-1 versus adjuvant oxaliplatin with capecitabine in patients with locally advanced gastric or gastro-oesophageal junction adenocarcinoma undergoing D2 gastrectomy (RESOLVE): an open-label, superiority and non-inferiority, phase 3 randomised controlled trial[J]. Lancet Oncol, 2021, 22(8): 1081-1092.
[16] IWASAKI Y, TERASHIMA M, MIZUSAWA J, et al. Gastrectomy with or without neoadjuvant S-1 plus cisplatin for type 4 or large type 3 gastric cancer (JCOG0501): an openlabel, phase 3, randomized controlled trial[J]. Gastric Cancer, 2021, 24(2): 492-502.
[17] SAKURAMOTO S, SASAKO M, YAMAGUCHI T, et al. Adjuvant chemotherapy for gastric cancer with S-1, an oral fluoropyrimidine[J]. N Engl J Med, 2007, 357(18): 1810-1820.
[18] SASAKO M, SAKURAMOTO S, KATAI H, et al. Five-year outcomes of a randomized phase Ⅲ trial comparing adjuvant chemotherapy with S-1 versus surgery alone in stage Ⅱ or Ⅲ gastric cancer[J]. J Clin Oncol, 2011, 29(33): 4387-4393.
[19] KAKEJI Y, YOSHIDA K, KODERA Y, et al. Three-year outcomes of a randomized phase Ⅲ trial comparing adjuvant chemotherapy with S-1 plus docetaxel versus S-1 alone in stage Ⅲ gastric cancer: JACCRO GC-07[J]. Gastric Cancer, 2022, 25(1): 188-196.
[20] BANG Y J, KIM Y W, YANG H K, et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open-label, randomised controlled trial[J]. Lancet, 2012, 379(9813): 315-321.
[21] LEE J, LIM D H, KIM S, et al. Phase Ⅲ trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with D2 lymph node disp: the ARTIST trial[J]. J Clin Oncol, 2012, 30(3): 268-273.
[22] PARK S H, LIM D H, SOHN T S, et al. A randomized phase Ⅲ trial comparing adjuvant single-agent S1, S-1 with oxaliplatin, and postoperative chemoradiation with S-1 and oxaliplatin in patients with node-positive gastric cancer after D2 rep: the ARTIST 2 trial [J]. Ann Oncol, 2021, 32(3): 368-374.
[23] KITANO S, ISO Y, MORIYAMA M, et al. Laparoscopy-assisted billroth I gastrectomy[J]. Surg Laparosc Endosc, 1994, 4(2): 146-148.
[24] KIM H H, HAN S U, KIM M C, et al. Effect of laparoscopic distal gastrectomy vs open distal gastrectomy on long term survival among patients with stage Ⅰ gastric cancer: the KLASS-01 randomized clinical trial[J]. JAMA Oncol, 2019, 5(4): 506-513.
[25] KATAI H, MIZUSAWA J, KATAYAMA H, et al. Survival outcomes after laparoscopy-assisted distal gastrectomy versus open distal gastrectomy with nodal disp for clinical stage ⅠA or ⅠB gastric cancer (JCOG0912): a multicentre, noninferiority, phase 3 randomised controlled trial[J]. Lancet Gastroenterol Hepatol, 2020, 5(2): 142-151.
[26] ZENG Y K, YANG Z L, PENG J S, et al. Laparoscopy-assisted versus open distal gastrectomy for early gastric cancer: evidence from randomized and nonrandomized clinical trials[J]. Ann Surg, 2012, 256(1): 39-52.
[27] LIU F L, HUANG C M, XU Z K, et al. Morbidity and mortality of laparoscopic vs open total gastrectomy for clinical stage Ⅰ gastric cancer: the CLASS02 multicenter randomized clinical trial[J]. JAMA Oncol, 2020, 6(10): 1590-1597.
[28] YU J, HUANG C M, SUN Y H, et al. Effect of laparoscopic vs open distal gastrectomy on 3-year disease-free survival in patients with locally advanced gastric cancer: the CLASS-01 randomized clinical trial[J]. JAMA, 2019, 321(20): 1983-1992.
[29] HUANG C M, LIU H, HU Y F, et al. Laparoscopic vs open distal gastrectomy for locally advanced gastric cancer: five-year outcomes from the CLASS-01 randomized clinical trial[J]. JAMA Surg, 2022, 157(1): 9-17.
[30] HYUNG W J, YANG H K, PARK Y K, et al. Long-term outcomes of laparoscopic distal gastrectomy for locally advanced gastric cancer: the KLASS-02-RCT randomized clinical trial[J]. J Clin Oncol, 2020, 38(28): 3304-3313.
[31] ETOH T, OHYAMA T, SAKURAMOTO S, et al. Five-year survival outcomes of laparoscopy-assisted vs open distal gastrectomy for advanced gastric cancer: the JLSSG0901 randomized clinical trial[J]. JAMA Surg, 2023, 158(5): 445-454.
[32]PARK Y M, CHO E, KANG H Y, et al. The effectiveness and safety of endoscopic submucosal disp compared with endoscopic mucosal rep for early gastric cancer: a systematic review and metaanalysis[J]. Surg Endosc, 2011, 25(8): 2666-2677.[33]
FACCIORUSSO A, ANTONINO M, MASO M D, et al. Endoscopic submucosal disp vs endoscopic mucosal rep for early gastric cancer: a meta-analysis[J]. World J Gastrointest Endosc, 2014, 6(11): 555-563.
[34]JAPANESE GASTRIC CANCER ASSOCIATION. Japanese gastric cancer treatment guidelines 2010 (ver. 3)[J]. Gastric Cancer, 2011, 14(2): 113-123.
[35]JAPANESE GASTRIC CANCER ASSOCIATION. Japanese gastric cancer treatment guidelines 2014 (ver. 4)[J]. Gastric Cancer, 2017, 20(1): 1-19.
[36]HASUIKE N, ONO H, BOKU N, et al. A non-randomized confirmatory trial of an expanded indication for endoscopic submucosal disp for intestinal-type gastric cancer (cT1a): the Japan Clinical Oncology Group study (JCOG0607)[J]. Gastric Cancer, 2018, 21(1): 114-123.
[37]JAPANESE GASTRIC CANCER ASSOCIATION. Japanese gastric cancer treatment guidelines 2018 (5th edition)[J]. Gastric Cancer, 2021, 24(1): 1-21.
[38]TAKIZAWA K, ONO H, HASUIKE N, et al. A nonrandomized, single-arm confirmatory trial of expanded endoscopic submucosal disp indication for undifferentiated early gastric cancer: Japan Clinical Oncology Group study (JCOG1009/1010)[J]. Gastric Cancer, 2021, 24(2): 479-491.
[39]ASSOCIATION J G C. Japanese gastric cancer treatment guidelines 2021 (6th edition)[J]. Gastric Cancer, 2023, 26(1): 1-25.
[40]BANG Y J, VAN CUTSEM E, FEYEREISLOVA A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742): 687-697.
[41]HECHT J R, BANG Y J, QIN S K, et al. Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2-positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: TRIO-013/LOGiC: a randomized phase Ⅲ trial[J]. J Clin Oncol, 2016, 34(5): 443-451.
[42]SATOH T, XU R H, CHUNG H C, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN: a randomized, phase Ⅲ study[J]. J Clin Oncol, 2014, 32(19): 2039-2049.
[43]TABERNERO J, HOFF P M, SHEN L, et al. Pertuzumab plus trastuzumab and chemotherapy for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (JACOB): final analysis of a double-blind, randomised, placebo-controlled phase 3 study[J]. Lancet Oncol, 2018, 19(10): 1372-1384.
[44]THUSS-PATIENCE P C, SHAH M A, OHTSU A, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study[J]. Lancet Oncol, 2017, 18(5): 640-653.
[45]SHITARA K, BANG Y J, IWASA S, et al. Trastuzumab deruxtecan in previously treated HER2-positive gastric cancer[J]. N Engl J Med, 2020, 382(25): 2419-2430.
[46]VAN CUTSEM E, BARTOLOMEO M D, SMYTH E, et al. Trastuzumab deruxtecan in patients in the USA and Europe with HER2-positive advanced gastric or gastroesophageal junction cancer with disease progression on or after a trastuzumab-containing regimen (DESTINY-Gastric02): primary and updated analyses from a single-arm, phase 2 study[J]. Lancet Oncol, 2023, 24(7): 744-756.
[47]PENG Z, LIU T S, WEI J, et al. A phase Ⅱ study of efficacy and safety of RC48-ADC in patients with locally advanced or metastatic HER2-overexpressing gastric or gastroesophageal junction cancers[J]. J Clin Oncol, 2020, 38(15_suppl): 4560.
[48]SHITARA K, LORDICK F, BANG Y J, et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet, 2023, 401(10389): 1655-1668.
[49]SHAH M A, SHITARA K, AJANI J A, et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial[J]. Nat Med, 2023, 29(8): 2133-2141.
[50]KANG Y K, BOKU N, SATOH T, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2017, 390(10111): 2461-2471.
[51]JANJIGIAN Y Y, SHITARA K, MOEHLER M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial[J]. Lancet, 2021, 398(10294): 27-40.
[52]SHITARA K, ÖZGÜROĞLU M, BANG Y J, et al. Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2018, 392(10142): 123-133.
[53]BOKU N, RYU M H, KATO K, et al. Safety and efficacy of nivolumab in combination with S-1/capecitabine plus oxaliplatin in patients with previously untreated, unresectable, advanced, or recurrent gastric/gastroesophageal junction cancer: interim results of a randomized, phase Ⅱ trial (ATTRACTION-4)[J]. Ann Oncol, 2019, 30(2): 250-258.
[54] XU J, JIANG H, PAN Y, et al. LBA53 Sintilimab plus chemotherapy (chemo) versus chemo as first-line treatment for advanced gastric or gastroesophageal junction (G/GEJ) adenocarcinoma (ORIENT-16): First results of a randomized, double-blind, phase Ⅲ study[J]. Ann Oncol, 2021, 32: S1331.
[55] MOEHLER M H, KATO K, ARKENAU H T, et al. Rationale 305: Phase 3 study of tislelizumab plus chemotherapy vs placebo plus chemotherapy as first-line treatment (1L) of advanced gastric or gastroesophageal junction adenocarcinoma (GC/GEJC)[J]. J Clin Oncol, 2023, 41(4_suppl): 286.
[56] RHA S Y, OH D Y, YAÑEZ P, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for HER2-negative advanced gastric cancer (KEYNOTE-859): a multicentre, randomised, double-blind, phase 3 trial[J]. Lancet Oncol, 2023, 24(11): 1181-1195.
[57] JANJIGIAN Y Y, KAWAZOE A, YANEZ P E, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2+ metastatic gastric or gastroesophageal junction (G/GEJ) cancer: initial findings of the global phase 3 KEYNOTE-811 study[J]. J Clin Oncol, 2021, 39(15_suppl): 4013.
[58] JANJIGIAN Y Y, KAWAZOE A, BAI Y, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2+ metastatic gastric or gastroesophageal junction (mG/GEJ) adenocarcinoma: survival results from the phase Ⅲ, randomized, double-blind, placebo-controlled KEYNOTE-811 study[J]. Ann Oncol, 2023, 34: S851-S852.
[59] YUAN S Q, NIE R C, JIN Y, et al. Perioperative PD-1 antibody toripalimab plus SOX or XELOX chemotherapy versus SOX or XELOX alone for locally advanced gastric or gastro-oesophageal junction cancer: results from a prospective, randomized, openlabel, phase Ⅱ trial[J]. J Clin Oncol, 2023, 41(16_suppl): 4001.
[60] DING X W, WANG X J, LI B, et al. PERSIST: A multicenter, randomized phase Ⅱ trial of perioperative oxaliplatin and S-1 (SOX) with or without sintilimab in resectable locally advanced gastric/gastroesophageal junction cancer (GC/GEJC)[J]. J Clin Oncol, 2023, 41(4_suppl): 364.
[61] AL-BATRAN S E, LORENZEN S, THUSS-PATIENCE P C, et al. Surgical and pathological outcome, and pathological regression, in patients receiving perioperative atezolizumab in combination with FLOT chemotherapy versus FLOT alone for resectable esophagogastric adenocarcinoma: interim results from DANTE, a randomized, multicenter, phase Ⅱb trial of the FLOT-AIO German Gastric Cancer Group and Swiss SAKK[J]. J Clin Oncol, 2022, 40(16_suppl): 4003.
[62] THRIFT A P, WENKER T N, EL-SERAG H B. Global burden of gastric cancer: epidemiological trends, risk factors, screening and prevention[J]. Nat Rev Clin Oncol, 2023, 20(5): 338-349.
[63] CORDLE F. The use of epidemiology, scientific data, and regulatory authority to determine risk factors in cancers of some organs of the digestive system. 5. Stomach cancer[J]. Regul Toxicol Pharmacol, 1986, 6(2): 171-180.
[64] ASAKA M. A new approach for elimination of gastric cancer deaths in Japan[J]. Int J Cancer, 2013, 132(6): 1272-1276.
[65] ASAKA M, KATO M, SAKAMOTO N. Roadmap to eliminate gastric cancer with Helicobacter pylori eradication and consecutive surveillance in Japan[J]. J Gastroenterol, 2014, 49(1): 1-8.
[66] CHOI K S, SUH M. Screening for gastric cancer: the usefulness of endoscopy[J]. Clin Endosc, 2014, 47(6): 490-496.
[67] CHEN Z H, LIN L, WU C F, et al. Artificial intelligence for assisting cancer diagnosis and treatment in the era of precision medicine[J]. Cancer Commun, 2021, 41(11): 1100-1115.
[68] JUMPER J, EVANS R, PRITZEL A, et al. Highly accurate protein structure prediction with AlphaFold[J]. Nature, 2021, 596(7873): 583-589.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#胃癌# #靶向治疗# #免疫治疗# #D2根治术# #微创治疗# #肿瘤分期# #围手术期治疗#
11