Int J Biol Sci:代谢在乳腺癌细胞和肿瘤相关巨噬细胞相互串扰中的作用
2024-03-03 Tracy、江舜尧 微科盟 发表于威斯康星
乳腺癌是影响全世界妇女最常见的癌症,也是导致女性死亡最常见的癌症类型。研究乳腺癌的代谢机制可能有助于开发新的免疫治疗方案。代谢重编程可以赋予乳腺癌细胞(BCCs)在肿瘤微环境(TME)和乳腺癌代谢改变
乳腺癌是影响全世界妇女最常见的癌症,也是导致女性死亡最常见的癌症类型。研究乳腺癌的代谢机制可能有助于开发新的免疫治疗方案。代谢重编程可以赋予乳腺癌细胞(BCCs)在肿瘤微环境(TME)和乳腺癌代谢改变中的生存优势,相应的代谢副产物可以影响肿瘤相关巨噬细胞(TAMs)的功能。此外,TAMs会根据TME中存在的信号进行代谢重编程,从而影响其功能和乳腺癌进展。在这里,我们从葡萄糖、脂质、氨基酸、铁和腺苷代谢等方面综述了BCCs和TAMs之间的代谢互作。针对癌症BCCs或TAMs代谢相关过程的研究也为对抗这种疾病的新治疗方法提供了宝贵的启示。这篇综述为结合免疫和代谢的靶向抗癌治疗提供了新的视角。
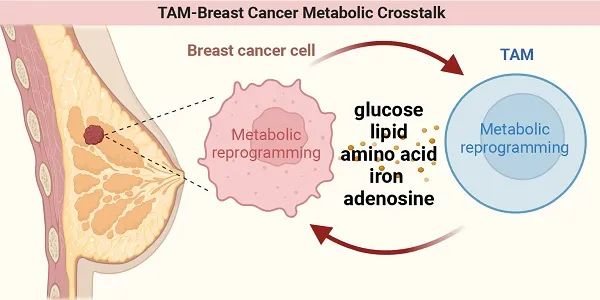
根据最新的统计数据,尽管相关治疗取得了进展,但乳腺癌仍然是全球最常见的癌症,20-59岁的晚期乳腺癌患者仍然面临着巨大的死亡风险。2022年,美国女性报告了约287,850例浸润性乳腺癌新发病例和51,400例导管原位癌新发病例,女性乳腺癌的发病率继续以每年约0.5%的速度增长。目前,乳腺癌已取代肺癌成为全球发病率最高的癌症,全球登记病例约为200万例,预计到2040年这一数字将增加到300万以上。
乳腺癌具有高度异质性,肿瘤微环境(tumor microenvironment, TME)促进了这种异质性。此外,TME在乳腺癌恶性进展的过程中发挥着关键作用。因此,以TME为靶点的免疫治疗对于乳腺癌患者的个体化治疗和改善预后具有非常高的潜力。据估计,TME占乳腺癌质量的50%,因为它是一个由肿瘤细胞、间质和浸润免疫细胞组成的生态系统。乳腺癌微环境成分协同抑制抗肿瘤免疫,促进乳腺癌的进展和转移。在TME的各种细胞中,肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)是起源于循环单核细胞的主要细胞。巨噬细胞的功能受TME的影响,表现为表型的异质性和可塑性。巨噬细胞的功能被定义为经典激活的(M1)抗肿瘤或替代激活的(M2)促肿瘤。在乳腺癌生长过程中,TAMs与M2型巨噬细胞一样,促进肿瘤生长、血管生成、转移,并逃避免疫监视。将TAMs从促肿瘤的M2型转化为抗肿瘤的M1型是乳腺癌免疫治疗的主要目标之一。许多研究强调了TAMs在乳腺癌预后和治疗中的重要性,并呼吁更好地了解TAMs与乳腺癌细胞(BCCs)之间的相互作用。
癌症代谢重编程是细胞内应激与癌症行为之间的桥梁,是癌症恶性进展的典型标志。它赋予肿瘤细胞生长优势,影响免疫细胞分化和功能,从而促进肿瘤进展。同样,TME中TAMs的代谢重编程可通过不同途径影响其功能。既往研究表明,在乳腺癌中,肿瘤细胞和TAMs均发生代谢变化,并可参与两者之间的交流,以协调癌症进展的复杂过程。因此,从免疫和代谢的角度推进乳腺癌治疗:深入了解肿瘤细胞和TAMs的代谢重编程,以及它们之间的代谢交流,有可能在乳腺癌研究中取得关键突破,并为创新的治疗铺平道路。
本文就BCCs和TAMs之间的代谢交流在乳腺癌生物学进展中的重要性进行综述。第一部分重点描述了进行代谢重编程的乳腺癌细胞和TAMs之间的交流,强调了进行代谢重编程的乳腺癌细胞影响TAMs的极化,从而在与TAMs的交流中影响癌症进展。然后,我们总结了进行代谢重编程的TAMs和BCCs之间的作用。第二部分概述了目前靶向TAMs和BCCs的代谢药物。这些药物的总结见表1。本综述有助于更好地理解代谢如何调控乳腺癌的进展,并为基于联合免疫方法的乳腺癌新型靶向代谢药物的精准设计提供坚实的背景。
2. 代谢
肿瘤细胞通过适当调节自身代谢来维持高增殖率,适应在不利的微环境中生存。因此,发生代谢重编程的BCCs与TAMs之间的交互作用与乳腺癌进展密切相关。
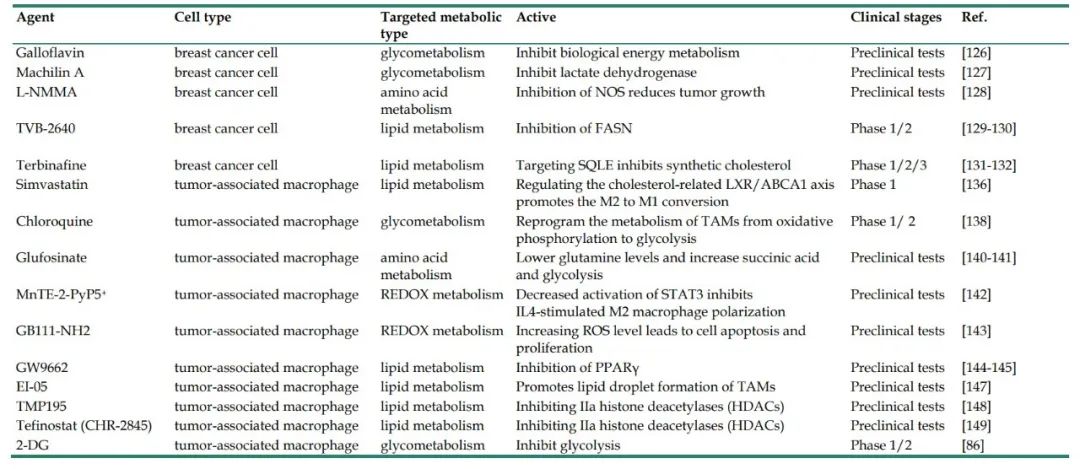
癌细胞通过不同的代谢途径驱动癌症进展。有氧糖酵解与乳腺癌进展密切相关。"有氧糖酵解"状态或Warburg效应是乳腺癌中典型的葡萄糖代谢重编程。具体来说,这是指癌细胞即使在有氧条件下也优先考虑糖酵解,从而迅速增加生物合成,抑制凋亡,提高其生存率的现象。癌细胞自我激活的代谢重编程支持其持续增殖和恶性进展。乳腺癌细胞糖酵解活性增强与促肿瘤免疫相关。大量证据表明,浸润在TME中的免疫细胞可以与肿瘤细胞相互作用,影响肿瘤进展和现有抗癌疗法的疗效。以下部分描述了接受糖酵解的BCCs和TAMs之间的代谢交流(图1)。
具有免疫抑制作用的TME阻断了肿瘤的免疫治疗,对TME的代谢调节是提高免疫治疗的有效策略。BCCs中的有氧糖酵解促进了肿瘤细胞的侵袭性,并启动了通过调节炎症性TME促进肿瘤进展的正调控回路。肿瘤细胞源性乳酸作为有氧糖酵解的副产物和癌细胞增殖的"告密者",在促进肿瘤生长中发挥重要的信号作用。癌细胞因供氧不足和葡萄糖代谢增加而释放乳酸,形成酸性环境。之前的研究表明G蛋白偶联受体132 (GPR132)是巨噬细胞的一种膜受体,它可以感知和响应基底细胞癌中的乳酸信号。此外,乳酸激活巨噬细胞GPR132促进M2样表型,进而通过乳酸-GPR132轴促进癌细胞黏附、迁移和侵袭。在乳腺癌中,肿瘤细胞发生糖酵解,导致其TME的pH值降低,从而激活TAMs中G蛋白偶联受体(GPCRs)介导的信号通路,促使TAMs向M2表型极化。此外,在酸性肿瘤环境中,转录因子ZEB1的异位表达产生的乳酸通过刺激PKA/CREB信号通路诱导TAMs向M2型极化,从而促进" Warburg效应",促进体外和体内乳腺癌细胞的增殖、迁移和化学抗性。BCCs分泌的乳酸信号通路中的主要信号分子ERK/STAT3的激活也可促进BCCs向M2型极化。有研究表明,可以通过抑制ERK/STAT3信号来消除乳酸诱导的M2型巨噬细胞极化,从而抑制肿瘤生长和血管生成。BCCs来源的乳酸也可以通过激活巨噬细胞中的Notch信号和增加TAMs中CC趋化因子配体5 (CCL5)的分泌将TAMs转化为M2样表型。乳酸刺激的TAMs产生大量CCL5,促进BCCs的糖酵解,形成正代谢反馈回路。因此,在未来的乳腺癌治疗中,干扰代谢循环是一个重要的治疗方向。
通常,癌症细胞具有比正常细胞更高水平的糖酵解酶和糖酵解转运蛋白,这相应地产生高乳酸水平并促进恶性进展。例如,最近的研究表明,BCCs中钠/葡萄糖转运体(SGLT1)的高表达介导了高水平的糖酵解。由此产生的乳酸代谢产物可以通过HIF1α/STAT3途径调节TAMs向M2的极化,促进雌激素受体(ER)阳性BCCs对三苯氧胺的耐药性。类似地,GLUT3在BCCs中的过表达可以通过乳酸介导的CXCL8促进促炎微环境的形成,从而诱导TAMs的激活并增强BCCs的侵袭能力。总之,乳酸是肿瘤免疫反应中的关键代谢参与者,经过糖酵解的BCCs分泌过多的乳酸会促进TAMs极化,从而加剧肿瘤免疫逃逸。这表明,这种方法可以作为揭示乳腺癌治疗新策略的突破。
肿瘤细胞的代谢重编程也可被TME中的免疫细胞调节。越来越多的研究表明,TME中的TAMs可通过不同方式影响肿瘤细胞的有氧糖酵解,从而影响乳腺癌的发生发展。最近的研究表明,HIF-1α-稳定长非编码RNA(HISLA)被包裹在TAMs分泌的细胞外囊泡(EVs)中,阻止PHD2与HIF-1 α的相互作用,抑制HIF-1 α的羟基化和降解,从而增强BCCs的有氧糖酵解。此外,肿瘤细胞糖酵解分泌的乳酸对巨噬细胞的HISLA具有上调作用,可在肿瘤细胞和TAMs之间形成正反馈环路。因此,通过阻断TAMs中HISIA的表达,可以有效抑制乳腺癌的糖酵解和化疗耐药。此外,TAMs分泌的TGF-β与BCCs表面的受体结合,抑制转录因子STAT1的丰度,从而降低肿瘤细胞中代谢酶琥珀酸脱氢酶的丰度。在这种情况下,肿瘤细胞积累的琥珀酸增强了HIF-1α的稳定性,BCCs的代谢被重新编程为糖酵解状态。有趣的是,巨噬细胞来源的外泌体miR-503-3p的上调也可以促进葡萄糖摄取和BCCs的恶性行为,并抑制BCCs的耗氧率和ATP值。相反,外分泌miR-503-3p的减少可以通过上调DACT2和失活Wnt/β-catenin信号通路来抑制BCCs的糖酵解并促进线粒体的氧化磷酸化,为癌症治疗提供新的有效策略。总之,TAM可以通过控制BCC中的葡萄糖代谢来促进癌症的进展。它们的存在可能部分解释了抗糖酵解疗法的有限疗效,并为发现治疗癌症的新靶点开辟了新途径。
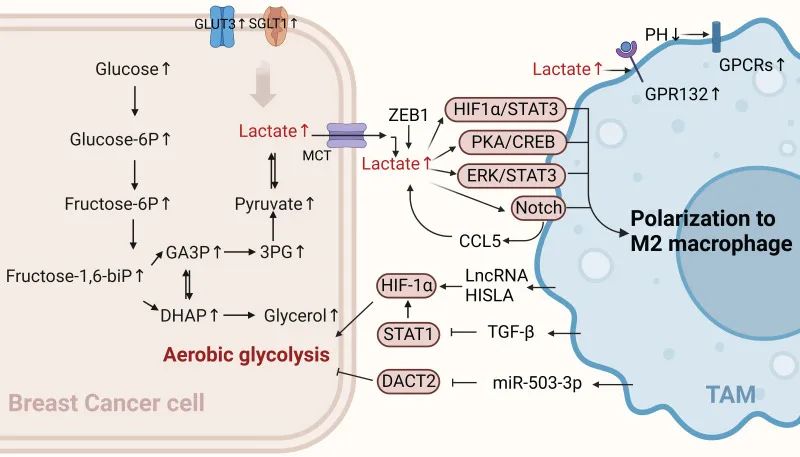
脂质是一组与代谢性疾病密切相关的物质。这些分子包括磷脂、甘油三酯、胆固醇、胆固醇酯和鞘脂。在肿瘤细胞生长过程中,除了葡萄糖代谢和能量供应外,细胞还需要大量的脂质来进行脂肪合成、生物膜的构建和功能的维持。在BCCs中,肿瘤细胞的脂质生成必须与其他代谢需求相平衡。常见的脂质相关代谢网络包括脂肪酸代谢通路和网络、花生四烯酸代谢通路和网络、胆固醇和鞘脂代谢通路和网络。近年来,大量研究表明,肿瘤细胞与肿瘤浸润免疫细胞之间的脂质代谢,以及脂质代谢物的沟通和代谢变化,在调节免疫抑制中起着至关重要的作用 (图2a)。
肿瘤细胞脂质代谢的酶或相关产物可使巨噬细胞向M2型极化,促进乳腺癌的发生发展。这些数据的分析表明,脂肪酸(FA)生物合成是乳腺癌早期阶段最重要的过程,是脂肪酸(FA)生物合成代谢的过程。据报道,在浸润性乳腺癌中,饱和FAs水平增加,与膜流动性降低相关。虽然肿瘤细胞中脂肪酸合酶(FASN)水平的增加导致向TME分泌的多不饱和FAs增加,但TAMs通过CD36摄取这些多不饱和FAs来增加其脂质水平。此外,增强的脂质积累促进了TAMs的激活和极化。
前列腺素E2(Prostaglandin E2, PEG2)是COX2产生的花生四烯酸的代谢产物,大量研究表明来源于肿瘤细胞的PGE2可以使TAMs向M2型极化。鞘脂代谢对BCCs的脂质代谢至关重要。鞘磷脂合成酶2 (Sphingolipid synthase 2, SMS2)是神经鞘脂合成的关键酶,对质膜的完整性和功能起着至关重要的作用。研究人员发现三阴性乳腺癌(TNBC)细胞的条件培养基有效地刺激骨髓来源的巨噬细胞(BMDMs)向M2型巨噬细胞极化。SMS2抑制剂显著抑制了这一过程,提示SMS2的高表达与M2极化巨噬细胞的高密度浸润相关。此外,肿瘤凋亡衍生鞘脂1-磷酸鞘氨醇(S1P)通过促进血管生成参与肿瘤进展,它也促进了巨噬细胞向TAM样表型极化。同样,肿瘤细胞来源的脂质通过诱导巨噬细胞内的内质网应激反应,导致STAT3活化和IRE1剪接介导的XBP1产生,从而使巨噬细胞向肿瘤前表型极化,这两者均起协同作用,使巨噬细胞向肿瘤前表型极化。因此,使用相关脂代谢抑制剂抑制肿瘤细胞的脂代谢进展,诱导巨噬细胞向抗肿瘤表型极化是重要的治疗策略。
图2 BCCs的其他代谢与TAMs相互作用
(a)脂质代谢。脂肪酸水平,包括在BCCs中通过FASN增加的多不饱和脂肪酸,通过CD36影响TAMs,并促进TAMs向M2极化。来自BCCs的花生四烯酸衍生的PGE2也使TAMs向M2型极化。来源于BCCs的脂质在巨噬细胞中诱导内质网应激反应,通过IRE1剪接激活STAT3和XBP1,促进TAMs的肿瘤前表型。肿瘤凋亡衍生鞘脂S1P促进巨噬细胞TAMs样极化。(b)氨基酸代谢。谷氨酰胺转运蛋白(如SLC1A5、SLC7A5和SLC3A2)在BCCs中的过表达直接影响谷氨酰胺代谢,产生特定亚型的炎症浸润,并影响TAMs向致癌表型方向发展。(c)铁代谢。TAMs分泌的TGF-β1抑制BCCs的铁死亡,增强细胞增殖、转移和顺铂耐药。TAMs影响的BCCs通过激活JAK2/STAT3轴诱导TAMs分泌更多TGF-β1,形成反馈回路。
2.1.3 BCCs的氨基酸代谢
越来越多的证据表明,氨基酸代谢在TME中的癌细胞生长、信号传导、氧化和免疫抑制中活跃,其中15种氨基酸在乳腺癌样本中显著升高,可作为乳腺癌早期诊断的标志物。精氨酸、谷氨酰胺和色氨酸在BCCs和TAMs中发挥辅助作用(图2b)。
2.1.3.1 氨基酸代谢影响TAM的功能和极化
谷氨酰胺是血液中最丰富的氨基酸,与TME中的免疫细胞相比,癌细胞优先摄取谷氨酰胺。之前的一项研究表明,谷氨酰胺消耗增加M1型,减少M2型表达和TAM功能。JHU083是一种靶向肿瘤细胞的谷氨酰胺拮抗剂,可促进肿瘤抑制巨噬细胞的极化,这提示靶向谷氨酰胺代谢可以重编程肿瘤细胞代谢,增强TAMs的抗肿瘤表型,从而抑制肿瘤进展。既往研究也报道了肿瘤细胞中谷氨酰胺转运蛋白的过表达,如SLC1A5、SLC7A5和SLC3A2,可直接影响谷氨酰胺代谢,导致不同亚型炎症浸润的产生。BCCs对谷氨酰胺摄取的增加可能与特定亚型的存在有关,如CD68+巨噬细胞。
铁代谢紊乱与癌症密切相关,巨噬细胞在铁代谢中起着至关重要的作用。研究表明,TAMs在BCCs中分泌调节铁代谢的因子。如TAMs分泌的TGF-β1通过调控TNBCs中GGT1/GSH/Gpx4轴调控HIF,抑制铁死亡,从而增强TNBCs的增殖、转移和顺铂耐药性。受TAMs影响的TNBCs可以激活JAK2/STAT3轴,诱导TAMs分泌更多的TGF-β1,形成一个反馈回路。因此BCCs与TAMs之间的交流可以保证TNBCs中HIF的持续活跃状态。当HIF被耗尽时,TNBCs的增殖和侵袭能力可通过铁死亡抑制剂Liproxstatin-1恢复(图2c)。
TAMs是TME的重要组成部分。为了在恶劣的肿瘤环境中生存,TAMs还必须经历代谢适应。这些代谢适应导致人的功能表型发生变化,影响乳腺癌谱的“促进”和“抑制”。除TAMs进行代谢适应外,BCCs产生的一些产物可影响TAMs的代谢和癌症进展。
2.2.1 TAMs的脂质代谢
TAMs可通过重编程脂质代谢影响癌症进展,这也涉及FAs、花生四烯酸(AA)和胆固醇(CHOL)通路。与肿瘤细胞不同,TAMs的脂质代谢可产生促肿瘤和抗肿瘤双重作用。刺激、产物或分泌因子对巨噬细胞的脂质代谢进行重编程是TAMs的一个重要特征,可影响TME中TAMs的调节,从而影响癌症进展(图3)。
研究表明,脂质积累与TAMs的促肿瘤功能密切相关。据报道,胱天蛋白酶-1可以切割过氧化物酶体增殖物激活受体γ(PPARγ)。PPARγ可转运至线粒体并与中链酰基辅酶A脱氢酶(MCAD)相互作用。这会抑制脂肪酸氧化,导致TAMs中的脂滴积聚,并促进其分化为促肿瘤表型。脂肪酸结合蛋白(FABP)是代谢过程的中心调节因子。不同形式的FABP对癌症的生长和转移有不同的影响。表皮FABP(E-FABP)在巨噬细胞中高度表达,它可以预防乳腺癌的发展,肿瘤间质中的E-FABP通过上调脂滴的形成来促进IFN-β。IFN-β信号传导可进一步增强肿瘤杀伤效应细胞向肿瘤间质的募集,产生抗肿瘤活性。相反,A-FABP是一种新的肿瘤促进因子。A-FABP在小鼠和人类癌症细胞的TAMs中高表达,通过调节NF-κB/miR-29b途径增强IL6/STAT3信号传导,从而促进癌症的生长和转移。PGE2-COX2轴在TAMs的脂质代谢中发挥重要作用。TAMs中的COX-2通过触发基质金属蛋白酶-9 (MMP-9)的表达促进BCCs的上皮-间充质转化。此外,TAMs通过PI3K/Akt/mTOR通路增加COX-2的表达,从而增强乳腺癌的内分泌耐药。最近的研究表明,MPGES -1衍生的PGE2抑制TAMs中CD80的表达,从而抑制乳腺癌的抗肿瘤免疫反应。COX2/mPGES1/PGE2通路调节TAMs中PDL1的表达,PGE2抑制剂可减少肿瘤部位的免疫抑制。研究发现27-HC合酶CYP27A1在TAMs中CHOL水平高表达。TAMs分泌的CHOL代谢物27-HC除了促进BCCs增殖外,还刺激TAMs分泌趋化因子,导致CCR2+和CCR5+单核细胞向肿瘤部位迁移并极化为M2型巨噬细胞。这些相对独立的过程最终导致了乳腺癌的发生。此外,巨噬细胞的表型是由代谢重编程的细胞信号因子介导的。最近的研究发现,当Hedgehog (HH)信号在M2巨噬细胞中被抑制时,代谢能量和生物能从氧化磷酸化和脂肪酸氧化转移到糖酵解。此外,还可损害M2巨噬细胞的免疫抑制功能,从而抑制M2型表型,促进M1型表型,抑制肿瘤生长。
证据表明TME中的BCCs在脂质代谢方面与TAMs存在“矛盾”,并且在肿瘤进展过程中,它们具有相反的脂质代谢重编程。白三烯是一组衍生自AA的介质,5-脂氧合酶(5-LO)是白三烯产生的关键酶。在TAMs中,凋亡癌细胞被识别后,5-LO通过MerTK(一种酪氨酸激酶受体)下调,并且通过c-Myb.5-LO表达缺陷激活其转录抑制导致TAMs招募T细胞和发挥抗肿瘤作用的能力降低。因此,MerTK在TME中的抑制可能增强治疗乳腺癌症的抗肿瘤免疫反应。然而,在BCC中,5-LO及其产物的表达增强促进了癌症细胞的细胞增殖并抑制了细胞凋亡。在肿瘤细胞中,单酰基甘油脂肪酶(MGLL)通过释放特定的脂肪酸来促进生长、增殖、转移和侵袭。然而,MGLL缺乏通过内源性2-AG-CB2大麻素信号将巨噬细胞转变为促肿瘤表型。
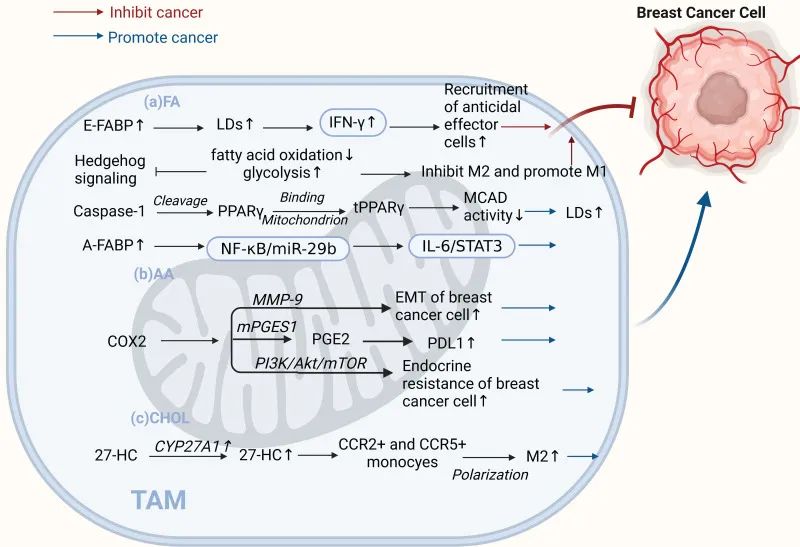
图3 TAMs脂质代谢控制乳腺癌“促进”和“抑制”
(a)脂肪酸。肿瘤间质中的E-FABP促进IFN-β,增强肿瘤杀伤效应细胞的募集和抗肿瘤活性。M2巨噬细胞中被抑制的HH信号将代谢从氧化磷酸化转变为糖酵解,抑制M2表型并促进M1表型,抑制肿瘤生长。Caspase-1激活PPARγ,抑制脂肪酸氧化,导致TAMs中脂滴积聚,并促进其分化为促肿瘤表型。TAMs中的高A-FABP表达增强了IL6/STAT3信号传导,促进了乳腺癌的发展。(b)花生四烯酸。TAMs中的COX-2促进癌症细胞的上皮-间质转化和内分泌抵抗。PGE2通过COX2/mPGES1/PGE2途径调节TAM中PDL1的表达,促进癌症的生长和转移。(c)胆固醇。TAMs中CYP27A1过表达分泌的胆固醇代谢产物27-HC将CCR2+和CCR5+单核细胞极化为M2型巨噬细胞。
结合既往研究发现,通过靶向酶、受体或生物活性脂质,干扰脂质介导的间充质细胞与肿瘤细胞或TAMs之间的交流,可抑制TAMs在脂质代谢中的促肿瘤功能,诱导肿瘤消退,抑制肿瘤转移。在不同细胞中实施脂质代谢干预可产生不同的效果。因此,迫切需要探索新的方法来更精确地靶向TAMs与微环境中的肿瘤细胞或其他免疫细胞之间的代谢通路。有针对性地开发相关靶向抑制剂和药物,将有助于研究者更好地理解代谢重编程在肿瘤治疗中的作用。
2.2.2 TAMs的葡萄糖代谢
研究表明,TAM中葡萄糖代谢模式的改变可导致免疫抑制功能,并最终促进肿瘤生长和转移(图4a)。巨噬细胞在不同极化状态下的代谢模式不同。因此,它们对肿瘤的发生、发展、血管生成和转移有不同的影响。通常,M1 TAM的主要代谢模式是有氧糖酵解,其中戊糖磷酸途径(PPP)也随着更多的NADPH而增强。M2 TAM更依赖于高水平的氧化磷酸化,PPP受到限制,NADPH的主要来源减少,可以产生IL-10和血管内皮生长因子(VEGF)以促进肿瘤生长,血管生成和转移。此外,不同极化状态的巨噬细胞通过调节CARKL来调节PPP。M1型巨噬细胞可以抑制CARKL的表达,增加PPP和耗氧率(OCR)的增加。
M2型巨噬细胞具有较高水平的CARKL表达和降低的PPP,随后限制了糖酵解过程。参与巨噬细胞葡萄糖代谢的关键调节酶在癌症中也起着至关重要的作用。研究人员发现,来自小鼠乳腺肿瘤模型和乳腺癌患者的TAM中关键的糖酵解酶己糖激酶2、下游磷酸果糖激酶和烯醇化酶1显着增加。此外,丙酮酸脱氢酶1(PDK1)可以调节巨噬细胞极化。PDK1敲低可减少M1巨噬细胞的有氧糖酵解,增强M2巨噬细胞的线粒体呼吸。总之,葡萄糖代谢的两个分支调节巨噬细胞的差异活化,从而影响癌症在促进和抑制方向上的进展。
TAM还可以根据氧的可用性和恶性组织的不同部分调整其细胞内代谢以适应适当的极化。研究表明,肿瘤缺氧区域的TAM可以产生促进血管生成和侵袭的表型。此外,缺氧可以抑制TAM的葡萄糖摄取,从而增加TME中的葡萄糖含量,进一步促进肿瘤细胞的葡萄糖摄取。在低氧条件下降低TAMs的糖酵解活性有利于乳腺癌的生长和转移。
此外,肿瘤衍生产物或相关信号可影响巨噬细胞中的糖酵解,从而促进癌症。先前的研究表明,肿瘤细胞可以释放细胞因子,如CSF1、IL-34和VEGFA,它们可以下调TAMs的糖酵解水平,诱导肿瘤极化为M2。此外,在乳腺癌中,肿瘤衍生的miR-375可用作巨噬细胞代谢的新型调节剂;它可以通过抑制乳酸脱氢酶来增加TAM的有氧糖酵解,而TAM增强的有氧糖酵解可以使BCC抗凋亡。最近的研究还发现,异常激活的HH信号通路调节TAM中的葡萄糖代谢,支持OXPHOS促进M2表型。因此,抑制HH信号通路的优点是将TME重塑为免疫激活状态,HH信号可以协调巨噬细胞的代谢变化,从而使免疫抑制的M2极化状态成为可能。据报道,由BCC分泌的糖蛋白Slit2通过调节巨噬细胞中的糖酵解来促进抗肿瘤表型的极化。这是第一项表明乳腺癌的生长和转移可以通过调节巨噬细胞的代谢活性来抑制,从而增强抗肿瘤免疫力的研究。
总之,TAM可以根据不同的信号或相互作用动态调整其代谢模式,并根据不同的代谢模式维持相应的极化表型。TAM中的代谢通量和代谢干预可能进一步改善肿瘤免疫治疗;然而,体内TAM代谢的选择性靶向仍然是一个持续的挑战。
2.2.3 TAMs的氨基酸代谢
INOS/ARG轴是巨噬细胞免疫代谢的调节中心。精氨酸代谢对于TAM和BCC之间的串扰很重要。在精氨酸代谢过程中,肿瘤细胞倾向于从NO合成途径转变为多胺合成途径,以满足其生长和增殖需求。在TAM中,多胺促进M2型巨噬细胞的活性,NO促进M1型巨噬细胞的活性。INOS催化L-精氨酸产生NO,促肿瘤巨噬细胞通过改变NO产生以减少INOS表达来促进癌症进展。因此,调整精氨酸代谢可以提高抗肿瘤免疫力。研究表明,Sepiapterin是一氧化氮合酶辅因子四氢生物蝶呤(BH4)的内源性生物合成前体,可逆转NO与多胺的比例,使BCC和TAM中的精氨酸代谢正常化,并抑制乳腺肿瘤细胞的生长。
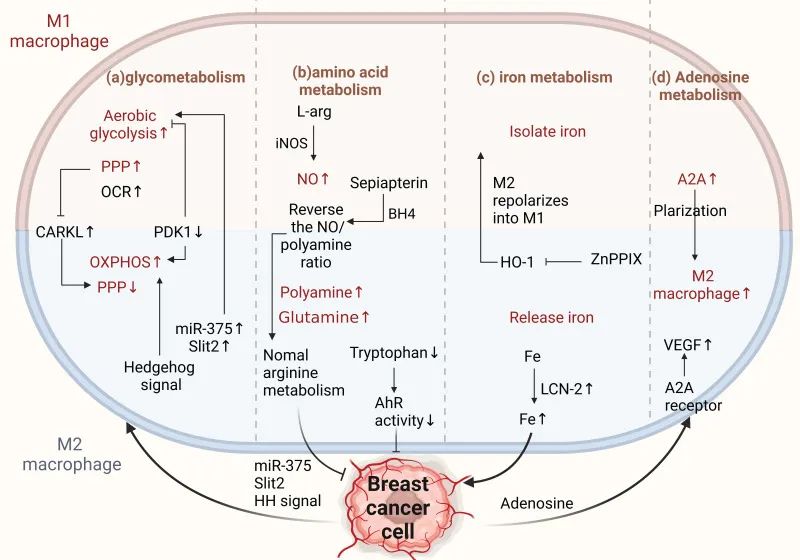
图4 TAM的代谢影响M2转化
(a)葡萄糖代谢。M1 TAM通过有氧糖酵解代谢,增强NADPH的PPP。M2 TAM更依赖于氧化磷酸化,降低PPP和NADPH,促进癌症进展。CARKL调控PPP;来自BCC的miR-375和Slit2促进巨噬细胞中的糖酵解,增加抗肿瘤表型。异常激活的HH信号传导支持OXPHOS促进M2表型。(b)氨基酸代谢。BCC在精氨酸代谢中从NO转变为多胺合成,影响TAM活性。Sepiapterin使精氨酸代谢正常化,抑制癌症进展。TAM上的色氨酸代谢物受体增强抗肿瘤免疫力。(c)铁代谢。M1 TAM螯合铁,M2 TAM释放铁。znPPIX将M2重新极化为M1型。TAM衍生的LCN-2将铁转运至BCC,促进乳腺癌的发展。(d)腺苷代谢。TAM中ADA2活性的增加诱导了促肿瘤M2表型。来自BCC的腺苷通过A2A受体促进血管生成并刺激巨噬细胞中VEGF的产生。
谷氨酰胺是巨噬细胞的重要能量来源,对其生理功能至关重要。研究表明,药理学谷氨酰胺合成酶抑制剂将M2型巨噬细胞极化为M1型。当巨噬细胞中的谷氨酰胺合成受到抑制时,它们诱导T细胞募集的能力增强,并且它们促进癌细胞运动的能力减弱,这表明巨噬细胞中谷氨酰胺水平的增加与M2型极化有关,靶向谷氨酰胺合成酶是治疗癌症的潜在策略。此外,TAM上的色氨酸代谢物受体可以通过去除膳食色氨酸来降低TAM的芳香烃受体活性(AhR),从而增强抗肿瘤免疫力。在开发针对肿瘤细胞和TAM的靶向治疗策略方面,靶向氨基酸代谢已被证明可以推动乳腺癌相关疗法的发展。然而,目前最大的问题在于缺乏关于氨基酸代谢机制的报道(图4b)。
2.2.4 TAMs的铁代谢
肿瘤细胞必须表达高水平的铁蛋白才能满足其铁需求。铁蛋白通常在肿瘤基质中表达,巨噬细胞是肿瘤基质的主要成分。不同的巨噬细胞表型在铁释放中发挥不同的功能作用。M1型巨噬细胞在炎症条件下分离铁,而M2型巨噬细胞更喜欢释放铁。干扰铁螯合的肿瘤表型可以在一定程度上抑制乳腺癌的生长和转移。众所周知,血红素加氧酶(HO-1)是铁再利用的重要来源,对铁代谢至关重要。HO-1促进乳腺癌的生长和转移。最近,研究发现锌-PPIX(ZnPPIX)是HO-1的特异性抑制剂,可抑制TAM中的HO-1,并使M2重新极化为M1巨噬细胞,这表明HO-1可能是乳腺癌治疗的重要靶点。此外,TAM分泌的铁蛋白促进乳腺癌的生长和转移。例如,TAM衍生的LCN-2促进人BCC的生长和增殖。LCN-2是病理条件下的替代铁转运蛋白,将铁转运至癌细胞以满足其代谢需求,并有助于乳腺癌的发生。
铁从TAM释放到TME中是肿瘤发生的一个有影响的方面。铁调素(一种肝脏表达的抗菌肽)被发现是铁代谢的主要调节因子,其表达与IL-6信号转导和转录激活因子STAT3信号通路有关,表明铁调素可以使用中和抗体方法直接靶向抑制肿瘤生长和转移(图4c)。
2.2.5 TAMs的腺苷代谢
腺苷是一种重要的细胞外信号分子,在TME中积累。腺苷途径调节肿瘤细胞增殖和凋亡。腺苷可以通过不同的腺苷受体以半胱天冬酶依赖性或半胱天冬酶非依赖性方式激活肿瘤细胞的凋亡。刺激肿瘤细胞中的A2B受体(腺苷受体的亚型之一)可以通过腺苷-腺苷受体系统引起免疫细胞表型的改变。腺苷脱氨酶(ADA)催化腺苷(ADO)或脱氧腺苷(DAO)的不可逆脱氨,多种证据表明癌细胞中ADA活性的增加或降低与乳腺癌的发生有关。来自TAM的ADA2活性增加可以刺激巨噬细胞极化至促肿瘤M2表型。腺苷通过刺激A2A受体促进血管生成,从而刺激巨噬细胞产生VEGF。腺苷受体直接调节乳腺癌细胞。因此,用腺苷相关酶干预将M2巨噬细胞重编程为M1型是治疗乳腺癌的重要方法(图4d)。
除乳腺癌外,通过代谢重编程的肿瘤细胞/TAM串扰的一般机制在其他癌症中也经常被提及。肿瘤细胞和TAM之间的代谢串扰在很大程度上决定了肿瘤的异质性和调节抗肿瘤免疫的条件。例如,lncMpa是一种源自TAMs的髓样特异性lncRNA,可以通过外泌体释放到肿瘤细胞中,以促进有氧糖酵解和肝癌细胞的增殖。相应地,在胰腺癌中,肿瘤细胞可以通过主要的细胞外基质成分或直接通过代谢重编程TAM来调节巨噬细胞的表型和功能。总之,通过代谢重编程的肿瘤细胞/TAM之间串扰的理论基础可以作为癌症诊断和治疗的基础,有效地扩大了治疗肿瘤的免疫疗法的范围。
3.靶向代谢的药物和策略
因此,靶向TAMs和肿瘤细胞代谢可能具有治疗意义。大量证据表明,TME的改变可以促进一些抗肿瘤药物的耐药性。靶向肿瘤和免疫细胞代谢与常规靶向治疗相结合可能是规避耐药或协同提高疗效的新途径。表1列出了靶向BCCs和TAMs的代谢药物。
3.1 靶向肿瘤细胞代谢
虽然BCCs和TAMs在微环境中代谢重塑的许多潜在机制尚不清楚,但越来越多的证据表明,抑制相关代谢酶可能是治疗乳腺癌的一种合理方法。既往研究表明,当乳腺癌患者对紫杉醇和曲妥珠单抗耐药时,乳酸脱氢酶抑制治疗可以显著改善耐药。Galloflavin (GF)是新近发现的一种乳酸脱氢酶抑制剂,可阻断糖酵解和ATP生成,通过抑制生物能代谢来阻碍肿瘤进展。Machilin A,一种抑制乳酸脱氢酶的化合物,通过直接减少细胞乳酸生成来抑制癌症进展。代谢酶信号通路也可能与乳腺癌的不良预后有关。研究人员使用PAN-NOS抑制剂NG -单甲基-l-精氨酸(L-NMMA)抑制NOS,从而抑制肿瘤生长,提高乳腺癌患者的生存率。最近的研究发现,FASN抑制剂TVB-2640在乳腺癌临床前模型中具有显著的抗肿瘤潜力,目前正处于临床试验中。特比萘芬靶向合成胆固醇3-7的关键酶SQLE也可能是预防和治疗肿瘤的有效方法。除了抑制阻碍癌症进展的相关代谢酶外,当BCCs进行糖酵解时,具有乳酸交换活性的单羧酸转运蛋白MCT4与肿瘤细胞建立代谢共生关系。这表明,通过基因消融的转运蛋白靶向代谢共生是治疗耐药乳腺癌的一种策略。
3.2 靶向肿瘤相关巨噬细胞代谢
3.2.1 代谢中的“旧药新用”
既往研究表明,一些药物可以通过靶向乳腺癌代谢而获得强大的治疗效果。一些靶向药物并不是直接作用于BCCs,而是通过激活抑癌巨噬细胞,从而阻止癌细胞的生长。脂质稳态与癌症密切相关。肝脏x受体(liver X-receptor, LXR)/三磷酸腺苷结合盒转运体A1 (adenosine triphosphate-binding cassette transporter A1, ABCA1)轴是调节巨噬细胞胆固醇稳态的机制之一。当ATP结合盒转运体G1 (ATP-binding cassette transporter G1, ABCG1)缺乏时,巨噬细胞胆固醇蓄积激活核因子κB(NF-κB),导致巨噬细胞M1型极化,产生TNFα和NO发挥抗肿瘤免疫作用。辛伐他汀(Simvastatin, SV)是一种代谢CHOL的药物。近年来研究表明,SV可逆转上皮-间充质转化(EMT),并通过调节CHOL代谢发挥抗肿瘤作用。其中一条途径作用于TAMs,通过调节胆固醇相关的LXR/ABCA1轴促进M2向M1表型转化。TAMs重编程后,TGF-β分泌减少,从而对抗肿瘤免疫产生联合作用。此外,研究人员发现无毒的中药黄芪多糖(astragalus polysaccharide, APS)在体外对BCCs的生长没有显著的抑制作用,但通过激活巨噬细胞释放NO和TNF-α发挥抑癌作用。氯喹(Chloroquine, CQ)是之前研究中发现的一种抗疟药,据报道,CQ可通过将TAMs极化为M1型来重塑TAMs。这可以改善免疫抑制性TME,从而产生抗肿瘤免疫。该药物在抗肿瘤免疫中的具体作用机制涉及两条途径。巨噬细胞溶酶体释放钙离子后,转录因子TFEB被激活,使TAMs的代谢从氧化磷酸化重新编程为糖酵解,从而从代谢角度抑制癌症。蒲公英提取物已被用于治疗乳腺结节和炎症,可通过抑制IL-10/STAT3/PD-L1免疫抑制信号通路调控TME,促进巨噬细胞由M2型向M1型极化,减少TNBCs的增殖、迁移和侵袭。在巨噬细胞中,由IL10驱动的GS活性与促肿瘤M2样表型相关。草铵膦是一种特异性的人类GS抑制剂,已被证实可降低巨噬细胞内的谷氨酰胺水平,增加琥珀酸水平和糖酵解。巨噬细胞中的谷氨酰胺酶被抑制后,其诱导T细胞募集的能力增强,最重要的是,GS抑制剂使M2极化的巨噬细胞向M1表型倾斜,从而增强了乳腺癌的抗肿瘤免疫。综上所述,现有的文献强调了开发靶向抑制代谢通路和增强抗肿瘤免疫的乳腺癌治疗药物的巨大潜力。
3.2.2 其他靶向策略
众所周知,M1型巨噬细胞可以承受广泛的ROS水平。M2型巨噬细胞更容易受到细胞氧化还原状态的影响;因此,针对巨噬细胞的氧化还原敏感性开发相关策略和药物是治疗乳腺癌的策略。例如,Griess等人发现巨噬细胞ROS调节剂MnTE-2-PyP5+通过减少STAT3活化来抑制IL4刺激的M2巨噬细胞极化,从而减少乳腺癌的血管生成和转移。此外,研究人员发现新型半胱氨酸组蛋白蛋白酶抑制剂GB111-NH2通过提高ROS水平来抑制乳腺癌的发展,导致巨噬细胞的凋亡和增殖。早期研究表明,一些天然和合成的PPARγ激活剂,如罗格列酮和脱氢表雄酮,也可以通过调节巨噬细胞向交替激活的巨噬细胞的分化来触发乳腺癌的发生;然而,PPARγ拮抗剂GW9662可以逆转这种效应。此外,已发现PARP抑制剂通过调节糖脂代谢、巨噬细胞功能和表型来诱导TME的代谢重编程。研究还发现,当PARP抑制增强时,巨噬细胞中CSF1R的表达增加,抗CSF1R和PARP抑制剂的组合可以激活M1型巨噬细胞和CD8+T细胞发挥抗肿瘤免疫作用。一种名为EI-05的化合物是一种新型的E-FABP激活剂,可促进TAM中脂滴的形成和IFN-β的产生。
研究表明,通过抑制II a类组蛋白脱乙酰酶(HDAC)进行表观遗传调控是利用巨噬细胞抗肿瘤潜力的有前途的方法。TMP195是一种改变巨噬细胞转录谱的II a类HDAC抑制剂,可减少临床前乳腺癌模型中巨噬细胞介导的肿瘤生长。另一种HDAC抑制剂tefinostat(CHR-2845)被非特异性酯酶肝羧酸酯酶1(CES1)切割成活性酸,其表达仅限于单核细胞谱系细胞和某些肝细胞,已成功用于晚期恶性肿瘤患者的I期临床试验。此外,大多数针对糖酵解逆转巨噬细胞极化的研究都依赖于糖酵解抑制剂,如2-脱氧-D-葡萄糖(2-DG)。呼吸复合物I抑制剂二甲双胍是一种抗糖尿病药物,可重塑TME,降低TAM的密度,增加吞噬作用。除了一些靶向药物之外,先前的研究表明,纳米颗粒从M2 TAM和BCC中去除VEGF和PIGF,将肿瘤免疫抑制的TME重塑为抗肿瘤状态。这种分子和免疫肿瘤联合治疗为开发分子、免疫和代谢方面的三联疗法提供了一个新的创新点,以最大限度地治疗乳腺癌患者。
讨论
TME中肿瘤和免疫细胞的代谢重编程越来越被认为是促成这些细胞之间复杂作用的关键途径。研究已经发现,靶向肿瘤免疫代谢的肝癌、肺癌和胶质母细胞瘤的治疗取得了良好的治疗效果;然而,乳腺癌的治疗,特别是通过代谢重编程的治疗,尚未被发现。本文总结了目前针对BCC和TAM代谢的相关药物,以及这两种细胞通过代谢重编程相互作用的具体机制,为有效的乳腺癌治疗提供了一个很好的切入点。
巨噬细胞具有高度可塑性和异质性。在乳腺癌中,TAM代谢产生的代谢物通过影响其极化直接或间接影响BCC,从而影响癌症进展。反过来,代谢也会影响TAM的功能和极化。这两种细胞类型的代谢重编程有时可以形成反馈途径。然而,关于精确靶向肿瘤相关巨噬细胞和特定代谢靶点存在局限性。首先,BCC和TAM在代谢上是异质的,当用特异性靶向脂质代谢的药物治疗时,可能表现出相同或相反的作用。其次,改变的氨基酸代谢显著影响BCC和TAM。然而,关于乳腺癌中氨基酸代谢的报道很少;因此,迫切需要进一步研究肿瘤细胞与TAM之间的相互交流及其作用机制。第三,我们发现当使用靶向代谢药物时,正常细胞共享一些代谢途径。在开发靶向代谢药物时,确保靶向TAM或肿瘤细胞代谢的特异性也值得考虑。因此,进一步了解靶向免疫细胞和肿瘤细胞之间的代谢机制可能有助于我们了解乳腺癌免疫代谢治疗的进展。
此外,最近的新技术为未来的癌症治疗提供了关于TAM免疫代谢的新思路。例如,肿瘤衍生的外泌体证明了癌细胞和TAM之间潜在的代谢串扰模式。外泌体对癌症患者TAMs极化的影响程度以及使用外泌体转运进行靶向治疗的潜在途径促使我们研究与乳腺癌相对应的阻断药物。此外,最近纳米生物技术的兴起促进了更大的癌症治疗浪潮。据报道,纳米颗粒可诱导M2型巨噬细胞向M1型巨噬细胞的复极化,主要聚焦TAM相关免疫疗法提高癌症疗效。纳米材料用于靶向递送,药物释放的精确定位为开发用于乳腺癌治疗的靶向代谢药物提供了有用的方向。总之,靶向免疫代谢是一种有前景的癌症治疗方法;然而,未来还有很长的路要走。
原文链接:
Liang Y, He J, Chen X, Yin L, Yuan Q, Zeng Q, Zu X, Shen Y. The emerging roles of metabolism in the crosstalk between breast cancer cells and tumor-associated macrophages. Int J Biol Sci 2023; 19(15):4915-4930. doi:10.7150/ijbs.86039. https://www.ijbs.com/v19p4915.htm
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#乳腺癌# #肿瘤相关巨噬细胞#
23