Mol Cancer:中山大学潘志忠/林俊忠/周驰发现促进结直肠癌肝转移的调控新机制
2024-01-02 iNature iNature 发表于威斯康星
该研究证明,由m6 A修饰的环状RNA驱动的正反馈回路促进结直肠癌肝转移。
肝转移是结直肠癌(CRC)患者死亡的主要原因。新出现的证据表明,环状RNA (circRNA)在癌症进展中起着关键作用。然而,其在结直肠癌肝转移中的作用在很大程度上仍然未知。
2023年12月13日,中山大学潘志忠、林俊忠及周驰共同通讯在Molecular Cancer在线发表题为“A positive feedback circuit driven by m6A-modified circular RNA facilitates colorectal cancer liver metastasis”的研究论文,该研究证明,由m6 A修饰的环状RNA驱动的正反馈回路促进结直肠癌肝转移。Circ-YAP在伴有肝转移的结直肠癌中显著上调,与预后不良相关。Circ-YAP促进CRC细胞在体外的迁移和侵袭,并促进患者源性异种移植(PDX)模型体内的肝转移。
从机制上讲,circ-YAP编码了一种含有220个氨基酸的新型截断蛋白,称为YAP-220aa,该蛋白与LATS1竞争性结合,导致YAP去磷酸化和核易位,从而激活一系列促进转移的基因。重要的是,N6 -甲基腺苷(m6 A)修饰协调了circ-YAP翻译的有效起始,需要m6 A“读取器”YTHDF3和eIF4G2翻译起始复合物。有趣的是,circ-YAP被YAP/TEAD复合物转录增强,从而形成一个正调控前馈回路。总之,该研究揭示了circ-YAP编码的一个以前未被表征的癌蛋白,这意味着一个有希望的结直肠癌肝转移患者的生物标志物和治疗靶点。

结直肠癌(Colorectal cancer, CRC)是消化道最常见的恶性肿瘤之一,其发病率和死亡率在所有恶性肿瘤中分别排名第三和第二位。肿瘤转移是结直肠癌患者死亡的主要原因。临床上约有45-60%的结直肠癌患者存在肝转移,90%以上的肝转移不能初步切除。未经手术治疗的结直肠癌肝转移患者中位生存时间仅为6.9个月,5年生存率不足5%。因此,破解结直肠癌肝转移机制,发现预防和干预转移的新治疗靶点,提高患者生存率具有重要的临床意义。
环状RNA (Circular RNA, circRNA)是一类特殊的内源性RNA分子,具有共价闭环结构,没有传统的5′端“帽状结构”和3′端聚A尾部。一些circRNA被确定为预测疾病进展和预后的可用生物标志物。最近的一些证据表明circRNA能够被翻译成功能性肽。此外,circRNAs编码的截断蛋白如E-Cad-254aa和ARHGAP35-1289aa分别被报道在胶质瘤和肝细胞癌中发挥关键作用。由于从头到尾的形状,circRNA以帽独立的方式编码蛋白质,由内部核糖体进入位点(IRES)或m6 A修饰驱动。m6 A是真核RNA中最丰富的内部修饰,具有动态可逆性,由m6 A写入器(METTL3/14和WTAP)催化,由m6 A“擦除器”(FTO和ALKBH5)去除,由m6 A读取器(YTHDF1/2/3和ythdc2 /2)识别。迄今为止,只有少数这些隐藏在环状RNAs中的小内源性蛋白被表征,绝大多数的功能相关性尚未被发现。
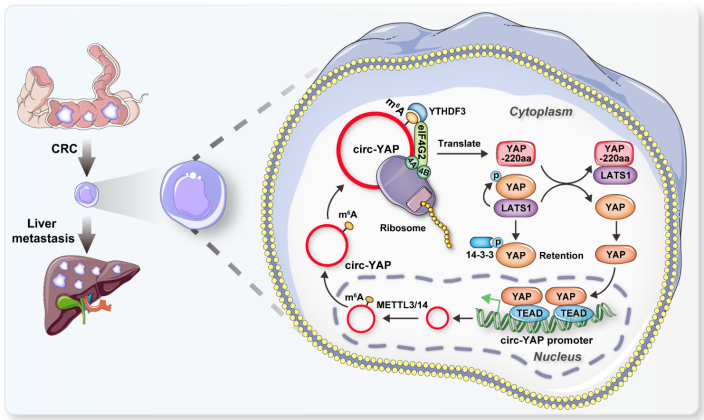
机理模式图(图源自Molecular Cancer )
该研究发现circRNA circ-YAP是CRC肝转移的驱动因素。Circ-YAP包含一个220-aa的开放阅读框(ORF),并以m6 A依赖的方式编码一种新的YAP蛋白异构体,称为YAP-220aa。此外,还发现YAP220aa通过阻止LATS1介导的YAP磷酸化和细胞质保留来激活YAP信号。该研究揭示了circ-YAP编码的一个以前未被表征的癌蛋白,这意味着一个有希望的结直肠癌肝转移患者的生物标志物和治疗靶点。
原文链接:
https://doi.org/10.1186/s12943-023-01848-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#结直肠癌肝转移# #环状RNA#
32