Cell论文:优化改良天然产物sequanamycin A,解决肺结核耐药新方案
2023-11-14 ComputArt计算有乐趣 ComputArt计算有乐趣 发表于上海
这些结果支持进一步研究该系列作为结核病临床候选药物,并有可能成为治疗药物敏感和耐药结核病的新方案。
结核病( Tuberculosis,TB )是由结核分枝杆菌( Mycobacterium tuberculosis,Mtb )引起的呼吸道传染病,是COVID-19流行前全球感染性疾病死亡的主要原因。此前,结核病的治疗主要依靠利奈唑胺及大环内酯类抗生素治疗。其中,利奈唑胺通过靶向50s核糖体来抑制蛋白质合成,但是其毒性阻碍了它在结核病治疗中的广泛应用。而大环内酯类则通过阻断核糖体的多肽出口隧道来阻止蛋白质的生物合成,但由于大环内酯类抗生素诱导会诱导Mtb erm37 基因,编码甲基转移酶甲基化Mtb核糖体的A2058位点,改变核糖体构象影响其与核糖体的结合。所以尽管这类抗生素是治疗许多细菌感染的基石药物,但它们已被证明对结核病无效。并且随着抗生素耐药性问题的加剧,耐多药结核病( MDR-TB )和广泛耐药结核病( XDR-TB )的发病人数逐年增加。因此,我们迫切需要具有抗Mtb活性的新型抗结核药物组合。
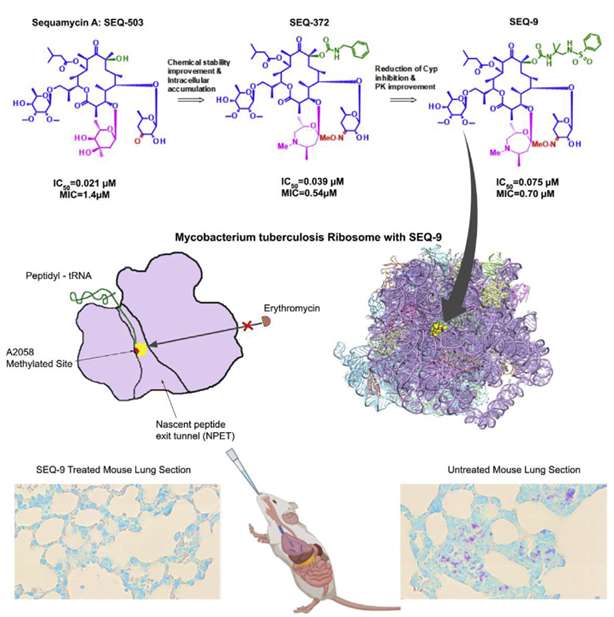
来自法国赛诺菲Sophie Lagrange团队针对这一问题,优化改良了天然产物sequanamycin A,进而生产先进的先导化合物SEQ-9。SEQ-9在急性和慢性结核模型中作为单一药物有效,并在小鼠结核感染模型中与其他结核药物联合使用显示出杀菌活性。这些结果支持进一步研究该系列作为结核病临床候选药物,并有可能成为治疗药物敏感和耐药结核病的新方案。近日,该项研究工作发表于Cell期刊(Zhang et al., 2023, Cell 186, 1013–1025)。
sequanamycin A(SEQ - 503)被发现于1969年,由 Allokutzneria albata(放线菌目假诺卡氏菌科的成员)产生的 14 元环红霉素家族大环内酯。SEQ - 503在结构上与其他十四元环大环内酯类不同,其C3位为肉豆蔻糖而非克拉定糖,C5位为酮阿洛糖而非红霉脱氧糖胺,C13位为麦芽糖。
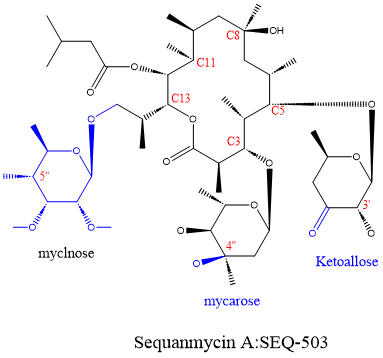
图1、sequanamycin A(SEQ - 503)的分子结构
此外,相较于大多数大环内酯类抗生素,SEQ - 503对结核杆菌的最小抑菌浓度( minimum inhibitory concentration,MIC )仅为1.4 μM。这证明其有作为抗结核药物的潜力。
但这种化合物提出了几个挑战:第一,SEQ - 503在酸性介质中不稳定:在pH值为2的50%乙腈/水中的半衰期不到30min,这表明它在人体胃中会迅速降解,因此不适合作为口服药物。第二,该化合物在人肝微粒体中代谢不稳定:67%的化合物在体外20分钟内代谢。
为了克服这些限制,研究人员对 SEQ-503 进行了药物化学改造与研究,发现了两个对Mtb H37Rv菌株( MIC分别为0.57和0.13 m M)具有较好抑制活性的序列霉素衍生物SEQ - 569和SEQ - 977。SEQ - 977与核糖体结合的整体结构与SEQ - 569相似,仅C8位的取代基不同。此外,SEQ-569 和 SEQ-977 均可成功的与 T. thermophilus 70S 核糖体结合。
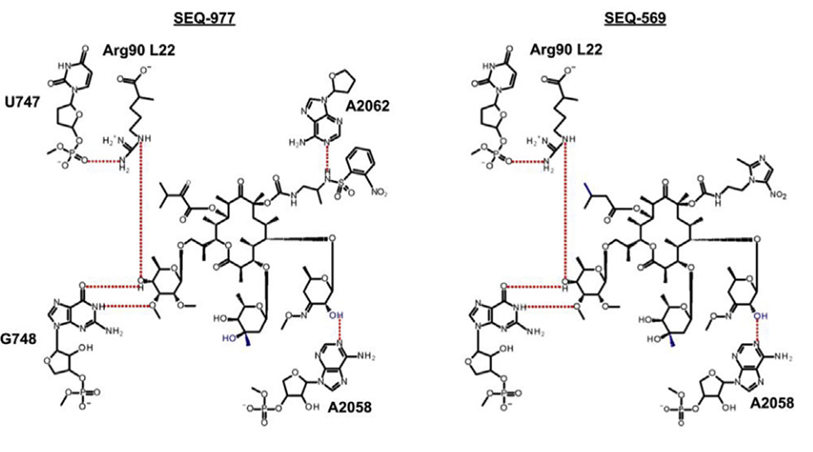
图2、SEQ-569 与 SEQ-977 的分子结构
与经典的红霉素大环内酯类相比,sequanamycin 家族具有一些额外的氢键,这些氢键对 sequanamycin 家族化合物来说至关重要。以SEQ - 977为例,其除了C8位的氨基甲酸酯基团外,磺酰胺基团的NH也与A2062的N1形成氢键。这种相互作用导致A2062在SEQ - 977共晶结构中的取向与SEQ - 569不同,也解释了为何SEQ - 977 ( IC50 = 0.034 μM,MIC = 0.13 μM ) 相较于SEQ - 569( IC50 = 0.054 μM,MIC = 0.57 μM ) 具有 更高的效力。
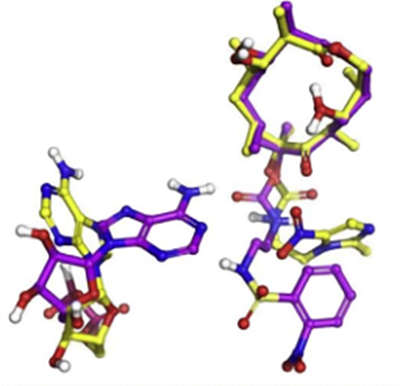
图3、A2062在SEQ - 569 (黄色)和SEQ - 977 (紫色)的C8位氨基甲酸酯存在时的相对位置
研究团队后续优化了修饰 C5 的 酮丙二糖和 C8 的氨基甲酸酯基团,并产生新的化合物,如SEQ - 416,其具有更好的抗结核活性和化学稳定性,但在小鼠结核病模型中效果不佳。研究人员推测可能这些结果与巨噬细胞的有限渗透和积累有关。
将 mycarose 进一步修饰为具有取代胺的 7 元 1,4-噁氮杂烷,合成 SEQ-372,具有弱碱性(pKa为8.2)和更好的亲脂性 ( logD为4.93 ),这些理化性质可以改善化合物在细胞内的积累。与其中性类似物 SEQ-416 ( IC50 = 0.044 μM,MIC = 0.15 μM ) 相比,SEQ-372 ( IC50 = 0.039 μM,MIC = 0.54 μM ) 在标准 MIC 测定条件下抗菌效力略低,但在巨噬细胞中的积累增加 20 倍,巨噬细胞中抗 Mtb 的效力增加约 10 倍。
SEQ-372 是该系列中第一个在急性 TB 感染小鼠模型中显示出剂量依赖性功效的化合物,在相同剂量和相同测定条件下比克拉霉素更有效。然而,SEQ-372 抑制细胞色素 3A4 的特性限制了其被用作联合治疗的药物。
进一步优化 C8 的氨基甲酸酯部分,合成了 SEQ-9 ( IC50 = 0.065 μM ),它的吸收、分布、代谢和消除 ( ADME )特性均很理想,并且 不具有细胞色素 3A4 抑制活性。该化合物在酸性条件下 ( pH 2.0,50% 乙腈/水 ) 的半衰期从 SEQ-503 的 30 分钟增加到 48 小时。且由于对人类、小鼠和大鼠微粒体代谢负担较低, SEQ-9 的血浆曲线下面积 ( AUC ) 在给予小鼠相同口服剂量(30 mg/kg)时比 SEQ-372 高 6 倍。此外,肺与血浆的暴露比为 19,表明其在肺组织中富集。研究人员还发现,在 HepG2 细胞 ( IC50 = 10 μM ) 和原代人肝细胞 ( IC50 = 26 μM ) 的体外细胞毒性实验中,SEQ-9 具有更合适的安全范围。
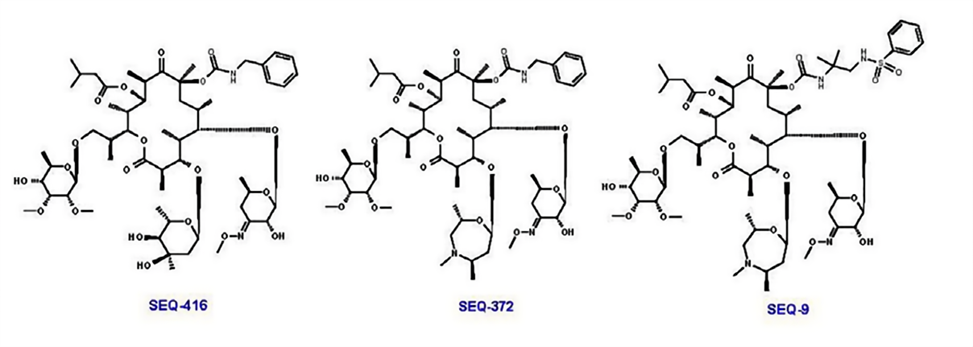
图4、SEQ-416、SEQ-372、SEQ-9的分子结构
相关实验证明,SEQ - 9对Mtb核糖体具有强效的靶向活性,并具有合理的体外安全范围。为了评估其对SEQ - 9的耐药频率,并确认其靶向活性,研究人员分离出对SEQ - 9有抗性的自发Mtb突变体。发现用SEQ - 9选择的耐药突变体对sequanamycin抗生素和克拉霉素具有更高的耐药性,同时对利福平和利奈唑胺保持敏感。为了更好地了解sequanamycin克服Mtb核糖体上A2058甲基化耐药性的机制,研究人员进行了冷冻电镜研究,以确定与SEQ-9结合的A2058甲基化Mtb核糖体的结构(PDB:7KGB,EMDB:EMD22865),以及与SEQ-9结合的未甲基化Mtb核糖体的结构(PDB:7SFR, EMDB:EMD25100)进行比较。研究人员通过在培养基中培养具有亚抑制浓度的红霉素的Mtb来实现核糖体的甲基化,并且通过测量甲基化核糖体与未甲基化核糖体相比IC50的变化来证实核糖体的甲基化。对于甲基化的Mtb核糖体,SEQ-9仍然显示出对蛋白质合成的有效抑制(甲基化Mtb核糖体的IC50 = 0.075和0.065 μM),这表明A2058的N6上的甲基不会减少Mtb核糖体和sequanamycin之间的整体结合相互作用。金黄色葡萄球菌(S. aureus)核糖体的结构表明,大环内酯类药物耐药性是由A2058上的N6甲基与脱硫胺糖的二甲基胺之间的空间位阻冲突引起的。这强调了甲基化A2058在置换水分子方面所起的作用,水分子是介导抗生素与核糖体结合的关键。
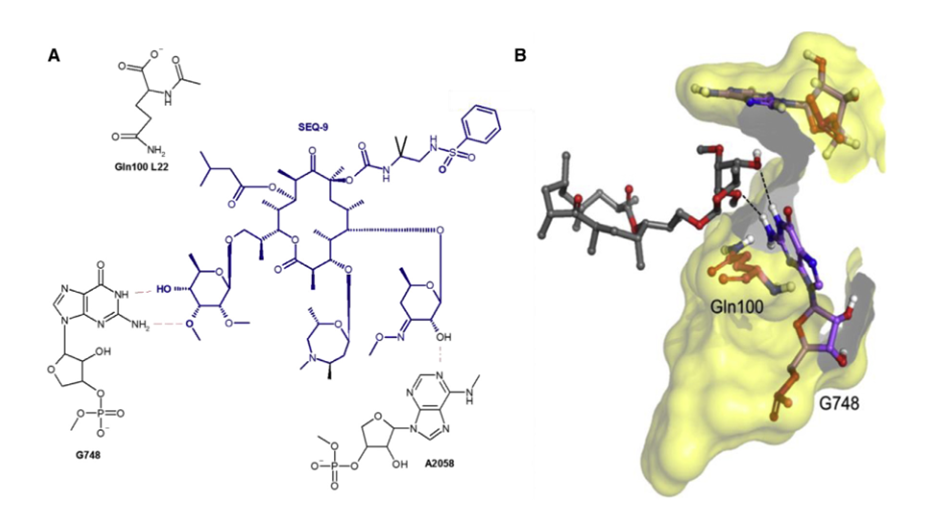
图5、SEQ-9与Mtb 核糖体的相互作用
在药效方面,SEQ - 9 对 多种 Mtb 菌株 表现出有效的抗菌活性。并且对急性和慢性TB小鼠模型均具有剂量依赖性杀菌作用。在与贝达喹啉 ( B ) 、普瑞玛尼 ( Pa ) 、利奈唑胺 ( L ) 或吡嗪酰胺 ( Z ) 的联合疗法中也贡献了重要的杀菌作用。
小结:研究人员报告发现了一系列称为 sequanamycins 的大环内酯类化合物,它们具有出色的体外和体内抗结核分枝杆菌 (Mtb) 活性sequanamycin是一种细菌核糖体抑制剂,与核糖体相互作用的方式与经典大环内酯类药物(如红霉素和克拉霉素)类似,但具有结合特性,使它们能够克服结核分枝杆菌固有的大环内酯类耐药性。结合抑制剂的核糖体结构被用于优化sequanamycin,进而生产先进的先导化合物SEQ-9。SEQ-9在急性和慢性结核模型中作为单一药物有效,并在小鼠结核感染模型中与其他结核药物联合使用显示出杀菌活性。这些结果支持进一步研究该系列作为结核病临床候选药物,并有可能成为治疗药物敏感和耐药结核病的新方案。
参考文献
【1】Zhang J, Lair C, Roubert C, et al. Discovery of natural-product-derived sequanamycins as potent oral anti-tuberculosis agents. Cell. 2023,186,1013-1025
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







