CSCO2022 CDE专场|抗肿瘤ADC药物的临床研发与审评考虑
2022-11-08 梅斯医学 网络
DE夏琳审评员作了题为“抗肿瘤ADC药物的临床研发与审评考虑”的报告,对ADC药物的临床研发现状进行了简要的介绍并强调了ADC药物研发过程中需要考虑的重要方面。
2022年11月6日,由中国临床肿瘤学会(CSCO)和北京市希思科临床肿瘤学研究基金会共同主办的第25届全国临床肿瘤学大会暨2022年CSCO学术年会进入第二天,迎来了令人高度关注、热点纷繁的CDE专场。
CDE夏琳审评员作了题为“抗肿瘤ADC药物的临床研发与审评考虑”的报告,对ADC药物的临床研发现状进行了简要的介绍并强调了ADC药物研发过程中需要考虑的重要方面。
什么是ADC药物?
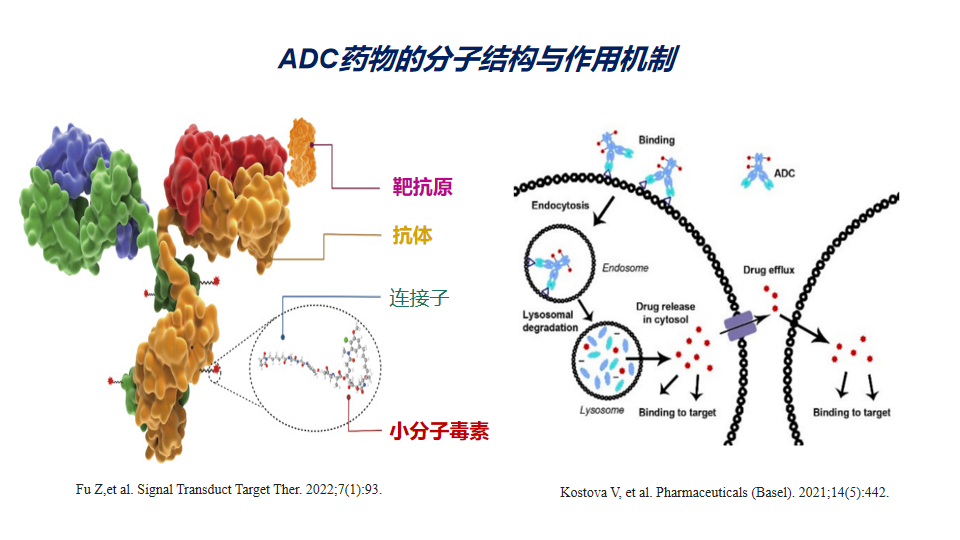
抗体偶联药物(ADC)是由靶向特异性抗原的单克隆抗体与小分子细胞毒性药物通过连接子链接而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。ADC由三个主要部分组成:负责选择性识别癌细胞表面抗原的抗体,负责杀死癌细胞的药物有效载荷,以及连接抗体和有效载荷的连接子。
ADC对抗原的识别导致ADC通过内吞途径进入细胞内,通过溶酶体降解后,有效载荷以生物活性形式释放并发挥作用,导致癌细胞死亡。细胞内有效载荷的数量由每个细胞表面抗原的数量、每个ADC的药物有效载荷分子的数量(也称为药物抗体比率,DAR)以及抗原返回细胞表面所需的时间决定。有效载荷可能在癌细胞死亡和降解后逃逸,也可能从胞浆中透膜而出。这种释放的后果可能是有益的(也称为旁观者效应),也可能是有害的,导致全身毒性。
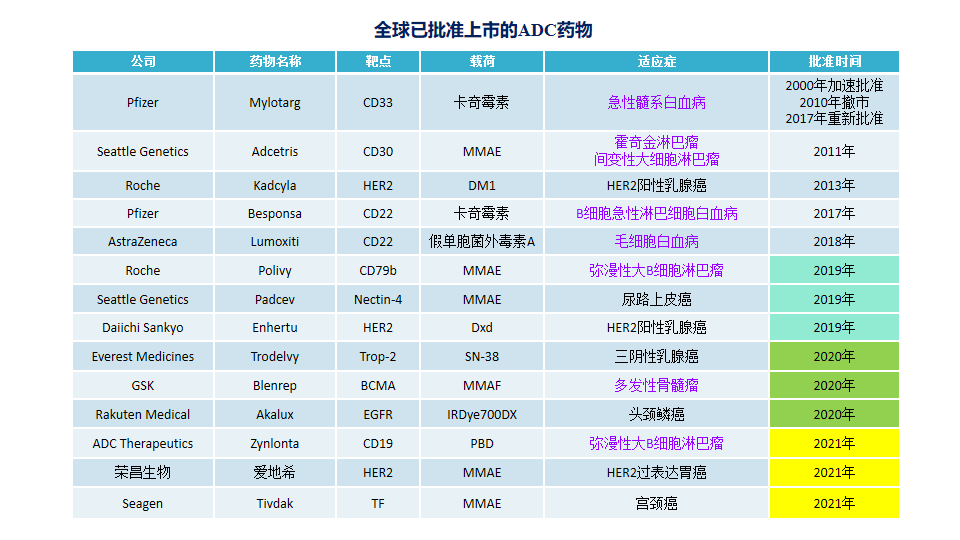
ADC药物凭借其良好的发展前景,各国药企都在加速ADC的研发。截至目前,全球已有14款ADC药物陆续上市。
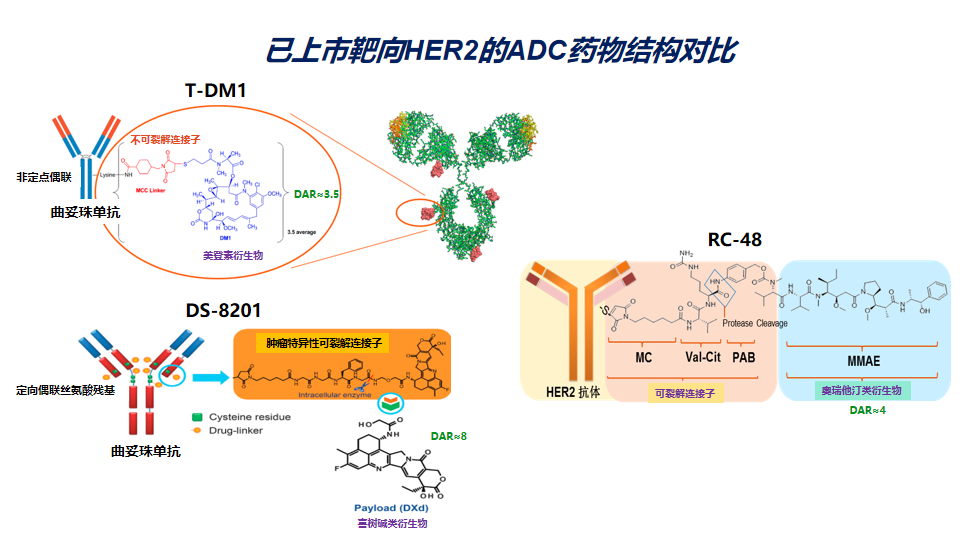
HER2靶向的ADC药物
乳腺癌治疗向来是创新疗法的先锋领域,ADC药物也不例外,第一个实体瘤ADC药物即是用于治疗乳腺癌。HER2作为经典的肿瘤靶点,由于特异性高表达于肿瘤组织而正常组织表达较少,而且HER2可以高效介导ADC药物的内吞作用,因此也是ADC药物开发的理想靶点。HER2靶向的ADC药物可追溯到多年以前,首个上市的产品是T-DM1,后续不断有新的ADC药物处于开发之中,第二款上市的则是大名鼎鼎的DS-8201,随着DS-8201取得巨大成功,HER2靶向ADC药物开发进入新的群雄逐鹿时期,但这些相同靶点的ADC药物如何区分以及是否还具有临床应用价值,越来越受到质疑。
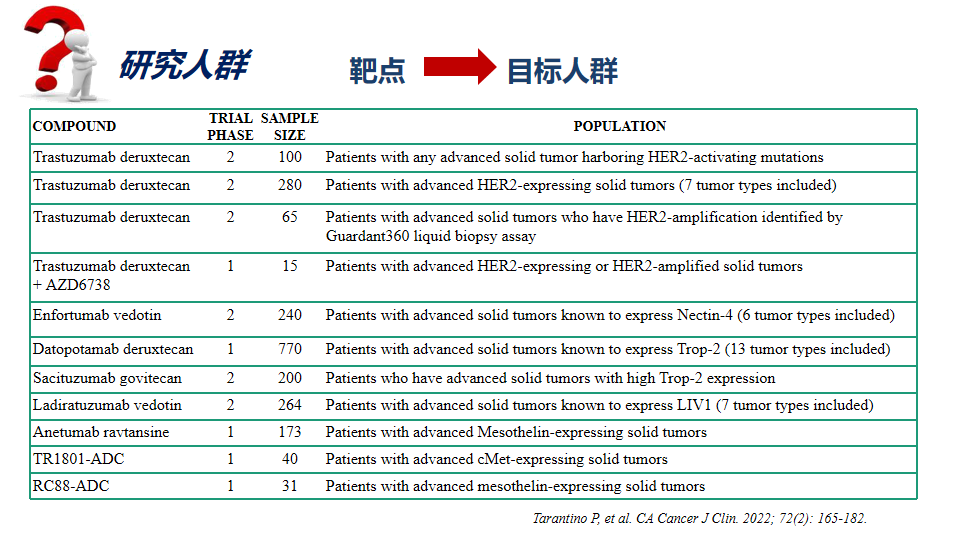
人群选择策略
基于作用机制,ADC 药物的人群选择策略主要集中在肿瘤细胞上靶抗原表达方面,但针对同一靶抗原不同 ADC 药物在不同瘤种中的疗效各异。其原因可能为:①由于 ADC 药物结构和作用机制的复杂性, 其疗效与抗体、连接子和毒素成分及其与肿瘤及微环境间的相互作用有密切关系, 造成了针对同一靶抗原的不同药物在各瘤种中的疗效迥异;②在不同的肿瘤组织学类型中, 存在靶抗原的异质性、潜在肿瘤基因组的复杂性等差异,均会影响 ADC 药物的递送以及抗肿瘤活性。以人表皮生长因子受体 2( human epithelialgrowth factor receptor-2, HER2) 为靶抗原的 ADC 药物为例,理论上其对 HER2 过表达/突变的肿瘤均有效,包括乳腺癌、胃癌、尿路上皮癌、结直肠癌和非小细胞肺癌等,但已有研究数据表明, 针对 HER2 靶抗原的不同 ADC 药物,因为连接子、有效载荷及偶联方式的不同, 可能呈现不完全相同的 PK、PD、有效性和安全性特征:如某一药物治疗HER2 阳性乳腺癌有效,但在 HER2 阳性胃癌患者中并未取得明显的临床获益;而另一药物在 HER2 阳性的乳腺癌患者和胃癌患者中均有效。
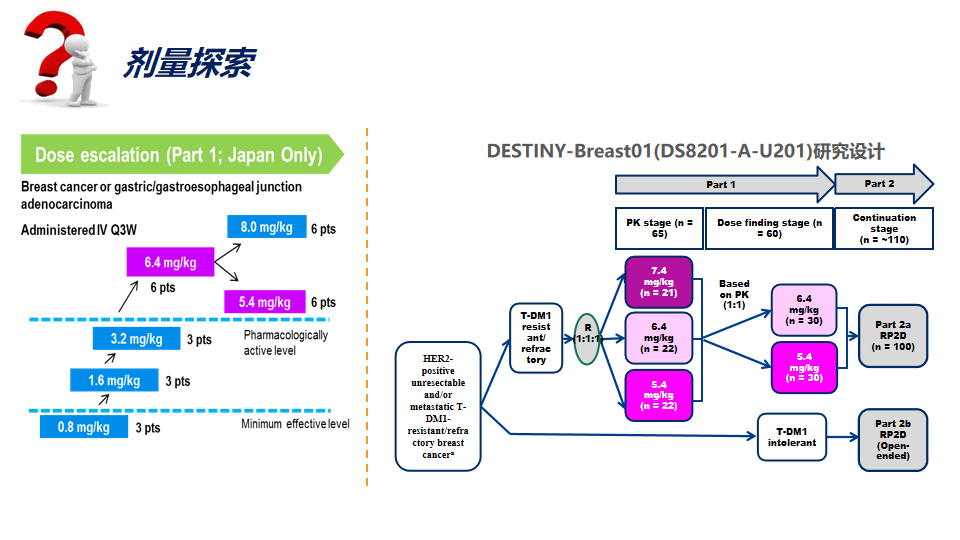
剂量探索
ADC的药效和毒性作用主要来自于游离小分子化合物,通常其临床起始剂量的拟定方法与大多数全身给药的小分子药物相同,应将动物剂量与人体剂量进行等效剂量种属间换算。基于拟定的适应症考虑毒性耐受终点和安全系数。
拟用于晚期肿瘤患者的ADC,常用方法是基于啮齿类动物STD10(10%的动物出现严重毒性反应剂量)等效剂量的1/10和非啮齿类动物HNSTD(最高非严重毒性剂量)等效剂量的1/6估算起始剂量,为了保障受试者的安全,一般取其中较低者作为起始剂量。对于具有免疫激动特性的ADC,应基于最低预期生物效应水平(MABEL)估算起始剂量。
从分子量大小和空间体积方面讲,ADC药物结构中的主体主要是抗体,因此表现出诸多与单抗类似的药代动力学特征。从安全的角度来看,药物的毒性是剂量限制因素。在开发早期全面了解ADC及其组成部分的PK和PD,以及它们与安全性和有效性结果的关系,对于优化ADC剂量至关重要。
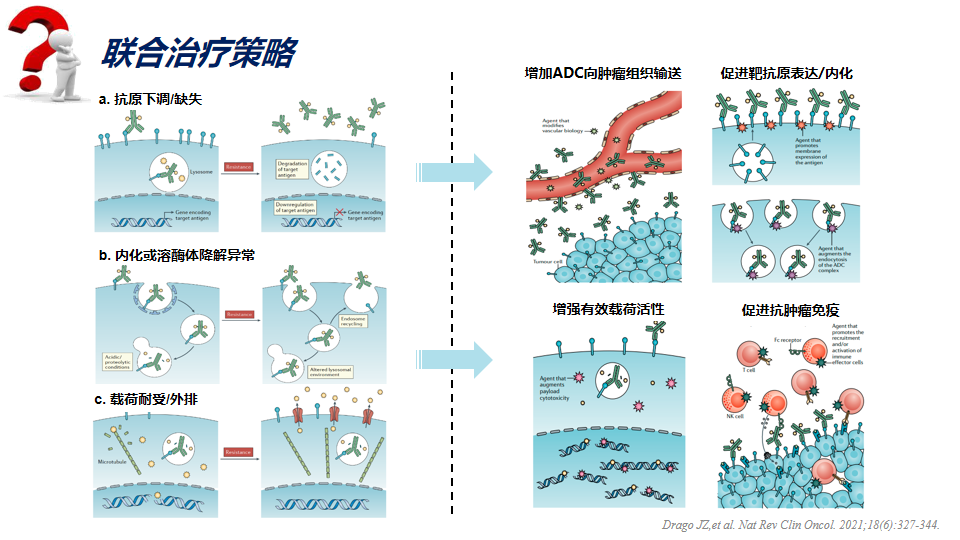
联合治疗策略
为了获得更佳疗效和克服耐药性,联合治疗也已成为抗肿瘤药物的重要研发方向。合理的联合治疗策略可有效的增加 ADC药物的抗肿瘤活性。目前 ADC 类药物可能的联合增效机制包括如下:①促进抗肿瘤免疫:ADC 药物可诱导免疫原性细胞死亡,改变肿瘤组织的免疫微环境,当与免疫治疗联合使用,可以发挥协同抗肿瘤活性,这很大程度上取决于有效载荷的特性。②增加ADC 向肿瘤组织的输送:例如靶向 VEGF 信号通路的药物,可能通过促进肿瘤血管正常化来改善 ADC 向肿瘤组织的输送。③联合后增强有效载荷活动和/或合成的杀伤力。④调节抗体靶蛋白表达:增加肿瘤细胞表面靶抗原表达的药物可能会促进抗体抗原结合。
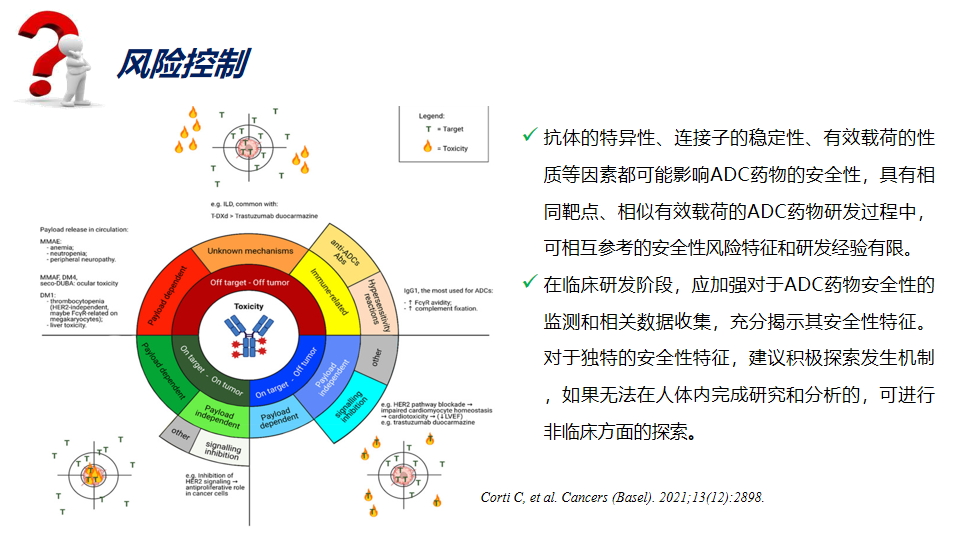
风险控制
抗体的特异性、连接子的稳定性、有效载荷的性质等因素都可能影响ADC药物的安全性,具有相同靶点、相似有效载荷的ADC药物研发过程中,可相互参考的安全性风险特征和研发经验有限。
在临床研发阶段,应加强对于ADC药物安全性的监测和相关数据收集,充分揭示其安全性特征。对于独特的安全性特征,建议积极探索发生机制,如果无法在人体内完成研究和分析的,可进行非临床方面的探索。
对于全球同步开发的ADC药物,鼓励在临床早期即入组适当比例的中国受试者,充分表征在中国人群中的PK和PD特征、安全性和耐受性,为关键研究中的中国人群给药剂量的选择、安全性风险的管理提供合理的依据。
总结与展望
抗肿瘤ADC药物研发热度持续高涨,技术进步推动ADC药物成功迭代,开启“广谱”抗肿瘤模式。同靶点的不同ADC药物可呈现不同的有效性和安全性特征,应结合产品自身特点,以临床需求为出发点,合理制定开发计划,鼓励差异性研发。开展有依据的联合治疗研究,关注叠加安全性风险,合理利用生物标志物精准筛选获益人群。
参考资料:
https://mp.weixin.qq.com/s/iJhWrM0LzPsf9ahrxF20oA
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













