Cell Reports:衰老小鼠中病理性Tau从神经元扩散到少突胶质细胞
2022-12-02 brainnew神内神外 brainnew神内神外 发表于安徽省
在急性切片中,尽管老化tg小鼠的突触兴奋性较低,但tg和ntg小鼠的CA1的长期增强作用相似。需要对老化小鼠进行长期高密度记录,以确定低放电细胞的突触可塑性是否在很大程度上补偿了高增强突触的损失。
脑组织过度磷酸化的Tau蛋白(pTau)在细胞内聚集与认知和运动功能障碍有关,并最终导致神经退行性变。尽管病理性Tau会导致广泛的病理生理后果,对Tau蛋白在脑内播散还缺乏足够了解。
近期《Cell Reports》期刊发表了题为“Spread of pathological human Tau from neurons to oligodendrocytes and loss of high-firing pyramidalneurons in aging mice”的文章。作者在体内研究了人类pTau如何影响Tau蛋白病模型小鼠海马形成中的细胞和网络活动。发现pTau优先在深层锥体神经元中聚集,导致神经变性,并且确定pTau扩散到少突胶质细胞。在老龄转基因小鼠的目标导向虚拟导航试验中,检测到较少的高放电锥体神经元,但放电群体保留了与θ振荡的耦合。
在空间记忆测试中,转基因小鼠的短期熟悉度降低,但空间记忆正常。作者推测,未受损的皮质下网络机制维持了皮质神经元的协调,从而抵消了广泛的pTau聚集、高放电细胞的丢失和神经变性。
 研究背景
研究背景
大多数tau蛋白病(散发性tau蛋白病)是由细胞内过度磷酸化的Tau蛋白(pTau)积累定义;少数tau蛋白病(遗传性tau蛋白病)由微管相关蛋白Tau(MAPT)基因突变引起。人类大脑中表达6种Tau亚型,其中3种分别含有3个重复序列(3Rs),另外3种分别含有4个重复序列(4Rs),均来自剪接变异体。这些异构体聚集在不同类型的神经元和胶质细胞中具有不同的时空分布。阿尔茨海默病、肌萎缩侧索硬化、尼曼-匹克病C型以及部分类型的家族性额颞叶痴呆和帕金森综合征(FTDP)均存在3R和4R Tau的混合物。匹克病和某些类型的FTDP只有3R Tau。4R Tau包括皮质基底变性(CBD)、进行性核上性麻痹(PSP)、嗜银性颗粒病和其他类型的FTDP。
对认知和运动功能的影响取决于哪些大脑区域和细胞类型最容易形成pTau聚集和神经退行性变。空间记忆缺陷(编码和回忆环境背景的能力)与从轻度认知障碍到阿尔茨海默病的皮层pTau的累积密切相关。一般认为pTau的扩散与神经症状的严重程度相关,年龄是最大的危险因素。动物模型提供了关于pTau对行为、认知、神经兴奋性和可塑性各方面影响的丰富信息。tau蛋白病模型会出现进行性运动障碍,这导致使用生理相关的老年动物进行研究变得困难。因此,作者使用特征明确的THY-Tau22小鼠系研究了突变型人类4R Tau的聚集如何影响不同年龄清醒行为小鼠的空间记忆和神经元协调。
该品系从2~3月龄逐渐形成pTau包涵体,并且比相关品系的表型更轻,这是研究pTau在老年小鼠中的累积效应的理想方法。重要的是,杂合子转基因(tg)小鼠和它们的非转基因(ntg)同窝小鼠在衰老过程中不会出现显著的运动障碍,这使得行为学测试和清醒的活体电生理记录成为可能。tg小鼠表现出明显的神经原纤维缠结(人类pTau在体细胞中积累)和神经纤维网线(pTau在轴突等其他过程中)。本文中作者发现,预期寿命正常的老龄tg小鼠有海马神经变性,表现出高放电锥体神经元减少,并表现出对空间线索的短期熟悉度降低,伴随着pTau从神经元扩散到少突胶质细胞。尽管有这些变化,神经元耦合到θ振荡和空间记忆能力没有明显的差异。作者推测这是由于控制皮质神经元协调的未受损网络机制所致。
pTau在衰老小鼠中的分布
为了了解pTau聚集如何影响神经元和神经活动,作者首先检测不同年龄的tg小鼠大脑中的pTau分布。在2-3个月大时,在背侧前下托(ProS),即海马背侧CA1(CA1d)和背侧下托(SUBd)之间的区域,观察到AT8免疫反应阳性(pTau+)的神经元簇(图1A)。CA1d(最接近ProS)和SUBd的远端部分在这个年龄出现很少的pTau+ 锥体神经元。ProS中pTau的表达强度在8个月后达到峰值,出现大量pTau+ 的体细胞(图1A和1B),与海马体依赖性记忆缺陷首次被观察到的时间相对应。相应的,在CA1d观察到更多的pTau+ 神经元,并向CA2扩散,在SUBd也相应增加。在老年小鼠(>16月龄)中,pTau的强度降低,可能是由于ProS和SUBd中的细胞丢失和较少的pTau+ 体细胞(图1A和1B)。
基于ProS和CA1的变化组合,作者将年轻小鼠定义为<8个月,衰老小鼠定义为8-16个月,老年小鼠定义为>16个月。在年轻小鼠中,pTau+ 齿状颗粒细胞在间隔极较少(稀疏pTau:n=4/5小鼠;中度pTau:n=1/5只小鼠),但在颞极常见(中度或广泛:n=3/6只小鼠;缺失或稀疏:n=3/6只小鼠)(图1A)。在衰老小鼠中,间隔极主要含有中度pTau(n=2/3小鼠; 稀疏: n=1/3小鼠)和颞极较广泛的pTau(n=2/3小鼠;中度: n=1/3小鼠)。在老年小鼠中,间隔极是可变的(中度或广泛:n=5/10小鼠;稀疏:n=5/10只小鼠),而颞极显示广泛的pTau(n=6/7只小鼠;稀疏:n=1/6小鼠;图1A)。颞侧(腹侧)CA1和CA3的pTau水平也随着年龄的增长而逐渐增加。
海马结构之外最突出和最早的部位是基底外侧杏仁核,在2.5个月时显示出中度的pTau,在>4.5个月时在所有动物中显示出广泛的pTau。内侧前额叶皮层显示出适度的pTau。内嗅皮层在所有年龄段都具有相似的适度pTau水平。在等皮质区,pTau主要分布在第5层附近,直到生命后期仍保持稀疏(图1C)。在ntg同窝小鼠中,未观察到pTau。在所有老年小鼠中检测到脂褐素荧光。综上所述,海马结构、等皮质和杏仁核的分布在很大程度上证实了之前的报道。
与前面描述的神经元pTau分布相反,与θ频率节律活动产生相关的关键皮层下区域未受影响,包括丘脑前部和中线、中间隔(图1D)、乳头体和乳头上核。下丘脑和基底神经节的其他区域也基本不受影响。在中脑,神经元pTau在红核、上丘深层、中脑导水管周围灰质和脑桥核中发现,但在大脑中中缝核、腹侧被盖区、黑质或髓间核没有发现。中脑多巴胺能(酪氨酸羟化酶免疫反应)神经元缺乏pTau。此外,pTau+ 轴突在伞、穹窿、侧隔和丘脑网状核中突出,最可能起源于受影响的海马/皮层神经元(图1D)。
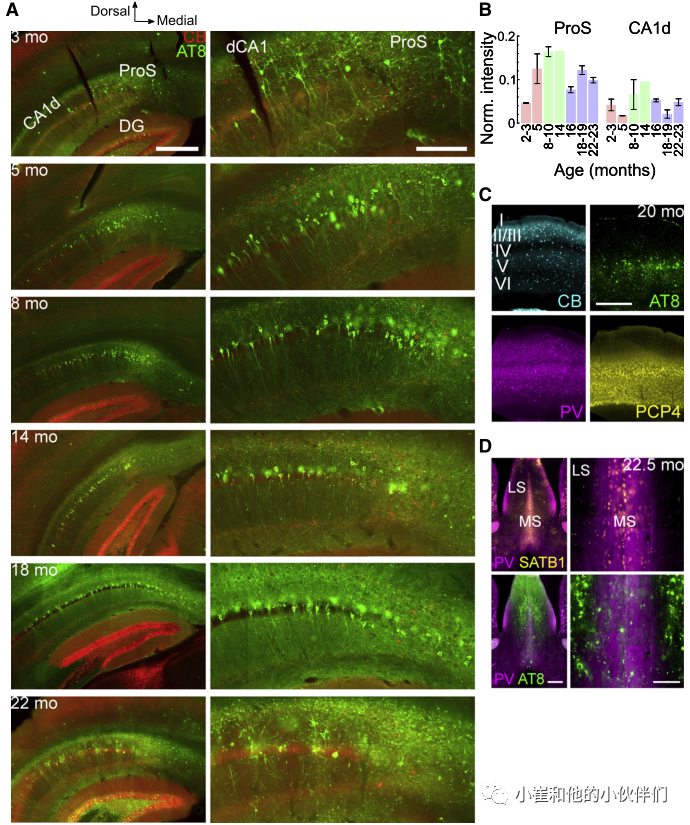
图1. THY-Tau22小鼠中pTau的年龄相关性增加
pTau首先在深层CA1锥体神经元积累
海马CA1区对空间/情景记忆至关重要。含有pTau的神经元对COUP tf1相互作用蛋白2(CTIP2),富含AT序列结合蛋白2(SATB2)和Wfs1蛋白具有免疫反应性,这些都是CA1区锥体细胞的标记物(图2A-2C)。与附近未受影响的神经元相比,Wfs1的免疫反应性极低,并局限于质膜(图2C),表明pTau影响Wfs1水平。
锥体层(SP)的上部致密亚层主要由钙结合蛋白免疫阳性(CB+)神经元组成,下部亚层神经元大多为CB免疫阴性。有趣的是,大多数pTau+ CA1 SP神经元位于深亚层,是CB-(图2D)。pTau+ 的细胞缺乏小白蛋白(PV)和钙视网膜蛋白(CR)免疫反应性,它们可能是GABA能神经元的亚群。在ProS,大多数pTau+ 细胞缺乏CB。作者通过电子显微镜观察证实了锥体神经元中的pTau,并且pTau定位在轴突末端(图2E)。因此,pTau优先在CB-中的锥体神经元积累。
之前有证据表明,12个月龄的tg小鼠CA1细胞普遍丢失。为了确定这是否是由于锥体神经元的丢失造成,作者沿着CA1d SP计数SATB2+核;在CA2或ProS/SUBd锥体神经元中未检测到SATB2。在老年小鼠中,CA1 SP明显变薄,尤其是向ProS方向观察到最丰富的pTau包涵体(图1A、1B和2F–2H)。与年龄匹配的ntg小鼠相比,老年tg小鼠的锥体细胞更少(图2H)。相比之下,年轻小鼠的CA1 SATB2+ 细胞核没有差异。有趣的是,作者在衰老小鼠中未发现CA1 DAPI+细胞核计数的差异。因此,作者认为pTau在锥体神经元中积累最终导致老年小鼠的退化。
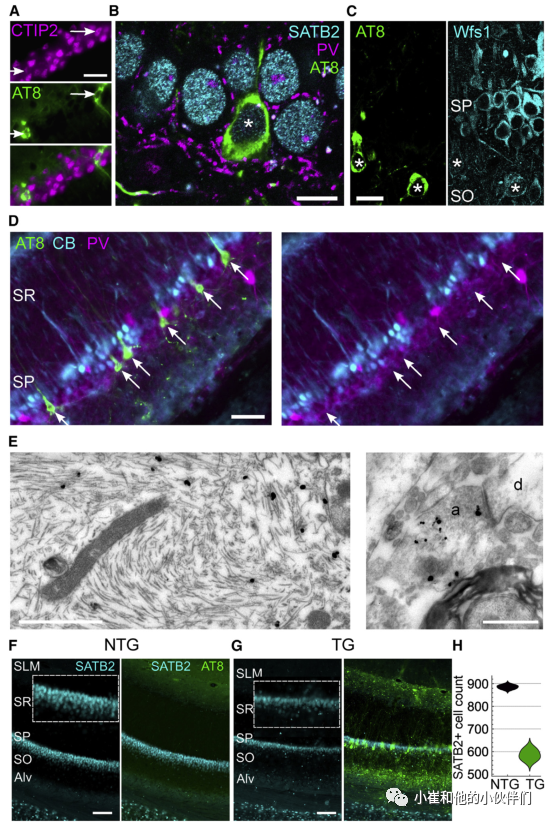
图2. pTau在深层CA1锥体细胞中的优先积累
pTau从锥体神经元向少突胶质细胞扩散
作者在年轻的tg小鼠中观察到pTau在许多脑区特别是在含有pTau+ 轴突的白质束中呈高度AT8免疫反应的“类火焰”环,使用电子显微镜确认了少突胶质细胞中存在pTau+ 丝束(图3E)。
在老龄和老化的tg小鼠中,而非在年轻的tg小鼠中,作者在许多脑区,尤其是包含pTau+轴突的白质束中(图3)观察到螺旋体-强烈AT8免疫反应的“火焰样”pTau环,如伞、穹穹、肺泡、海马背侧连合、胼胝体和终纹。螺旋体也出现在海马定向层、下复合体、颗粒状压部后皮质、等皮质、背侧纹状体和侧隔,外观与阿尔茨海默病中发现的螺旋体相似。前丘脑和乳头体有散在的螺旋体。在脑干,黑质网状部、腹侧被盖区、脑桥核和脚间核含有螺旋体,这是CBD和PSP等4R tau蛋白病的病理表现。螺旋体与少突胶质细胞转录因子olig2共定位。与olig2免疫反应性细胞核相关的较小的螺旋体(直径<2mm)可能代表密集的pTau。在pTau+ 神经元中未观察到Olig2。电子显微镜观察证实了少突胶质细胞中存在pTau+ 纤维束(图3E)。据作者所知,Thy1启动子在少突胶质细胞中不活跃。尽管在所有年龄段的神经元中都有pTau的积累(图1),但年轻的小鼠中没有观察到螺旋体,因此作者认为pTau是通过含pTau的轴突从神经元扩散到少突胶质细胞(图3)。
图3. pTau在少突胶质细胞中的积累
短期熟悉度降低但空间记忆未受损
为了评估pTau积累对神经退化的行为影响,作者使用Y迷宫评估了短期海马依赖的空间记忆变化(图4A)。两种基因型小鼠的活动总距离类似(图4A),表明tg小鼠活动没有明显改变。区分率(使用novel的时间除以novel和其他两组的总时间)显著不同(图4A)。正如野生型动物所预期的那样,这可以通过ntg小鼠在新臂停留的时间比偶发时间更长来解释。Tg小鼠不能辨别,这与之前的研究报道的年轻Tg小鼠的空间新颖性偏好受损一致。为了评估空间记忆,作者对14月龄小鼠进行海马依赖性水逃逸Y迷宫任务测试(图4B)。两种基因型的小鼠都找到隐藏平台的位置。结果表明空间记忆并未受损。为了进一步明确,在非匹配的T迷宫任务中测试了空间记忆(图4C)。Tg小鼠在习得训练中的表现与同窝ntg小鼠类似。第11天,作者拆除隐藏平台,让小鼠自由游泳60s。两种小鼠同样没有差异。综上,本实验未能检测到空间记忆缺陷。
作者在不匹配的t迷宫中测试空间记忆。在轻度食物限制条件下(自由进食体重的90.7%),分别在第4、7和12月龄时对小鼠进行了测试。小鼠的行为表现随着训练而改善,独立与年龄和基因型,各区块的总体表现相似,在所有年龄段,正确交替选择跑步的效果都有所改善(图4C)。所有训练都是在同一背景下进行的。其中,一个队列的ntg和tg小鼠在13个月时在不同的环境中重新测试。两种基因型的小鼠在第五个区块时接近高交替得分。
在T迷宫训练中,作者注意到许多小鼠会在开始臂的末端等待,然后自愿开始跑步。而tg小鼠在开始选择跑步之前等待的时间明显长于ntg小鼠(图4D)。强制运动也是如此,这表明选择的延迟与决策没有直接关系。尽管ntg和tg小鼠在第一次实验中有相似的延迟时间,但它们在随后的几天内迅速分化。一旦小鼠离开起始臂的末端,实际活动时间就相似。总之,尽管在这项任务中没有检测到空间记忆障碍,但tg小鼠启动强制跑和选择跑都花了更长的时间。
将小鼠置于高架迷宫中进行无条件焦虑的行为学测试,野生型啮齿类动物倾向于在封闭的手臂上花费更多的时间,而在腹侧海马损伤的大鼠中,在开放的手臂上的时间增加;该区域也富含pTau。在幼鼠(3月龄)中,与ntg小鼠相比,tg小鼠在开放臂停留的时间比例显著增加,这与之前报道的6月龄小鼠的结果一致。手臂入口也有细微的差别(图4E)。在另一组12月龄小鼠中,ntg小鼠的开放臂停留时间为46.9%,而tg小鼠的开放臂停留时间为75.2%(图4E)。综上所述,作者得出结论,pTau聚集影响短期熟悉和焦虑相关的活动,但不影响空间记忆。
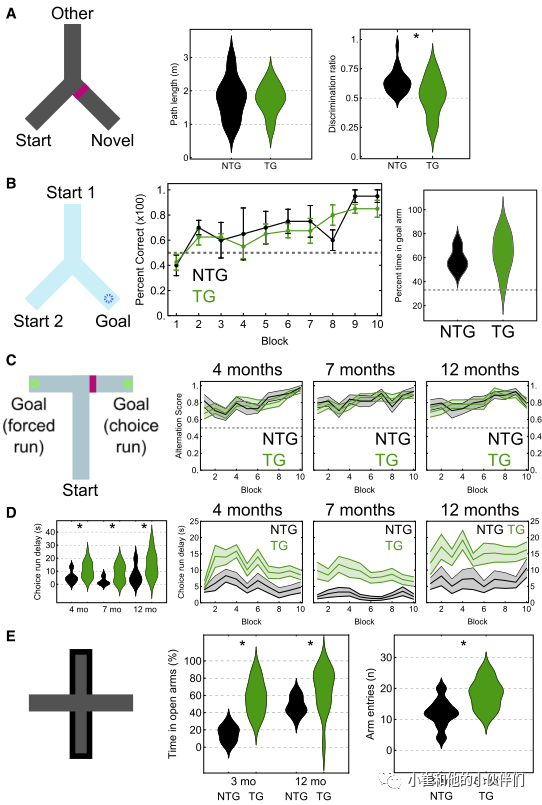
图4. 空间新颖性偏好的选择性障碍
在海马pTau存在的情况下,网络振荡得以保留
为了确定细胞内pTau是否影响神经元和网络活动,作者使用玻璃电极记录清醒的头部固定和自由活动小鼠的网络振荡和海马形成中的单个神经元。首先聚焦于5-12Hz的θ振荡,这反映了空间记忆所需的神经元活动。17~24个月的小鼠固定头部在跑步盘上跑步时,观察到显著的θ振荡(图5A),慢速和快速运动的ntg和tg小鼠θ频率值峰值类似。在另一种不同的环境中,训练限制饮水的老年小鼠(22-24个月)在沿虚拟线性轨道的空气悬浮喷射球上跑步,两种基因型的θ峰也相似(图5A)。这些数据表明振荡θ频率不受pTau的影响。
为了更密切地研究潜在网络变化,作者使用经验模式分解(EMD)比较了局部场电位(LFP)的频谱含量,这更适合于非线性非平稳信号。在老龄小鼠(18-24个月)中,作者采样了用玻璃电极和硅探针记录的上述运动时期的LFPs,并使用掩蔽EMD获得固有模式函数。θ对应的IMF6(图5C),在ntg小鼠中平均瞬时频率为7.3±0.4Hz,在tg小鼠中为6.9±0.2Hz。作者检测到慢-γ(IMF4)、中-γ(IMF3)和快-γ(IMF2)振荡(图5C和5D),两种基因型小鼠的分布相似。
在啮齿动物和人类中,较高频率的振荡通常与较慢的振荡相耦合。在轻度认知障碍和阿尔茨海默病中的相位-振幅耦合(PAC)受损被认为与小鼠模型中的pTau相关。中γ射线与CA1浅顶树突的内嗅输入有关,在啮齿类动物的θ周期峰值时在CA1d SP中可检测到。尽管存在神经变性和pTau(图2F–2H),但在年龄大的两组基因型小鼠中检测到更高振幅的中伽马振荡(图5E)。
作者发现在纹波频率、纹波持续时间或纹波周期计数方面,ntg和tg小鼠之间没有差异。这表明采样的CA1d SWR不受pTau的影响。总之,对网络振荡的分析表明,海马中的神经元协调未受损,这与海马依赖性空间和记忆的良好表现一致。
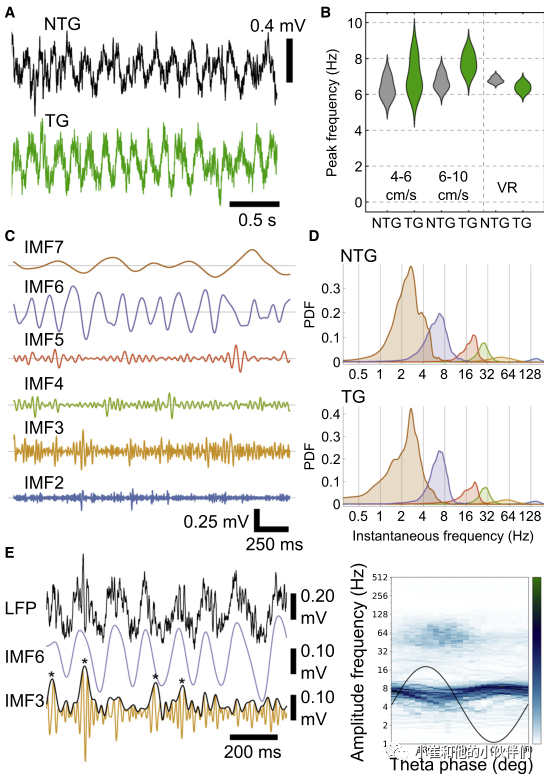
图5. tg和ntg小鼠的海马网络振荡相似
清醒tg小鼠记录的单个海马神经元
在确定局部pTau不影响网络活动之后,作者接下来研究pTau是否破坏了单个神经元的活动。为了直接比较pTau+ 和pTau- 神经元,作者使用玻璃电极在头部受限和自由活动的小鼠的海马形成中进行了细胞外记录,然后进行了细胞旁标记(图6)。作者的目标是早期就含有高水平pTau+ 的ProS。从47个记录的神经元(n=8老龄tg小鼠,n=3老龄tg小鼠,n=1年轻tg小鼠;6~28个月),共恢复9个神经元(锥体神经元6个,中间神经元3个)。
作者检测了8例AT8(pTau),结果均为免疫阴性(图6D和E)。作者还在ntg同窝小鼠和WT小鼠中记录了20个单个神经元(来自5只年轻小鼠,1只衰老小鼠和1只老年小鼠;6~18个月),2个锥体神经元和1个中间神经元恢复正常(图6A和B)。在tg和ntg小鼠中鉴定的锥体细胞均为CTIP2免疫阳性(图6B和6E),与pTau+ 细胞的谱图相匹配(图2A)。
在自由移动和头部固定条件下,所有年龄的两种基因型的锥体神经元都被相对较宽的孤立尖刺和复杂尖刺(CS)爆发所识别(图6A和C)。根据记录和标记的神经元的位置、形状和神经化学特征(图6A-6E),作者可以有把握地将带有CS爆发的未标记神经元分类为假定的锥体细胞,与已发表的数据相匹配。玻璃电极记录了锥体神经元具有典型的平均放电率分布,由大多数低放电细胞和少数高放电细胞组成,在不同年龄组中广泛重叠(图6F)。两种基因型具有相似的低发射率(图6F)。标记(已识别)和未标记(推定)中间神经元的放电率通常高于主细胞,缺乏CS爆发,表现出一系列有规律的爆发活动和节律性放电模式。不同基因型的激发率也相似。总的来说,在tg小鼠中记录的主细胞和中间神经元的放电频率的采样范围与ntg同窝小鼠和其他WT小鼠相似(图6G)。
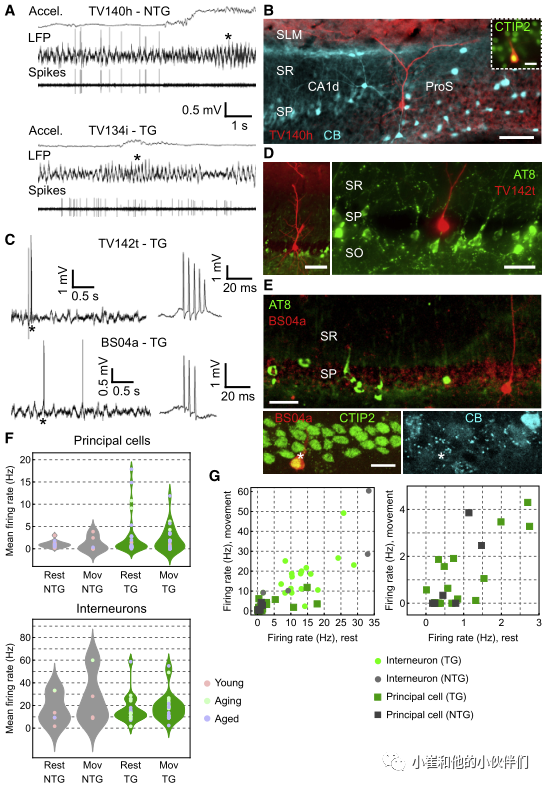
图6. 海马神经元与pTau的关系的鉴定
老龄tg小鼠在目标定向导航过程中高放电锥体神经元减少
接下来,作者研究了当小鼠参与目标导向导航任务时,pTau是否影响神经元活动。作者训练受水限制的头部固定的老年小鼠在空气悬浮的喷射球上沿着一条虚拟的直线轨道奔跑,以获得水奖励。16只老年小鼠(其中9只曾用于空间记忆测试)中,11只可以成功训练,以稳定的步态跑到尽头。对于具有良好覆盖率的试验,小鼠具有相似的试验持续时间。
在这项任务中,作者用急性硅探针记录ProS多个单元的活动。记录了308个单元,将147个单元定位于ProS/SUB,将161个单元定位到相邻的CA1d。首先,比较了所有具有CS的单位(假定的锥体细胞)的放电率,把记录的锥体神经元和标记模式对比相匹配(图6)。基因型或记录区域之间的平均发射率没有差异(图7A)。然而,作者发现基因型和区域之间的相互作用存在显著差异(图7B)。这些数据表明不同基因型的小鼠高放电神经元在ProS/SUB的分布也有显著差异,但CA1中并差异不大(图7B)。这些结果表明,在老年tg小鼠中ProS/SUB中存在较少的高激发细胞。
先前的研究设置了放电速率阈值,以帮助从高放电中间神经元分离假定的锥体细胞(假定为低放电)。当将低放电ntg和tg CA1 CS单位(平均发射率<3Hz)与从在同一喷射球上执行类似任务的年轻WT小鼠获得的单独数据集进行比较时,作者发现放电率没有差异(图7C和D)。这表明,对于低放电锥体细胞亚群,老年小鼠的放电率分布与年轻小鼠相似。前面已将ProS、SUB和CA1中的锥体细胞标记为高激发(>3Hz)CS细胞(图6),因此作者认为高激发ProS/SUBd锥体细胞,其可能具有不同于其他细胞的特殊作用,所以在tg小鼠中优先丢失,留下低激发CS细胞。
接下来比较缺乏CS(假定的中间神经元)的单元放电率,与一些记录的和标记的中间神经元的分布相匹配。与CS细胞相比,不同基因型、区域或它们之间的相互作用在放电率方面没有显著差异(图7A)。不同基因型的CS单位与非CS单位的比例也相似(图7A)。
作者还研究了tg小鼠中高激发ProS/SUB CS单位的减少是否影响位置细胞(代表虚拟线性轨迹的不同位置)的相对比例(图7C和7D)。48只ntg和tg小鼠的位置细胞比例相似。在虚拟走廊的不同位置观察到地点场所,有部分与奖励相关(图7C和7D)。一些单元在奖励期后表现出同步放电(图7D)。这些数据表明,在这些衰老的tg小鼠中,位置细胞的定位被保存下来。
老年小鼠中θ节律的保持
鉴于作者没有检测到θ振荡或其他相关光谱成分的任何主要差异(图5),作者假设尽管存在广泛的pTau,老年tg小鼠中的剩余神经元将保持其θ耦合。事实上,来自tg小鼠的单元与θ耦合,并且可以在重叠位置场中的单个θ周期上变得同步(图7D、7E)。对于CS单位,来自ntg小鼠的95%和来自tg小鼠的86%显著θ耦合(图7C-F)。在不同基因型或脑区之间,θ耦合没有差异(图7E)。ntg和tg小鼠的最强耦合CS单位分别为r=0.47和r=0.64;两者均在SUBd内发现。作者还发现,与放电速率相关的耦合分布没有差异(图7F)。
老年tg小鼠的相位分布(扩散)更大。此外,对于具有<3Hz的发射速率和显著相位耦合的θ,耦合强度与从较年轻的WT小鼠获得的数据没有差异。此外,对于放电速率<3hz且相位耦合显著的θ-耦合CS单元子集,耦合强度与从较年轻的WT小鼠获得的数据没有差异。对于非CS细胞,94%的ntg小鼠和85%的tg小鼠与θ振荡显著耦合。与CS单位一样,非CS单位在基因型之间的耦合强度(图7E)或耦合与放电率的分布(图7F)没有差异。然而,作者在ProS/SUB和CA1区检测到显著不同的耦合,这表明CA1中的中间神经元整体上耦合更强。对于CS单位,非CS单位的相位分布在老年tg小鼠中也更大。总之,作者在老年ntg和tg小鼠中检测不到θ相位耦合的差异。
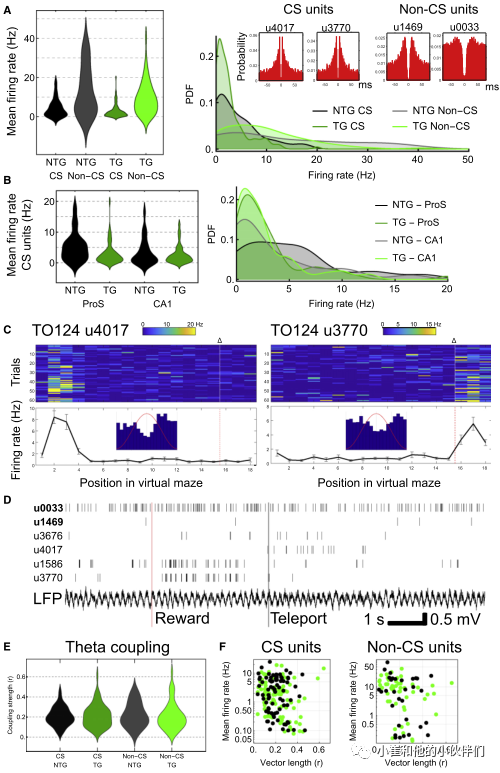
图7. 老年tg小鼠失去高强度的复杂尖峰细胞,但θ偶联正常
讨论
与之前的报道及Thy1启动子驱动的4R-Tau系一致,作者发现pTau的进展与年龄相关。作者进一步绘制了长达28个月的pTau分布图,发现了深层Wfs1+/CB-海马锥体神经元优先积累pTau,随后发生神经变性。pTau+ 锥体细胞中跨膜糖蛋白Wfs1的明显下调可能与其调节内质网(ER)中错误折叠蛋白降解的作用有关,这突出了神经退行性变的易感性。少突胶质细胞开始出现pTau+,并与pTau+ 白质束相关。作者认为海马结构中广泛的Tau病理和高灌注ProS细胞的丢失导致了特定的短期熟悉度的缺陷。但没有检测到网络振荡或θ耦合的损伤,tg和ntg小鼠的空间记忆能力相似。
Tau向少突胶质细胞扩散的机制和后果
在少突胶质中发现的pTau+ 螺旋体与PSP、CBD和阿尔茨海默病中的类似,可能是4R pTau过度产生的特有特征。螺旋体可能促进pTau在人体内的繁殖,因为接种了来自tau病模型小鼠或患者的pTau的小鼠可以通过少突胶质细胞扩散。这使得THY-Tau22小鼠成为PSP和CBD的一个有用的模型。因为Thy1是神经元特异性的,作者认为轴突内的pTau直接传播到少突胶质细胞。少突胶质细胞中的Thy1在年轻动物中被抑制,检查老年Thy-GFP小鼠的GFP+ 少突胶质细胞可能有用。
含有pTau的少突胶质细胞沿着纤维束,进入轴突膜和邻近Ranvier节的髓磷脂之间的旁节间隔状连接处,然后扩散到细胞体。在MAPTP301S tau蛋白病模型中,新的少突胶质细胞在认知缺陷发作前5-6个月增加,这被认为是对髓磷脂早期丢失的补偿。而少突胶质细胞前体细胞的破坏会导致记忆障碍。
相反,老年小鼠少突胶质细胞生成的促进记忆改善。在THY-Tau22小鼠中,髓磷脂产生的破坏可能影响动作电位的传播。有髓卫星少突胶质细胞与神经元胞体紧密相关,并与星形胶质细胞和其他少突胶质胶质细胞电耦合。因为已经观察到pTau+ 锥体神经元附近的螺旋体,以及老年tg小鼠中较少的高放电锥体细胞,灰质少突胶质细胞的破坏也可能降低高放电活性,并影响刺突的启动和繁殖。因为没有在由大量pTau+ ProS/SUBd/CA1d锥体神经元支配的区域观察到pTau,ProS投射到杏仁核,且这两个区域都富含pTau,证明pTau是不太可能前向跨神经元扩散的。
未受影响的皮层神经元协调和空间记忆
MS的θ偶联的爆裂GABA能神经元投射到颞皮层,MS失活降低了皮层θ功率并损害了空间记忆。而pTau破坏MS胆碱能神经元也会导致记忆缺陷,据报道,THY-Tau22小鼠存在胆碱能缺陷。选择性失活大鼠丘脑前或腹中核也会导致空间记忆损伤;这些核中的有几个还包含θ节律神经元,并投射到颞皮质区域。因为在MS或丘脑中并没有检测到pTau+神经元,这可以解释为什么在以pTau为主的CA1-SUB中,θ耦合神经元、θ峰值频率、IMF和交叉频率耦合在两种基因型中具有大致相似的分布。作者在不同年龄段进行了纵向行为测试,这个行为学环境已经被明确可以延迟记忆缺陷的发生。
此外,空间学习可以导致神经保护性少突胶质细胞生成,许多动物的行为测试被用于神经生理学记录。先前的研究报告称,tg小鼠早在3个月就出现了缺陷,9-10月龄的tg小鼠在水迷宫中寻找隐藏平台的时间更长,同时发现它们的腿部运动增加。通过使用水逃逸Y迷宫将这种潜在误差减至最小,结果表明tg小鼠的空间记忆没有受损。总之,未受损的海马神经元协调性解释了正常海马依赖性空间记忆表现的原因。
短期熟悉度的降低
如先前在年轻小鼠中所示,在自发的空间新奇偏好Y迷宫中13月龄的tg小鼠未能区分海马依赖性的新臂和其他臂。这表明在识别迷宫外空间线索的相似性方面存在缺陷,而这正是空间新颖性偏好所需要的。空间记忆的编码和回忆涉及不同脑区内和不同脑区之间顺序神经元活动的协调。与CA1相比,SUBd包含更多种类的空间调制神经元,包括头部方向细胞、边界向量细胞、网格细胞以及位置细胞,与CA1不同,SUBd从丘脑前部直接接收谷氨酸能输入。
由于高pTau水平导致ProS/SUBd中高灌注神经元的丢失,提示编码不同特征的神经元序列可能被破坏。短期熟悉度的降低也可以解释为什么tg小鼠在开始跑步之前在T型迷宫的起始臂中花费的时间更长:可能是因为ProS/SUBd活性的降低,放置在起始臂中对小鼠来说保留了一些新鲜感。
最后,无论是年轻的还是年老的tg小鼠,在高架迷宫中都会在张开的双臂中度过更长的时间。早期在腹侧海马体和相互连接的杏仁核也发生Tau病理,在tg小鼠的一生中都观察到了这种病理。此外,大鼠腹侧海马的损伤改变了与焦虑相关的情境行为,但不改变空间学习。综上所述,空间熟悉度的变化可能由pau富集的ProS/SUBd中不同类型的空间调节细胞的潜在缺陷所解释。
Tau对已识别神经元的影响
在单个记录和标记神经元中缺乏pTau,但不知道pTau如何影响体内放电。在目标定向导航过程中,老年tg小鼠较高放电的ProS锥体细胞较少。除了衰老小鼠的神经变性和pTau+少突胶质细胞可能破坏动作电位传播外,锥体神经元内的局部pTau积聚也可能导致放电率降低,从而导致分布向较低速率转移。目前还没有关于特异性积累pTau的单个海马神经元体内放电的报道。
在rTg4510τ病变模型中,小鼠的膜电位振荡较慢,放电率降低,但仅报道了一个标记的pTau+新皮质神经元。至12个月大rTg4510小鼠的体内钙显像显示麻醉状态下活性降低。这些较低的活动水平可能这可归因于高激发细胞的实际损失,将种群转移到低激发细胞。需要将pTau含量与成像/记录的神经元相匹配,以测试pTau对神经元活动的影响。异常的θ和γ振荡,在三只雄性3xTg小鼠中,与WT小鼠相比,海马位置细胞的放电率降低,位置场稳定性降低,空间信息减少,突变体Tau与诱导的淀粉样蛋白β斑块和潜在的海马外转基因表达可能导致3xTg模型中的缺陷。倾斜的放电率分布是大脑的一个共同特征,高放电少数群体具有关键作用,倾向于更紧密的联系,并能够在不同的背景下进行概括。增强的高放电细胞的丢失可能会导致放电率分布总体上向较低的中值偏移。
在急性切片中,尽管老化tg小鼠的突触兴奋性较低,但tg和ntg小鼠的CA1的长期增强作用相似。需要对老化小鼠进行长期高密度记录,以确定低放电细胞的突触可塑性是否在很大程度上补偿了高增强突触的损失。对空间导航的影响可能是,由于失去了“泛化”的高激发神经元,小鼠需要更长的时间来识别空间环境。尽管如此,由于神经元协调性未受损(如θ振荡期间的尖峰时间),空间记忆本身得以保留。阿尔茨海默氏病、FTDP、PSP和其他Tau病在一些皮层下区域(如丘脑和脑干)表现出Tau病理,这可能会导致记忆缺陷。总之,我们对THY-Tau22小鼠系的详细表征结果表明,因为未受影响的神经元系统的控制,尽管存在广泛的海马Tau病理学、少突胶质细胞对pTau的摄取、神经变性和高激发ProS/SUBd细胞的丢失,但许多测量的功能参数和行为仍与年龄匹配的对照动物非常相似。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






