Nature子刊:AAV病毒基因治疗艾滋病的首次临床试验结果公布
2022-04-12 生物世界 生物世界
这项研究表明,AAV 载体可以在体内持久产生具有生物活性、且难以诱导产生的广泛中和抗体,这位抗击艾滋病等传染性疾病增加了新的有力工具。
艾滋病(HIV)是获得性免疫缺陷综合征的简称,由感染HIV病毒引起。HIV是一种能攻击人体免疫系统的病毒,它把人体免疫系统中最重要的CD4+T细胞作为主要攻击目标,大量破坏该细胞,经过数年、甚至长达10年或更长的潜伏期后发展成艾滋病病人,使人体丧失免疫功能,因抵抗力极度下降会出现多种感染,后期常常发生恶性肿瘤,以至全身衰竭而死亡。
据联合国艾滋病规划署数据,目前全球范围内现存HIV携带者和艾滋病患者人数高达3800万人,且数量仍在快速增长中。
2022年4月11日,美国国立卫生研究院(NIH)的研究团队在国际顶尖医学期刊 Nature Medicine 上发表了题为:Safety and tolerability of AAV8 delivery of a broadly neutralizing antibody in adults living with HIV: a phase 1, dose-escalation trial 的研究论文。
诱导产生广泛中和抗体(bnAbs),是预防和治疗艾滋病的利器。该研究对8名感染了 HIV 的患者进行 AAV 病毒介导的基因治疗,通过 AAV 病毒递送编码强效广泛中和抗体(bnAbs)的 DNA,能够在体内长效产生广泛中和抗体,为艾滋病等疾病治疗带来新的有力工具。这也是首次通过 AAV 递送在人体内产生单克隆抗体。

该研究招募了8名感染了HIV的患者,他们接受了至少3个月的抗逆转录病毒治疗。然后他们接受肌肉注射的 AAV8 递送的广泛中和抗体(AAV8-VRC07)治疗,治疗分三个给药剂量:5×10E10vg/kg、5×10E11vg/kg、2.5×10E12vg/kg。
这项1期临床试验,主要终点是评估 AAV8-VRC07 治疗的安全性和耐受性,确定体内的药代动力学和免疫原性,并描述患者对 AAV8-VRC07 载体及其产物的免疫反应。次要终点是评估 AAV8-VRC07 对 CD4 T 细胞计数和 HIV 病毒载量的影响,并评估参与者体内产生的广泛中和抗体的持久性。
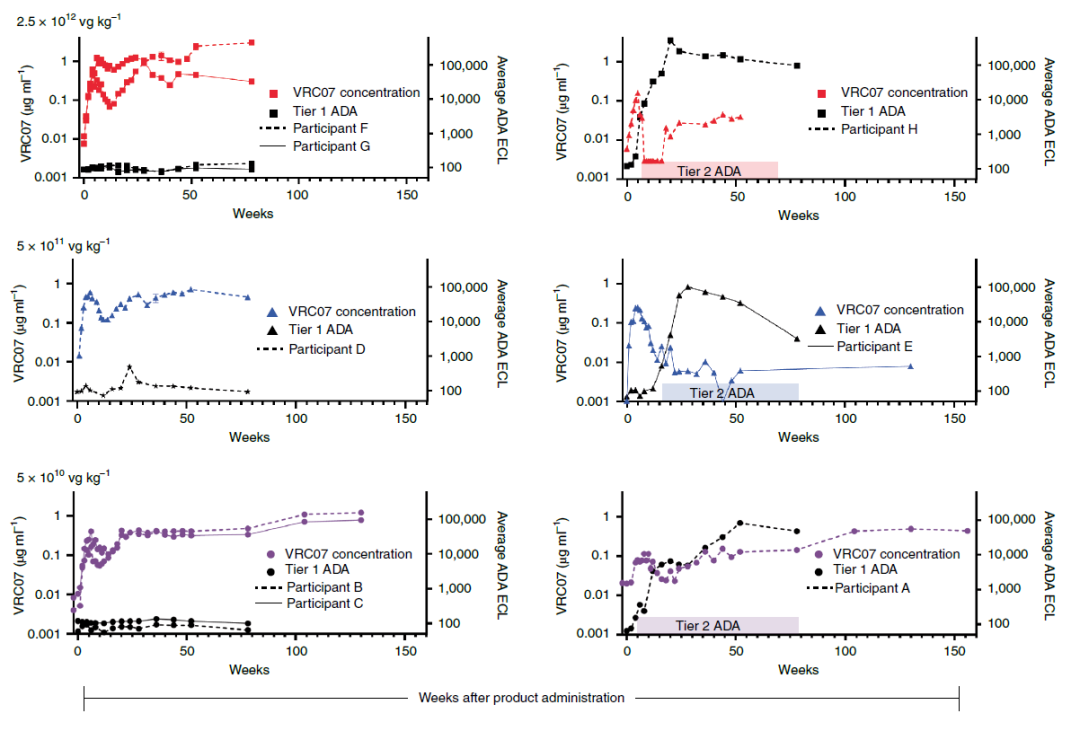
结果显示,肌肉注射 AAV8-VRC07 是安全的且耐受性良好。1-3年随访期间,患者 CD4 T 细胞计数或病毒载量未发生临床显著变化。8名患者在注射后第6周和第52周时广泛中和抗体均增加,8人都产生了可测量的血清广泛中和抗体,其中有3人的最大抗体浓度超过1µg/ml。有4人的血清广泛中和抗体浓度在长达3年的随访中接近最大浓度并保持稳定。体内产生的广泛中和抗体的中和活性与体外产生的活性相似。
这项研究表明,AAV 载体可以在体内持久产生具有生物活性、且难以诱导产生的广泛中和抗体,这位抗击艾滋病等传染性疾病增加了新的有力工具。
更重要的是,这一 AAV 递送平台能够单次注射长时间产生抗体,可以使用 AAV 递任何所需的抗体的编码 DNA,从而用于治疗疟疾、新冠、艾滋病等各种传染性疾病,还可用作其他生物药的递送,治疗自身免疫病、癌症等各种疾病。
论文链接:
Safety and tolerability of AAV8 delivery of a broadly neutralizing antibody in adults living with HIV: a phase 1, dose-escalation trial .Nature Medicine.2022.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#结果公布#
54
#Nat#
36
#AAV#
44