【AJH】奥加伊妥珠单抗加入CLL和NHL异基因移植预处理的长期结局:MD安德森1/2期研究
2024-03-14 聊聊血液 聊聊血液 发表于上海
该研究评估在含苯达莫司汀、氟达拉滨、利妥昔单抗(BFR)的标准方案基础上加用INO治疗适合HSCT的B细胞CD22+淋巴系统恶性肿瘤患者的安全性和疗效
奥加伊妥珠单抗预处理
奥加伊妥珠单抗(Inotuzumab ozogamicin,INO)是人源化抗cd22单克隆IgG4抗体。CD22在超过90%的急性B淋巴细胞白血病和淋巴瘤患者中表达。在治疗复发/难治性B细胞非霍奇金淋巴瘤(NHL)的1期和2期试验中,INO单药或联合利妥昔单抗均显示出抗肿瘤活性和可控制的毒性。在1期研究中,INO的最大耐受剂量(MTD)为1.8 mg/m2,具有临床疗效和可接受的毒性。在另一项研究中,复发性急性B淋巴细胞白血病患者随机分配接受INO单药治疗或标准化疗,结果INO组的完全缓解(CR)率、总生存(OS)率和无进展生存(PFS)率更高。然而,肝静脉闭塞性疾病(VOD)是INO的主要不良反应,尤其是在接受异基因干细胞移植(HSCT)的患者中。如果患者接受含两种烷化剂的移植预处理,或在HSCT前胆红素水平升高≥正常上限,则有VOD风险。
INO在HSCT预处理中的安全性仍不确定,而谨慎选择预处理方案可能降低VOD的发生风险。因此MD安德森癌症中心Issa F. Khouri教授牵头开展了一项前瞻性研究,以评估在含苯达莫司汀、氟达拉滨、利妥昔单抗(BFR)的标准方案基础上加用INO治疗适合HSCT的B细胞CD22+淋巴系统恶性肿瘤患者的安全性和疗效,研究结果近日发表于《American Journal of Hematology》。

研究方法
该研究为研究者发起的单中心1/2期研究,纳入18 - 70岁、为耐药或复发的CD22+慢性淋巴细胞白血病(CLL)或NHL, ECOG 0-2和充足器官功能储备。其他要求包括有6/6HLA相合的同胞供者,或者如果没有同胞供者,则要求有HLA-A、HLA-B、HLA-C和DRB1相合无关供者。此外排除活动性中枢神经系统受累、既往暴露或已确诊INO难治性、入组研究前6个月内接受过自体移植、妊娠、母乳喂养以及已知感染HIV、人类嗜T淋巴细胞病毒或乙型或丙型肝炎病毒。其他排除标准包括胆绞痛病史,在研究注册前2年内并发其他恶性肿瘤(鳞状细胞癌或基底细胞癌除外),未控制的感染,在研究入组后6个月内发生卒中或心肌梗死,严重的内科或精神疾病,或者在研究注册前3周内使用其他研究药物。
作为预处理方案,在门诊通过静脉给药(IV)给予递增剂量的INO (第-13日,0.6、1.2或1.8 mg/m2)。INO治疗前口服对乙酰氨基酚650 mg,静脉注射苯海拉明25 mg,静脉注射氢化可的松25 mg。在第-5、-4和-3日,患者住院接受每日静脉注射氟达拉滨30 mg/m2和每日静脉注射苯达莫司汀130 mg/m2;在第-6日、+1日和+8日接受375 mg/m2利妥昔单抗治疗。第0天行HSCT。
移植物抗宿主病(GVHD)预防方案:他克莫司0.015 ~ 0.03 mg/kg静脉滴注,第-2天开始;甲氨蝶呤5 mg/m2静脉滴注,第+1、+3、+6天。接受相合无关供者(MUD)移植的患者在第+11天额外接受甲氨蝶呤5mg/m2,在-1和-2天接受兔抗胸腺细胞球蛋白1 mg/kg静脉滴注。无活动性GVHD的患者在HSCT后6个月开始他克莫司减量。从第+7天开始,以5 μg/kg/天的剂量皮下注射粒细胞集落刺激因子,直至中性粒细胞绝对计数>0.5X109/L且保持3天。患者按照机构指南接受抗生素、抗病毒药物和抗真菌药物的支持性治疗。为避免抗真菌药相关的肝毒性,患者接受卡泊芬净治疗直至第+30日,之后如果肝功能在正常范围内,则可根据HSCT标准治疗将治疗改为唑类药物。
主要终点是确定在CD22+淋巴系统恶性肿瘤患者接受HSCT时,INO与含烷化剂的BFR预处理方案联用时的安全性,次要终点为分析总生存期和无进展生存期。
此外还回顾性比较了本队列与一组复发性淋巴系统恶性肿瘤患者(n=56)的结果,这些患者在MD安德森接受相同的含烷化剂预处理(BFR)、HSCT和相同的GVHD预防,这些治疗是在之前发表的一项前瞻性研究 (www.clinicaltrials.gov。#NCT00880815)中进行的,于2009年4月1日至2013年2月22日开展。
研究结果
患者
2014.1.24-2.19.9.28共入组26例患者,其中6例(23%)进入1期研究:4例接受0.6 mg/m2 INO治疗,2例接受了1.2 mg/m2 INO治疗。所有患者均未出现剂量限制性毒性。其余20例(77%)患者进入2期研究,最大剂量为1.8 mg/m2。
患者特征见表1和表2。许多患者患有具有高危特征,最值得注意的是,46%的患者在进入研究时年龄≥60岁,42%的患者造血细胞移植特异性合并症指数(HCT-CI)≥3。疾病特征方面,在接受检测的9例CLL患者中,有7例(78%)检出TP53突变,其中4例单独检出TP53突变,3例同时检出其他突变。在接受检测的套细胞淋巴瘤(MCL)患者中,有25%检出TP53突变;此外在接受检测的6例MCL患者中,4例(83%)存在增殖率升高(Ki67染色≥30%),25%呈母细胞样特征。所有患者既往均接受过多线治疗。1例Richter转化患者对免疫化疗联合纳武利尤单抗难治。CLL患者移植前接受的小分子抑制剂包括伊布替尼(n=6;5例患者因难治性疾病停药,1例患者桥接移植)、idelalisib(2例;均为难治性疾病)、维奈克拉(n=5;均为既往伊布替尼难治患者)。此外,1例患者为CAR-T细胞疗法难治。8例MCL患者中有4例既往接受过伊布替尼治疗(2例进展,2例桥接移植)。入组时,18例(69%)患者达到CR, 7例(27%)达到部分缓解(PR), 2例(4%)达到疾病稳定。11例(42%)移植自HLA相合同胞,15例(58%)移植自MUD。

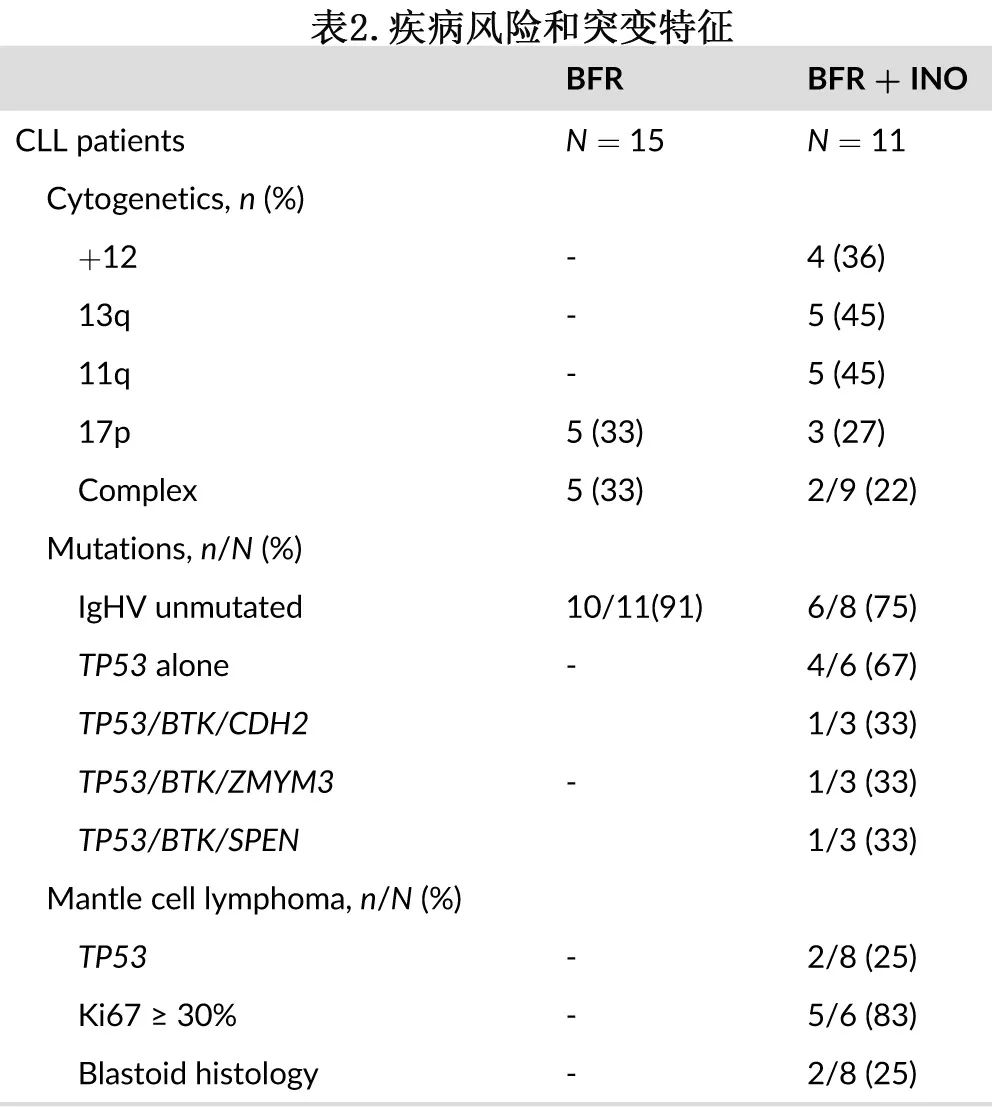
结局
所有患者在接受未经处理的供体移植物后均获得植入。中性粒细胞计数>0.5X109/L的中位时间为移植后6.5天,血小板计数恢复至>20X109/L的中位时间为0天。11例(42%)患者未出现重度中性粒细胞减少(ANC< 0.5X109/L),20例(77%)患者未出现血小板计数<20X109/L。所有患者均获得供者细胞植入,无继发性植入失败。截至+30日,中位供者髓系和T细胞比例分别为89%和99.5%,且在+90天都增加到100%。
生存患者中位随访48.7个月,5年OS率和PFS率分别为84%和80%(图1A)。7例PR患者移植后6例转为CR;1例SD患者HSCT后转为CR。不同组织学亚型的OS和PFS差异均无统计学意义。接受相合同胞供者移植的患者OS和PFS率为100%,而MUD分别为72% (p=0.06;图1B)和64% (p=0.03;图1C)。患者数量少而无法进行多因素分析。

具体到CLL队列,7例在研究开始时达到PR或SD,HSCT后7例中6例获得CR(1例HSCT后未达到CR的患者既往对化学免疫疗法、伊布替尼、idelalisib和CAR-T细胞疗法均难治);这6例CR患者中有4例有MRD结果,移植后中位19个时均为阴性,其中1例MRD-患者出现霍奇金淋巴瘤复发。4例CLL在进入研究时处于CR,3例在HSCT后接受了MRD评估,且在中位18个月时呈阴性;3例CR患者中有1例在研究开始时为MRD+。
安全性
大多数患者在移植后接受了至少4个月的随访,因此可评估GVHD。II-IV级和III-IV级急性GVHD累积发生率分别为27%和4%。广泛性慢性GVHD的累积发生率为50%。在相合同胞和无关供者之间,急性(p=0.92)或慢性GVHD (p=0.39)的发生率均无统计学显著性差异。
INO预处理未导致剂量限制性毒性。无一例患者发生黏膜炎或脱发。1例患者输注INO过程中出现2级腹痛,后缓解。接受INO治疗的患者肝功能毒性反应轻微(表3)。1例患者出现3级VOD;该患者在HSCT前接受了纳武利尤单抗治疗,同时发生了难治性超急性GVHD。
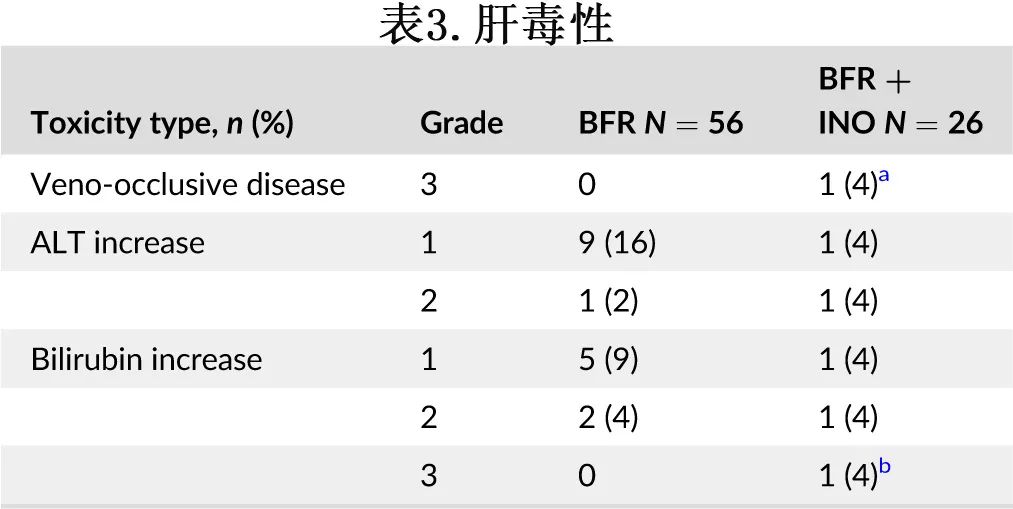
4例患者在30天内出现4级非血液学不良反应,但归因于移植过程而非INO本身;包括细菌感染(3例)和植入综合征相关的低氧血症(1例)。无5级毒性反应。所有毒性作用均消失。
4例患者在研究期间死亡,2例死于急性GVHD(包括上述1例VOD患者),1例死于慢性GVHD, 1例死于疾病进展。1、2和5年的治疗相关死亡(TRM)率为12%。
对照队列分析
正如方法部分所述,作者还将该队列与56例在MD安德森接受相同的含烷化剂的预处理(BFR)、HSCT和相同GVHD预防的复发性淋巴系统恶性肿瘤患者队列进行对比,两组之间的患者、疾病和移植特征相似(表1和2)。两组间植入时间或供者细胞比例无统计学显著差异,本研究没有观察到移植失败,而对照组有2例患者发生继发性移植失败。表3总结了肝毒性特征和发生率。
两组100天II-IV级和III-IV级急性GVHD发生率差异无统计学意义,但研究组2年广泛性慢性GVHD的发生率高于对照组(50% vs 25%,p=0.019),且50%的病例为新发型。两组的TRM率无统计学差异(12% vs 9%,p=0.67),但对照组存活患者的随访时间长于研究组(中位随访101.3个月 vs 48.7个月,p<0.001)。
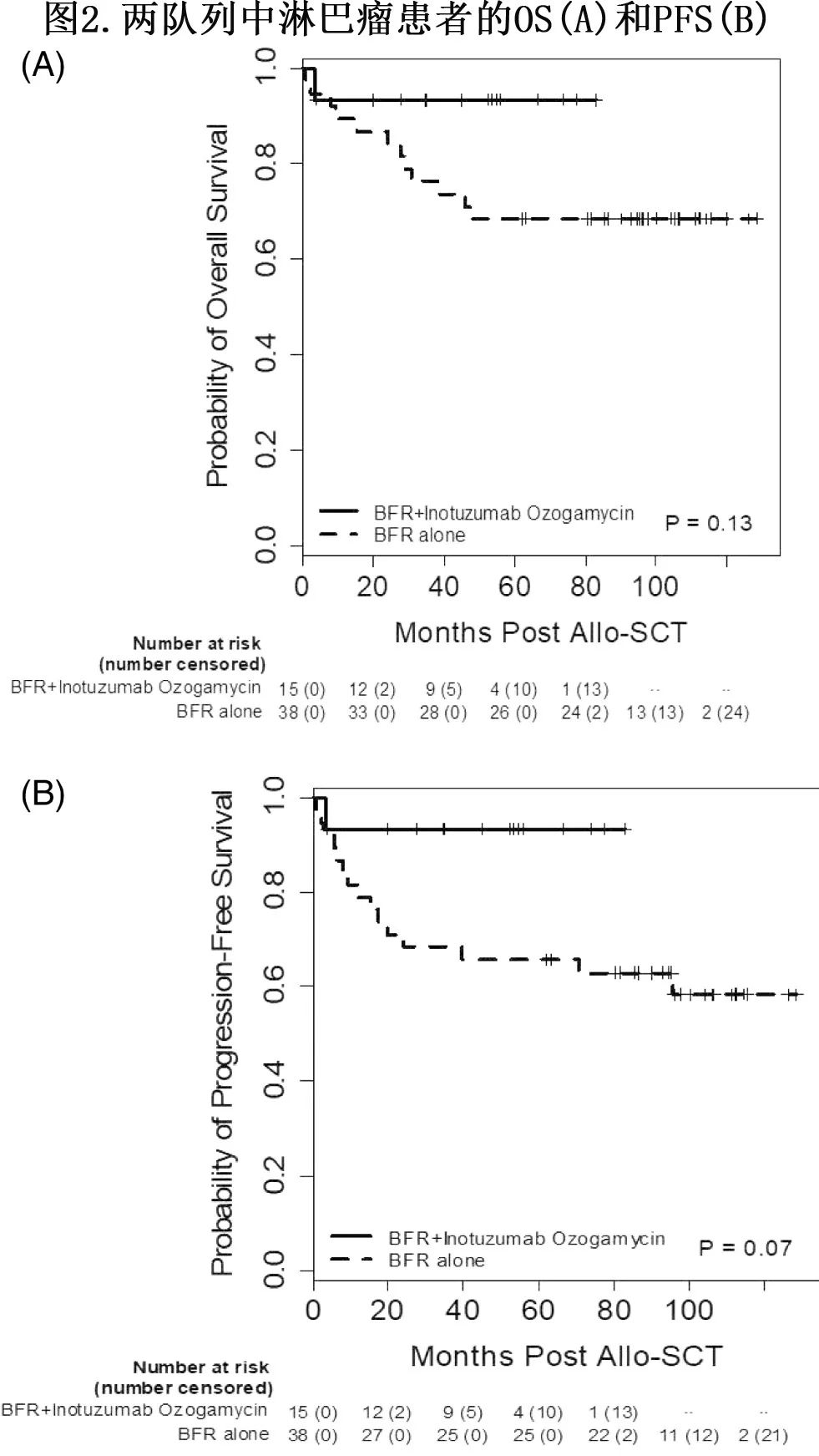
研究组和对照组的5年OS率和PFS率相似,但具体到淋巴瘤患者,研究组较对照组有更好的5年OS (93% vs 68%,p=0.13;图2A)和5年PFS(93% vs 58%,p=0.07;图2B)。该现象在CLL患者中没有观察到,研究组和对照组的5年OS和PFS分别为72% vs 93% (p=0.30)和62% vs 59% (p=0.73)。
总结
该研究报告了相关领域第一项前瞻性研究,评估了将INO作为含一个烷化剂预处理的一部分,用于接受HSCT的复发/难治性CD22+淋巴系统恶性肿瘤患者。共纳入26例患者,其中6例(23%)进入1期研究:4例接受0.6 mg/m2 INO治疗,2例接受1.2 mg/m2 INO治疗,这些患者均未出现剂量限制性毒性。其余20例(77%)患者进入2期研究,最大剂量为1.8 mg/m2。1例患者发生VOD,该患者在HSCT前立即接受过纳武利尤单抗治疗,同时发生超急性 (GVHD。5年TRM为12%。中位随访48.7个月,5年OS率和PFS率分别为84%和80%。与同期接受相同预处理但未接受INO的历史队列(n=56)相比,INO组在肝毒性发生率、植入时间、TRM和急性GVHD风险方面均无明显差异,且接受INO治疗的淋巴瘤患者有优于对照组的5年OS(93% vs 68%)和PFS(93% vs 58%)的趋势。
总的来说,对于接受HSCT的复发/难治性CD22+淋巴系统恶性肿瘤患者,在烷化剂预处理基础上添加最大剂量为1.8 mg/m2的INO是可行和安全的,未增加VOD风险,未发现剂量限制性毒性,骨髓抑制水平为轻度,大多数患者未发生重度血小板减少,约半数患者未发生重度中性粒细胞减少,仅1例患者出现3~4级非血液学不良反应。作者中心还在开展更多的研究,以进一步探索INO在其他疾病如需要HSCT的急性淋巴细胞白血病中的有效性和安全性。
参考文献
Khouri IF, Alzahrani K, Kantarjian H, et al. Safety and long-term survival results of the addition of inotuzumab ozogamicin to the conditioning regimen of allogeneic stem cell transplantation: A single-center phase 1,2 trial. Am J Hematol. 2024;1‐8. doi:10.1002/ajh.27254
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#奥加伊妥珠单抗# #慢性淋巴细胞白血病# #复发/难治性B细胞非霍奇金淋巴瘤#
18