Nat Rev Drug Discov:综述:星形胶质细胞在神经系统疾病中的作用及治疗价值
2022-10-24 王数 “神经周K”公众号
星形胶质细胞是异质性的。新的分子技术已经根据其分子特征和/或功能(促进或抑制CNS炎症或神经退行性变)确定了星形胶质细胞子集。
星形胶质细胞是中枢神经系统(CNS)中数量最多的胶质细胞,在健康和疾病中发挥多种功能。星形胶质细胞调节谷氨酸和离子稳态、胆固醇和鞘脂代谢,并对环境因素作出反应,这些都与神经系统疾病有关。星形胶质细胞也表现出显着的异质性,由发育程序和刺激特异性细胞反应调控星形胶质细胞在CNS中的位置和细胞-细胞相互作用。
2022年2月美国麻省理工学院和哈佛大学布罗德研究所Francisco J Quintana在nature reviews drug discovery期刊上发表的文章重点介绍了星形胶质细胞在神经系统疾病中的作用,以及其作为治疗干预靶点的潜力。此外,提出了星形胶质细胞亚群的简明命名法,强调星形胶质细胞特定亚群在神经系统疾病中的作用。
1
星形胶质细胞概述及分类
星形胶质细胞最早在19世纪由鲁道夫·维乔(Rudolf Virchow)提出。十年后,高尔基(Camillo Golgi)用铬酸银染色技术将星形胶质细胞的形态可视化,提出了胶质细胞充当大脑“胶水”的概念。星形胶质细胞很快被分为两种基本形态亚型:原生质型(protoplasmic)和纤维型(fibrous)。原生质星形胶质细胞主要出现在灰质,纤维状星形胶质细胞则普遍存在于白质中。卡哈(Santiago Ramón y Cajal)采用了这些亚型,并进一步揭示了人类小脑中星形胶质细胞的不同形态。
星形胶质细胞是异质性的。新的分子技术已经根据其分子特征和/或功能(促进或抑制CNS炎症或神经退行性变)确定了星形胶质细胞子集。这些亚群分为两类:发育程序驱动的星形胶质细胞亚群(DIA亚群),刺激诱导的星形胶质细胞亚群(SIA亚群)。
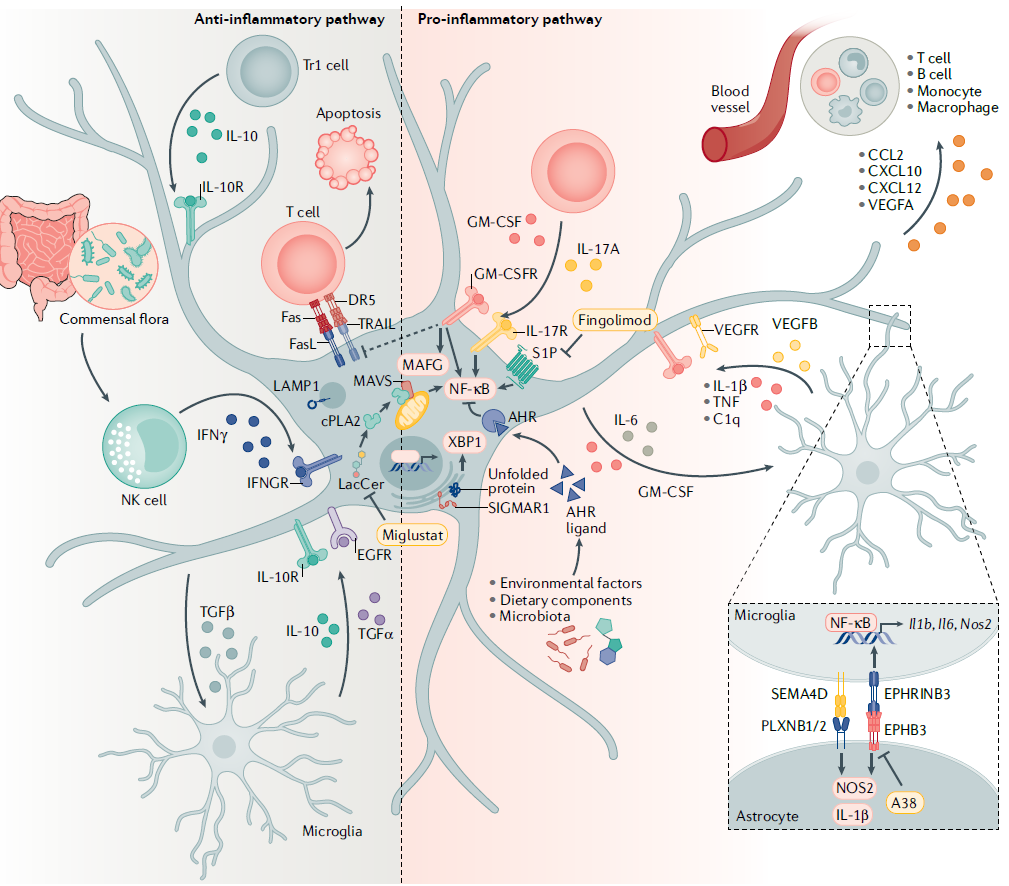
图1:星形胶质细胞亚群和可塑性
2
星形胶质细胞的功能
星形胶质细胞参与CNS稳态相关的关键过程,包括神经递质循环、离子平衡、能量代谢、调节突触发生和突触传递,以及维持血脑屏障。
CNS炎症
星形胶质细胞参与CNS炎症,具有促炎和抗炎活性。由于星形胶质细胞与CNS中的其他细胞和分子相互作用,它们分泌各种细胞因子、趋化因子和神经调节分子。在急性EAE B6小鼠模型中,反应性星形胶质细胞的减少增加了疾病的严重程度和CNS炎症。相反,在NOD小鼠EAE模型中,在慢性进展期选择性减少反应性星形胶质细胞可改善疾病的发病机制,限制小胶质细胞和单核细胞的招募和激活。CNS炎症中星形胶质细胞相反的作用突出了它们的功能异质性。
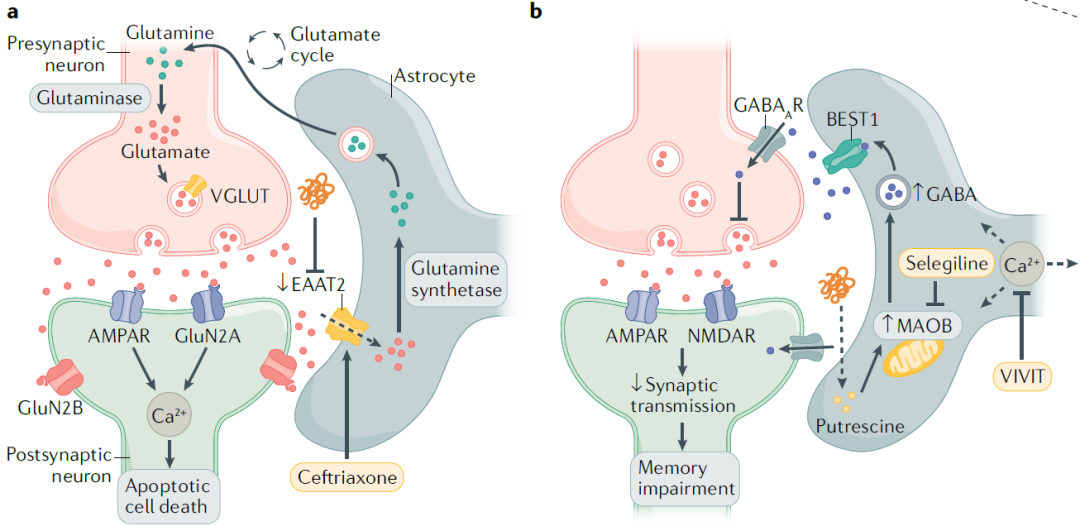
图2:星形胶质细胞在CNS炎症中的作用
谷氨酸稳态
谷氨酸是CNS中最普遍的兴奋性神经递质,然而过量的谷氨酸会引发神经元死亡,这个过程被称为兴奋性毒性。星形胶质细胞通过高亲和力谷氨酸转运体兴奋性氨基酸转运体1(EAAT1)和EAAT2从突触间隙中清除细胞外谷氨酸,这两个转运体在谷氨酸稳态、突触可塑性和神经元存活中起着关键作用。因此,星形胶质细胞谷氨酸摄取受损可导致神经元兴奋性毒性,这通常与神经退行性病变有关。
在阿尔茨海默症中,脑内淀粉样蛋白β (Aβ)的积累通过抑制EAAT2调节星形胶质细胞对谷氨酸的摄取。这导致表达谷氨酸受体的神经元过度激活,增加细胞内Ca2+,促进神经功能障碍。
图片
图3:阿尔茨海默症中星形胶质细胞信号的靶向性研究
离子稳态
星形胶质细胞通过促进大脑中K+的吸收和缓冲调节神经元的兴奋性。星形胶质细胞表达多种K+通道,有效清除细胞外液中的K+离子,这一过程称为K+空间缓冲。因此,星形胶质细胞K+通道功能障碍可导致神经元损伤,导致神经退行性病变。
在亨廷顿氏病中,星形胶质细胞中突变型亨廷顿蛋白(mHTT)损害兴奋性氨基酸转运体2 (EAAT2)和K+离子通道Kir4.1的表达。谷氨酸转运蛋白水平的降低导致了mGlu2 /3介导的Ca2+信号传递增强。诱发的星形胶质细胞Ca2+信号的增加之后紧随的是自发Ca2+信号的丢失。细胞外K+和谷氨酸水平的升高导致神经元过度兴奋和神经退行性变的发展。

图4:在亨廷顿氏病中靶向星形胶质细胞信号
能量代谢
星形胶质细胞通过支持乳酸转移(称为星形胶质细胞-神经元乳酸穿梭)为神经元提供能量需求。高水平的细胞外K+、谷氨酸摄取和细胞内Ca2+触发星形胶质细胞乳酸释放。星形胶质细胞代谢功能障碍与神经退行性疾病相关,包括MS、AD、PD和HD。例如,乳糖神经酰胺介导的星形胶质细胞鞘脂代谢调控星形胶质细胞和神经元之间的代谢相互作用,是EAE和MS的发病机制。
神经毒性
星形胶质细胞的神经毒性活性可能涉及多种触发因素、星形胶质细胞亚群和效应机制。由小胶质细胞产生的补体因子C1q、肿瘤坏死因子(TNF)和IL-1α刺激诱导的C3+神经毒性星形胶质细胞亚群可诱导神经元死亡。长链饱和脂质,由超长链脂肪酸蛋白1伸长合成并在脂质颗粒中分泌的,是星形胶质细胞分泌的神经毒性因子。
3
星形胶质细胞在精神疾病中的作用
星形胶质细胞功能的失调,如对神经元活性的调控、神经递质的释放和与突触修剪相关的过程,都与神经精神疾病有关。在发育过程中星形胶质细胞通过小胶质细胞调节突触修剪。例如,星形胶质细胞通过IL-33介导的机制促进发育中的视觉系统的突触修剪,与小胶质细胞依赖的突触修剪相关。此外,星形胶质细胞产生的补体被证明可以触发小胶质细胞依赖的修剪来重塑神经回路。
星形胶质细胞产生的细胞因子与抑郁和焦虑样行为相关。例如,杏仁核星形胶质细胞中的腺苷信号以区域和突触特异性的方式促进了焦虑相关表型。靶向星形胶质细胞细胞因子的产生可能为抑郁和相关疾病提供新的治疗选择。
总结
星形胶质细胞靶向治疗的一个主要挑战是在健康和疾病中星形胶质细胞的异质性。不同的星形胶质细胞亚群在CNS区域分布、疾病或疾病状态之间表现出显着的差异。
有趣的是,一些与星形胶质细胞相关的发病机制在多种神经疾病中是共同的,包括神经毒性和细胞外谷氨酸水平调控异常、K+离子循环或乳酸穿梭缺陷。调控这些共同的星形胶质细胞活性失调通路,可能为治疗星形胶质细胞驱动的多种神经系统疾病提供靶点。
原始出处:
星形胶质细胞是中枢神经系统(CNS)中数量最多的胶质细胞,在健康和疾病中发挥多种功能。星形胶质细胞调节谷氨酸和离子稳态、胆固醇和鞘脂代谢,并对环境因素作出反应,这些都与神经系统疾病有关。星形胶质细胞也表现出显着的异质性,由发育程序和刺激特异性细胞反应调控星形胶质细胞在CNS中的位置和细胞-细胞相互作用。
图片
2022年2月美国麻省理工学院和哈佛大学布罗德研究所Francisco J Quintana在nature reviews drug discovery期刊上发表的文章重点介绍了星形胶质细胞在神经系统疾病中的作用,以及其作为治疗干预靶点的潜力。此外,提出了星形胶质细胞亚群的简明命名法,强调星形胶质细胞特定亚群在神经系统疾病中的作用。
1
星形胶质细胞概述及分类
星形胶质细胞最早在19世纪由鲁道夫·维乔(Rudolf Virchow)提出。十年后,高尔基(Camillo Golgi)用铬酸银染色技术将星形胶质细胞的形态可视化,提出了胶质细胞充当大脑“胶水”的概念。星形胶质细胞很快被分为两种基本形态亚型:原生质型(protoplasmic)和纤维型(fibrous)。原生质星形胶质细胞主要出现在灰质,纤维状星形胶质细胞则普遍存在于白质中。卡哈(Santiago Ramón y Cajal)采用了这些亚型,并进一步揭示了人类小脑中星形胶质细胞的不同形态。
星形胶质细胞是异质性的。新的分子技术已经根据其分子特征和/或功能(促进或抑制CNS炎症或神经退行性变)确定了星形胶质细胞子集。这些亚群分为两类:发育程序驱动的星形胶质细胞亚群(DIA亚群),刺激诱导的星形胶质细胞亚群(SIA亚群)。
图片
图1:星形胶质细胞亚群和可塑性
2
星形胶质细胞的功能
星形胶质细胞参与CNS稳态相关的关键过程,包括神经递质循环、离子平衡、能量代谢、调节突触发生和突触传递,以及维持血脑屏障。
CNS炎症
星形胶质细胞参与CNS炎症,具有促炎和抗炎活性。由于星形胶质细胞与CNS中的其他细胞和分子相互作用,它们分泌各种细胞因子、趋化因子和神经调节分子。在急性EAE B6小鼠模型中,反应性星形胶质细胞的减少增加了疾病的严重程度和CNS炎症。相反,在NOD小鼠EAE模型中,在慢性进展期选择性减少反应性星形胶质细胞可改善疾病的发病机制,限制小胶质细胞和单核细胞的招募和激活。CNS炎症中星形胶质细胞相反的作用突出了它们的功能异质性。
图片
图2:星形胶质细胞在CNS炎症中的作用
谷氨酸稳态
谷氨酸是CNS中最普遍的兴奋性神经递质,然而过量的谷氨酸会引发神经元死亡,这个过程被称为兴奋性毒性。星形胶质细胞通过高亲和力谷氨酸转运体兴奋性氨基酸转运体1(EAAT1)和EAAT2从突触间隙中清除细胞外谷氨酸,这两个转运体在谷氨酸稳态、突触可塑性和神经元存活中起着关键作用。因此,星形胶质细胞谷氨酸摄取受损可导致神经元兴奋性毒性,这通常与神经退行性病变有关。
在阿尔茨海默症中,脑内淀粉样蛋白β (Aβ)的积累通过抑制EAAT2调节星形胶质细胞对谷氨酸的摄取。这导致表达谷氨酸受体的神经元过度激活,增加细胞内Ca2+,促进神经功能障碍。
图片
图3:阿尔茨海默症中星形胶质细胞信号的靶向性研究
离子稳态
星形胶质细胞通过促进大脑中K+的吸收和缓冲调节神经元的兴奋性。星形胶质细胞表达多种K+通道,有效清除细胞外液中的K+离子,这一过程称为K+空间缓冲。因此,星形胶质细胞K+通道功能障碍可导致神经元损伤,导致神经退行性病变。
在亨廷顿氏病中,星形胶质细胞中突变型亨廷顿蛋白(mHTT)损害兴奋性氨基酸转运体2 (EAAT2)和K+离子通道Kir4.1的表达。谷氨酸转运蛋白水平的降低导致了mGlu2 /3介导的Ca2+信号传递增强。诱发的星形胶质细胞Ca2+信号的增加之后紧随的是自发Ca2+信号的丢失。细胞外K+和谷氨酸水平的升高导致神经元过度兴奋和神经退行性变的发展。
图片
图4:在亨廷顿氏病中靶向星形胶质细胞信号
能量代谢
星形胶质细胞通过支持乳酸转移(称为星形胶质细胞-神经元乳酸穿梭)为神经元提供能量需求。高水平的细胞外K+、谷氨酸摄取和细胞内Ca2+触发星形胶质细胞乳酸释放。星形胶质细胞代谢功能障碍与神经退行性疾病相关,包括MS、AD、PD和HD。例如,乳糖神经酰胺介导的星形胶质细胞鞘脂代谢调控星形胶质细胞和神经元之间的代谢相互作用,是EAE和MS的发病机制。
神经毒性
星形胶质细胞的神经毒性活性可能涉及多种触发因素、星形胶质细胞亚群和效应机制。由小胶质细胞产生的补体因子C1q、肿瘤坏死因子(TNF)和IL-1α刺激诱导的C3+神经毒性星形胶质细胞亚群可诱导神经元死亡。长链饱和脂质,由超长链脂肪酸蛋白1伸长合成并在脂质颗粒中分泌的,是星形胶质细胞分泌的神经毒性因子。
3
星形胶质细胞在精神疾病中的作用
星形胶质细胞功能的失调,如对神经元活性的调控、神经递质的释放和与突触修剪相关的过程,都与神经精神疾病有关。在发育过程中星形胶质细胞通过小胶质细胞调节突触修剪。例如,星形胶质细胞通过IL-33介导的机制促进发育中的视觉系统的突触修剪,与小胶质细胞依赖的突触修剪相关。此外,星形胶质细胞产生的补体被证明可以触发小胶质细胞依赖的修剪来重塑神经回路。
星形胶质细胞产生的细胞因子与抑郁和焦虑样行为相关。例如,杏仁核星形胶质细胞中的腺苷信号以区域和突触特异性的方式促进了焦虑相关表型。靶向星形胶质细胞细胞因子的产生可能为抑郁和相关疾病提供新的治疗选择。
总结
星形胶质细胞靶向治疗的一个主要挑战是在健康和疾病中星形胶质细胞的异质性。不同的星形胶质细胞亚群在CNS区域分布、疾病或疾病状态之间表现出显着的差异。
有趣的是,一些与星形胶质细胞相关的发病机制在多种神经疾病中是共同的,包括神经毒性和细胞外谷氨酸水平调控异常、K+离子循环或乳酸穿梭缺陷。调控这些共同的星形胶质细胞活性失调通路,可能为治疗星形胶质细胞驱动的多种神经系统疾病提供靶点。
原始出处:
Lee, HG., Wheeler, M.A. & Quintana, F.J. Function and therapeutic value of astrocytes in neurological diseases. Nat Rev Drug Discov 21, 339–358 (2022). https://doi.org/10.1038/s41573-022-00390-x.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言