【论著】| 结直肠癌中LC3与树突状细胞募集、TLS形成的相关性及其临床意义
2023-10-11 中国癌症杂志 中国癌症杂志 发表于上海
结直肠癌中LC3异常表达可通过增加表面抗原激活mDC,进而募集淋巴细胞,促进TLS的形成与成熟,最终影响患者的预后。
[摘要] 背景与目的:肿瘤细胞免疫逃逸是肿瘤治疗中的难点,而肿瘤细胞中自噬过度激活会引起肿瘤细胞表面抗原的增加,参与抗肿瘤免疫。本研究通过临床样本检测结直肠癌中自噬关键因子微管相关蛋白轻链3(light chain 3,LC3)表达、成熟树突状细胞(mature dendritic cell,mDC)数目及三级淋巴结构(tertiary lymphoid structure,TLS)的形成,探讨其相关性及临床意义,旨在为增强抗肿瘤免疫治疗提供新思路。方法:采用免疫组织化学EnVision法检测2016年1月—2017年6月滨州医学院附属医院收治的经手术切除的179例T2期高危及T3期结直肠癌患者的癌组织及癌旁组织中LC3、DC-lamp的表达和TLS的形成。采用蛋白质印迹法(Western blot)及实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测TLS+及TLS-结直肠癌组织中LC3、NY-ESO-2、淋巴毒素β(lymphotoxin-beta,LTβ)、CC族趋化因子配体21(CC chemokine ligand 21,CCL21)、CXC族趋化因子配体13(CXC chemokine ligand 13,CXCL13)及白细胞介素17(interleukin-17,IL-17)的表达,分析其相关性及临床意义。采用log-rank检验比较组间预后差异,采用COX比例风险回归模型进行多因素生存分析。结果:结直肠癌组织中LC3、DC-lamp的表达量均高于癌旁组织 (P<0.05),LC3与DC-lamp的表达呈正相关(P<0.05)。TLS+组中LC3、NY-ESO-2、LTβ、CXCL13及CCL21的蛋白水平及mRNA表达均高于TLS-组(P<0.05),而IL-17的表达量则低于TLS-组(P<0.05),LC3表达与TLS/生发中心(germinal center,GC)+、TLS/GC-两亚型均呈正相关(P<0.05),且与NY-ESO-2、LTβ、CXCL13及CCL21的表达呈正相关(P<0.05)。DC-lamp在TLS/GC+和TLS/GC-亚型组中的表达量均高于其余两亚组(P<0.05),且呈正相关 (P<0.05)。Log-rank检验及COX比例风险回归模型显示,结直肠癌中LC3、DC-lamp、TLS及淋巴结转移与结直肠癌患者的预后密切相关,且均是结直肠癌预后的独立危险因素。结论:结直肠癌中LC3异常表达可通过增加表面抗原激活mDC,进而募集淋巴细胞,促进TLS的形成与成熟,最终影响患者的预后。
[关键词]结直肠肿瘤;轻链3;成熟树突状细胞;三级淋巴结构;临床意义
[Abstract] Background and purpose: It has been recognized as a complex problem in tumor therapy to deal with the tumor immune escape, and over-activated autophagy can cause the increase of tumor surface antigen, which participates in anti-tumor immunity. In this study, the expressions of microtubule-associated protein light chain 3 (LC3), mature dendritic cell (mDC) and the formation of tertiary lymphoid structure (TLS), an essential autophagy factor in colorectal cancer, were detected in clinical samples. The results had important clinical implications and provided new insights for enhancing anti-tumor immunity. Methods: Immunohistochemical EnVision method was used to detect the expressions of LC3, DC-lamp and the formation of TLS in cancer tissues and normal mucosal tissues of 179 patients with T2 stage high-risk and T3 stage colorectal cancer who underwent surgical rep at Binzhou Medical University Hospital from January 2016 to June 2017. Western blot and real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) were used to detect the expressions of LC3, NY-ESO-2, lymphotoxin-beta (LTβ), CC chemokine ligand 21 (CCL21), CXC chemokine ligand 13 (CXCL13) and interleukin-17 (IL-17) in TLS+ and TLS- colorectal cancer tissues. Then the correlation and clinical significance were analyzed. Log-rank test was used to compare the prognostic differences between groups, and COX proportional risk regression model was used for multivariate survival analysis. Results: Clinical samples showed that the expressions of LC3 and DC-lamp were higher in colorectal cancer tissues than in normal mucosa tissues (P<0.05), and the expressions of LC3 and DC-lamp were positively correlated (P<0.05). The protein and mRNA expressions of LC3, NY-ESO-2, LTβ, CXCL13 and CCL21 were higher in TLS+ group than in TLS- group. The expression of IL-17 was higher in the TLS- group than in the TLS+ group (P<0.05). The expression of LC3 was positively correlated with TLS/germinal center (GC)+ and TLS/GC- subtypes and positively correlated with the expression of NY-ESO-2, LTβ, CXCL13 and CCL21 (P<0.05). The expression of DC-lamp was higher in TLS/GC+ and TLS/GC- subtype groups than in the other two subgroups (P<0.05), and there was a positive correlation. Kaplan-Meier and COX regression models showed that LC3, DC-lamp, TLS and lymph node metastasis were closely related to the prognosis of patients with colorectal cancer, and they were independent risk factors for the prognosis of colorectal cancer. Conclusion: The abnormal expression of LC3 in colorectal cancer can activate mDC to recruit lymphocytes and promote the expression and maturation of TLS, ultimately affecting the prognosis of patients.
[Key words] Colorectal cancer; Light chain 3; Mature dendritic cell; Tertiary lymphoid structure; Clinical significance
随着生活环境及饮食习惯的改变,结直肠癌已发展为全球常见恶性肿瘤的第3位,居肿瘤相关死亡率的第4位[1]。因此,提高结直肠癌的疗效,改善其预后,是结直肠癌研究领域亟待解决的问题。肿瘤细胞免疫逃逸是肿瘤重要的生物学特性,目前抗肿瘤细胞免疫逃逸已成为肿瘤治疗的研究热点。有研究[2]已证实,伴有丰富三级淋巴结构(tertiary lymphoid structure,TLS)的肿瘤组织对免疫治疗的反应率较高,提示TLS可以作为对肿瘤免疫治疗反应的预测因子。而成熟树突状细胞(mature dendritic cell,mDC)对肿瘤抗原的提呈作用则是促进TLS形成的关键[3]。自噬是细胞处理自身受损蛋白质和细胞器的重要生物学现象。本课题组前期研究[4]显示,结直肠癌中自噬可诱导肿瘤相关巨噬细胞募集及转化。本研究采用免疫组织化学EnVision法检测结直肠癌组织中自噬关键因子轻链3(light chain 3,LC3)的表达,并通过mDC、滤泡DC (follicular DC,FDC)、高内皮微静脉(high endothelial venule,HEV)及CD4+、CD8+、CD20+淋巴细胞的水平及Ki-67增殖指数判断TLS,采用蛋白质印迹法(Western blot)及实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测LC3、NY-ESO-2、淋巴毒素β(lymphotoxin-beta,LTβ)、CC族趋化因子配体21(CC chemokine ligand 21,CCL21)、CXC族趋化因子配体13(CXC chemokine ligand 13,CXCL13)及白细胞介素17(interleukin-17,IL-17)的表达,探讨自噬与mDC、TLS及相关免疫因子的关系,为进一步揭示结直肠癌肿瘤免疫逃逸机制、寻找新的治疗靶点及预测肿瘤免疫治疗效果提供新思路。
1 材料和方法
1.1 材料
1.1.1 组织标本
收集2016年1月—2017年6月滨州医学院附属医院收治的经手术切除的T2期高危及T3期结直肠癌患者的临床病理学资料。所有病例均为首次发现,术前未经任何治疗,术后均采用FOLFOX方案化疗,并进行随访,随访截至2022年6月,失访者不予入组。根据世界卫生组织(World Health Organization,WHO)第5版消化系统肿瘤分类标准[5],由两名资深病理科医师双盲阅片重新诊断,非肿瘤死亡者予以排除。纳入结直肠癌患者179例,其中男性83例,女性96例,平均年龄61岁。组织学类型:管状腺癌143例,黏液腺癌36例。肿瘤直径<5 cm者74例,≥5 cm者105例。分化程度:高分化26例,中分化98例,低分化55例。浸润深度:肌层65例,侵及或浸透外膜者114例。有淋巴结转移者90例,无淋巴结转移者89例。
1.1.2 试剂
LC3、DC-lamp、TLB、NY-ESO-2 、CXCL13、CCL21、IL-17和β-actin抗体均购自英国Abcam公司,MECA-79抗体购自美国BD Biosciences公司,即用型抗体CD4 、CD8、CD20、CD21、Ki-67和羊抗兔/鼠Ⅱ抗均购自北京中杉金桥生物技术有限公司,Western blot检测所需试剂购自上海碧云天生物技术有限公司,RTFQ-PCR实验试剂盒购自日本Takara公司,特异性引物序列由日本Takara公司合成。
1.2 方法
1.2.1 免疫组织化学检测
应用免疫组织化学EnVision法:3 μm连续组织切片,将切片脱蜡至水,用3%的H2O2去除内源性过氧化物酶,高压热修复抗原,加一抗LC3(1∶100)、DC-lamp(1∶500)、MECA-79(1:100)、即用型CD4、CD8、CD20、CD21、Ki-67抗体4 ℃过夜,二抗37 ℃温育30 min,采用二氨基联苯胺(diaminobenzidine,DAB)显色,苏木精复染,1%盐酸乙醇分化,脱水透明,中性树胶封固。用已知LC3蛋白阳性的脑组织、DC-lamp蛋白阳性的肺组织、CD4蛋白阳性的T细胞淋巴瘤、CD8、CD20、CD21蛋白阳性、Ki-67增殖指数高的扁桃体组织作为阳性对照,用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)代替一抗作为阴性对照。
1.2.2 免疫组织化学结果判定标准
LC3主要表达于肿瘤细胞的细胞膜或细胞质中,以出现棕黄色颗粒为阳性标志。选取10个阳性细胞数最多的高倍镜下视野,根据染色强度和阳性细胞所占比例判定结果:无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。将两项评分结果相乘:≥4分判定为阳性,<4分判定为阴性。
DC-lamp标记mDC主要表达于mDC细胞质中,每张切片在10倍镜下观察10个独立视野,选取5个阳性细胞数最多的视野,在高倍镜下计数,取平均值,高于平均值者为阳性,低于平均值者为阴性。CD4、CD8、CD20表达于淋巴细胞的细胞膜和细胞质中;CD21标记FDC表达于FDC细胞膜和细胞质中;MECA-79标记HEV表达于内皮细胞中,均以细胞膜和(或)细胞质内出现棕黄色为阳性标志。MECA-79+血管周环绕Ki-67+B细胞聚集区域判定为生发中心(germinal center,GC)。
根据结直肠癌中TLS的形态特征并辅以DC-lamp、CD4、CD8、CD20、CD21、Ki-67及MECA-79标记判定TLS[6]。观察肿瘤前沿10个低倍镜视野,根据有无TLS形成,将其分为TLS+和TLS-。并根据GC的形成进一步将TLS+分为:次级滤泡样TLS组(TLS/GC+,GC+及CD21+伴CD4+、CD8+、CD20+淋巴细胞聚集体形成,TLS计数≥1个)和初级滤泡样TLS和早期TLS组(TLS/GC-,GC-、CD21-/CD21+伴CD4+、CD8+、CD20+淋巴细胞聚集体形成,TLS计数≥1个)。TLS-样本根据淋巴细胞浸润量分为淋巴细胞弥漫组(diffuse lymphocytic infiltration,DLI;多量弥漫CD4+、CD8+、CD20+淋巴细胞浸润,无聚集体形成,淋巴细胞计数>120个/高倍视野)和少淋巴细胞组(sparse infiltration,SLI;少量散在CD4+、CD8+、CD20+淋巴细胞分布,淋巴细胞计数<120个/高倍视野)。本实验均采用同一样本连续切片进行上述各指标标记,并在同一视野下观察,以确保判读结果的准确性及组间可比性。
1.2.3 Western blot检测
将新鲜组织经液氮冷冻研磨破碎后经放射免疫沉淀法(radio immunoprecipitation assay,RIPA)裂解,12 000 r/min离心5 min提取上清液,采用二辛可宁酸(bicinchoninic acid,BCA)蛋白定量试剂盒检测蛋白浓度,样品煮沸后进行电泳。应用含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween,TBST)洗涤3次,每次15 min,5%的脱脂牛奶室温摇床封闭2 h;一抗4 ℃温育过夜;TBST洗涤3次,每次15 min;二抗室温温育2 h;TBST洗涤3次,每次15 min,电化学发光(electrochemical luminescence,ECL)曝光,应用Image J软件对目标图像进行分析。
1.2.4 RTFQ-PCR
按照TRIzol试剂盒说明书提取组织RNA并检测其浓度,在37 ℃ 15 min、85 ℃ 5 s条件下将RNA反转录成cDNA。采用SYBR Green相对定量PCR法,按照试剂盒说明书配制25 μL体系反应液,在CFX96T RT-PCR Detection System C1000上进行扩增(表1)。反应条件:95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,合计40个循环。采用2-ΔΔCt法计算相对表达量,实验重复3次,结果取平均值。

1.3 统计学处理
采用SPSS 27.0软件对数据进行统计学处理。运用GraphPad Prism 9.0及Image J软件进行图像和数据处理,组间比较采用配对t检验。计数资料采用χ2检验或Fisher精确概率方法。相关性分析采用Spearman相关分析法。生存分析采用Kaplan-Meier法,并采用log-rank检验比较组间预后差异,采用COX比例风险回归模型进行多因素生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 结直肠癌中LC3和DC-lamp的表达及相关性
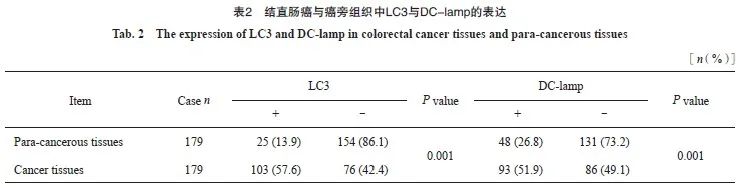
采用免疫组织化学法检测LC3和DC-lamp的表达,结果显示,结直肠癌中LC3的阳性表达高于癌旁组,差异有统计学意义(P<0.05)。同时,结直肠癌中DC-lamp的阳性表达高于癌旁组,差异有统计学意义(P<0.05,图1,表2)。
根据LC3的表达将179例结直肠癌分为LC3+与LC3-组,分别计数DC-lamp+ DC细胞。结果显示,LC3+组中DC-lamp表达高于LC3-组,差异有统计学意义(P<0.05)。Spearman相关分析显示,LC3表达水平与DC-lamp的表达呈正相关,差异有统计学意义(r=0.237,P<0.05,表3)。
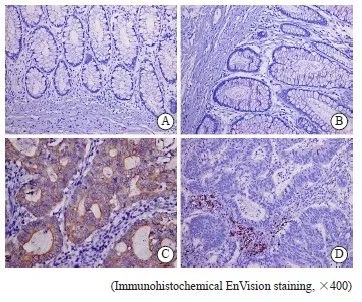
图1 结直肠癌与癌旁组织中LC3与DC-lamp的表达
Fig. 1 The expression of LC3 and DC-lamp in colorectal cancer and para-cancerous tissues
A: LC3 was negative in para-cancerous tissues; B: DC-lamp was negative in para-cancerous tissues; C: LC3 was positive in colorectal cancer tissues; D: DC-lamp was positive in colorectal cancer tissues.

2.2 结直肠癌中TLS的功能亚型及占比
根据TLS判断标准,对179例结直肠癌患者进行分组。TLS+组115例,其中TLS/GC+亚型组40例(22.3%),TLS/GC-亚型组75例(41.9%)。TLS-组64例,其中DLI亚组33例(18.5%),SLI亚组31例(17.3%)。TLS+占比(64.2%)高于TLS-组(35.8%),详见图2。
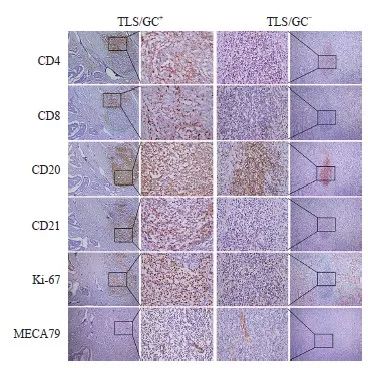
图2 结直肠癌TLS/GC+、TLS/GC-亚型分组中各相关指标的表达
Fig. 2 The expression of marker in TLS/GC+, TLS/GC- subtype in colorectal cancer
The left image showed the formation of aggregates of CD4+, CD8+and CD20+ lymphocytes of the TLS/GC+ subtype, with CD21+, Ki-67+ expression around MECA79+; The right image showed the formation of aggregates of CD4+, CD8+and CD20+ lymphocytes of the TLS/GC- subtype, without CD21+, Ki-67+ expression around MECA79+ (in the same field on serial ps of the same sample, immunohistochemical EnVision staining, ×100). Middle boxed area: The same area of marker (immunohistochemical EnVision staining, ×400).
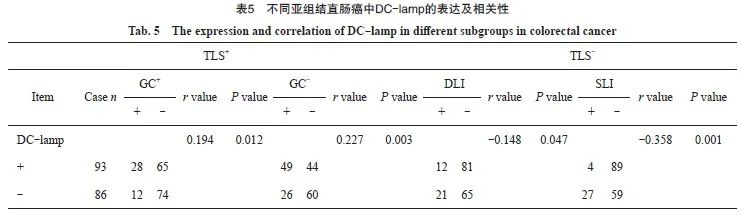
2.3 不同亚组结直肠癌中LC3的表达及相关性
观察各亚组中LC3的表达水平,分析其差异性及相关性。结果显示,TLS/GC+亚型组中LC3表达水平均明显高于其余3组,TLS/GC-亚型组中LC3表达水平则高于DLI组和SLI组,而SLI亚组中LC3表达水平明显低于其余3组,组间比较,差异均有统计学意义(P<0.05)。Spearman相关分析显示,LC3表达与TLS/GC+、TLS/GC-两亚型均呈正相关(r=0.270,r=0.230,P<0.05),而与DLI、SLI均呈负相关(r=-0.175,r=-0.443,P<0.05,表4,图3)。
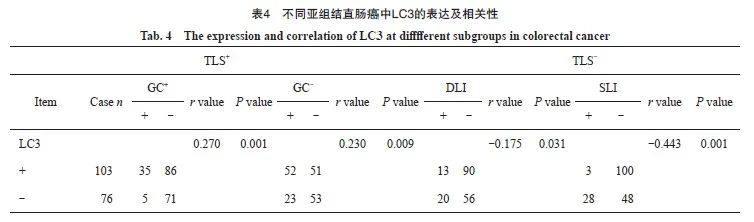

图3 不同亚组结直肠癌组织中LC3与DC-lamp表达
Fig. 3 The expression of LC3 and DC-lamp at different subgroups in colorectal cancer
A-D: the expressions of LC3 in different subgroups, which were strongly positive, positive, slightly positive and negative respectively; E-H: the expressions of DC-lamp in different subgroups, which were abundant, relatively abundant, low, and absent in DC-lamp cells (in the same field on serial ps of the same sample, immunohistochemical EnVision staining, ×200).
2.4 不同亚组结直肠癌中DC-lamp的表达及相关性
在各亚组中分别计数DC-lamp+细胞。结果显示,TLS/GC+和TLS/GC-亚型组中DC-lamp的表达水平均高于其余两组,差异均有统计学意义(P<0.05),但两亚组间比较DC-lamp的表达水平,差异无统计学意义(P>0.05);而SLI组DC-lamp的表达水平均明显低于其余3组,差异均有统计学意义(P<0.05)。Spearman相关分析显示,DC-lamp表达与TLS/GC+、TLS/GC-两亚型均呈正相关(r=0.194,r=0.227,P<0.05),而与DLI、SLI均呈负相关(r=-0.148,r=-0.358,P<0.05,表5)。
2.5 TLS+组与TLS-组中LC3、NY-ESO-2、LTβ、CXCL13、CCL21、IL-17的表达及结直肠癌中LC3与各因子的相关性
分别选取TLS+及TLS-结直肠癌组织各15例,检测LC3、NY-ESO-2、LTβ、CXCL13、CCL21及IL-17的表达。Western blot检测结果显示,TLS+组中LC3、NY-ESO-2、LTβ、CXCL13及CCL21的表达量均高于TLS-组,TLS-组中IL-17的表达量高于TLS+组,差异均有统计学意义(P<0.05)。RTFQ-PCR结果显示,TLS+组中LC3、NY-ESO-2、LTB、CXCL13及CCL21的mRNA表达量均高于TLS-组,TLS-组中IL-17 mRNA的表达量高于TLS+组,差异均有统计学意义(P<0.05,图4A~4C)。
应用Image J软件进行图像处理,根据结直肠癌组织中各因子表达的灰度值,采用线性回归的对数趋势线分析其相关性。结果显示,结直肠癌组织中LC3与NY-ESO-2、LTβ、CXCL13和CCL21的表达均呈正相关(R2=0.326、0.271、0.151和0.295),与IL-17的表达呈负相关(R2=-0.150),差异均有统计学意义(P <0.05,图4D~4H)。
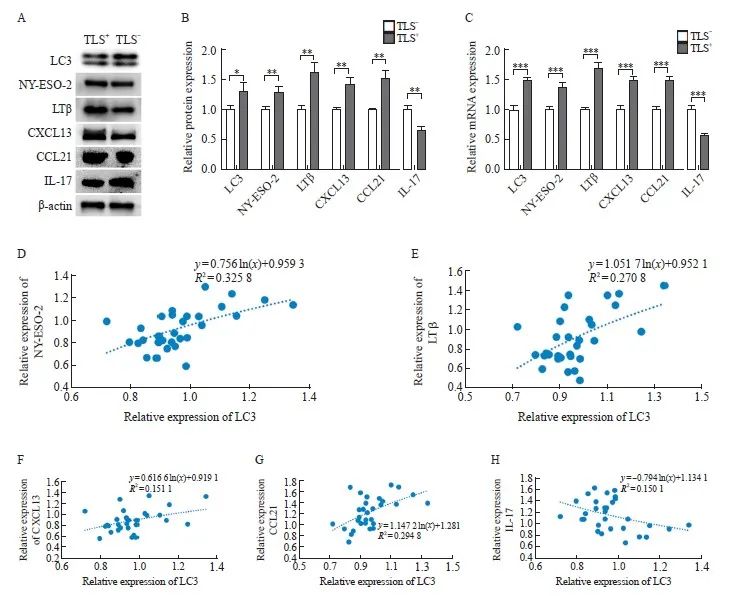
图4 TLS+及TLS-组中LC3、NY-ESO-2、LTβ、CXCL13、CCL21、IL-17的表达及结直肠癌中LC3与各因子的相关性
Fig. 4 The expression of LC3, NY-ESO-2, LTβ, CXCL13, CCL21 and IL-17 in TLS+ or TLS- groups and the correlation between LC3 and various factors in colorectal cancer
A: Electrophoretic picture; B, C: Relative expression of protein and mRNA; D-H: Analysis of the correlation between LC3 and NY-ESO-2, LTβ, CXCL13, CCL21 and IL-17 in colorectal cancer by logarithmic trend line of linear regression. *: P <0.05, compared with TLS- group; **: P<0.01, compared with TLS- group; ***: P <0.001, compared with TLS- group.
2.6 生存分析
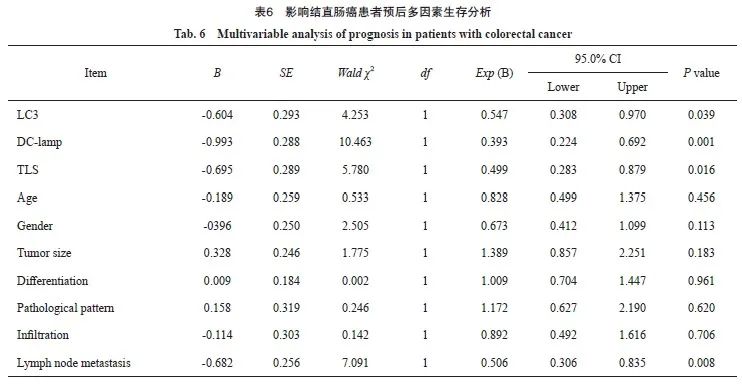
179例结直肠癌患者中的中位生存期为62个月,平均5年生存率为59.8%。Log-rank检验结果显示,LC3、DC-lamp、TLS及淋巴结转移与结直肠癌患者预后密切相关(P<0.05,图5)。COX比例风险回归模型显示,LC3、DC-lamp、TLS及淋巴结转移是结直肠癌的独立危险因素(P<0.05,表6)。
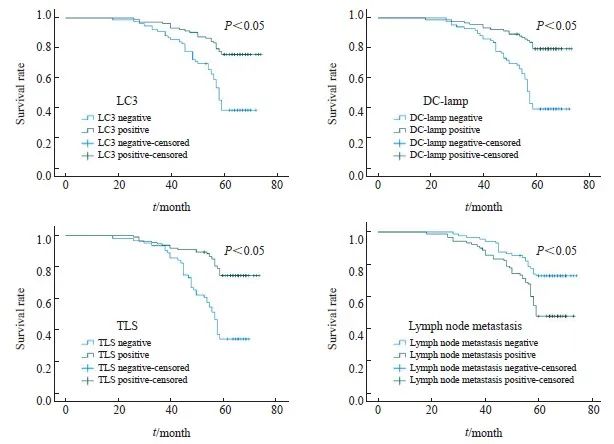
图5 结直肠癌患者的预后生存曲线
Fig. 5 Prognostic survival curve in colorectal cancer patients
3 讨 论
自噬是一种高度保守的生物学行为,在肿瘤的发生、发展中扮演着重要角色[7]。自噬小体的成熟是自噬过程的关键阶段,它通过在细胞质中形成的双层膜结构包裹肿瘤相关抗原、免疫介质和表面标志物等待清除物质,形成自噬小体并运送到溶酶体中降解[8]。当这些物质被降解后,其中一部分抗原肽可以与MHC分子结合,形成MHC-抗原肽复合物,最终通过抗原提呈细胞呈递,从而激活免疫应答[8]。因此,自噬与抗原提呈的相关性受到广泛关注。Münz等[9]和Romao等[10]的研究表明,LC3-Ⅱ可以与MHC分子作用,从而影响抗原呈递的效率和选择性。Jin等[11]研究证实,雷帕霉素可通过与LC3融合,将抗原靶向自噬小体,有效地增强抗原提呈细胞中MHC-Ⅱ类分子上抗原的呈现。NY-ESO-2是肿瘤抗原中免疫原性最强的CTAG基因家族中的一员,但在结直肠癌中表达较低[12]。然而,本研究结果显示,在LC3高表达的结直肠癌中伴有肿瘤表面抗原NY-ESO-2高表达,且两者呈正相关。结合本课题组前期研究结果[13],提示结直肠癌中存在自噬异常激活现象,并可增加肿瘤表面抗原暴露,进而影响肿瘤免疫。因此,深入研究自噬与肿瘤免疫的关系,对于肿瘤防治具有重要意义。
DC家族是免疫系统中功能强大的抗原提呈细胞[14],其中mDC在抗原提呈中发挥关键作用,能够吞噬、摄取、内化和处理抗原,通过表面的共刺激分子与T细胞相互作用,使其激活并诱导增殖和分化[15-16]。Fridman等[17]研究发现,肿瘤细胞自噬小体作为mDC交叉递呈的抗原来源,可有效地提升诱导抗原特异性CD8+ T细胞的应答能力。但也有研究[18]表明,高水平的自噬可导致MHC-Ⅰ类分子被选择性地降解,从而抑制T细胞介导的免疫反应,增加肿瘤细胞的免疫逃逸能力。Tian等[19]在肝癌细胞中研究发现,自噬活性升高会导致mDC中的氧化应激,并加速肿瘤抑制因子的降解,从而抑制其抗原提呈能力。由此可见,自噬与mDC抗原提呈诱导免疫的相关性还存在争议,而其在结直肠癌中的研究鲜见报道。本研究结果显示,LC3蛋白及mDC在结直肠癌中的表达率均明显高于癌旁黏膜,并且LC3表达与NY-ESO-2及mDC浸润量均呈正相关,提示结直肠癌中不仅存在自噬异常激活现象,同时也是增加肿瘤表面抗原暴露并最终影响mDC细胞浸润量及激活的重要因素。由此推测,结直肠癌中自噬所导致的肿瘤微环境中抗原的增加,可能是抗肿瘤免疫的始动因素之一,而mDC则在有效识别、呈递抗原、招募免疫细胞等方面发挥抗肿瘤免疫的核心效应。
TLS是位于非典型淋巴器官的异位淋巴结构[20],常发生于各类肿瘤前沿。TLS的组成成分包括T细胞区、B细胞区和HEV。T细胞区主要由CD4+、CD8+ T细胞及mDC构成,B细胞区由B细胞和FDC形成的GC构成[19]。TLS为抗肿瘤免疫反应提供了局部而关键的微环境[21]。目前研究发现,在胰腺导管癌[6]、乳腺癌[22]及非小细胞肺癌[23]等多钟实体肿瘤中均存在TLS结构,并且与肿瘤免疫及患者预后密切相关。Ding等[24]对肝内胆管癌的研究结果显示,TLS数量和空间位置与患者预后显著相关,证实肿瘤内TLS是抗肿瘤免疫反应的微观解剖学位点。Weinstein等[25]将转染过表达T-bet基因的mDC导入肿瘤微环境中可促进TLS发展、延缓肿瘤进程。Wang等[22]和Halle等[26]研究表明,mDC接受抗原刺激后通过产生多种细胞因子和趋化因子,在诱导免疫细胞异位聚集、促进FDC发育、构建TLS形态并维持其功能方面发挥重要作用。相关研究[27-28]表明,TLS/GC+亚型因具有成熟的GC,在维持肿瘤抗原特异性免疫反应方面具有最强效力,是最强抗肿瘤作用的“功能亚型”,TLS/GC-者次之,而缺乏TLS者的免疫监视能力较弱。有关结直肠癌中LC3与mDC对TLS功能亚型影响的相关研究较少。本研究的179例结直肠癌患者中有115例具有TLS结构,其中TLS/GC+亚型占22.3%,TLS/GC-亚型占41.9%,而DLI亚型占18.5%,SLI亚型占17.3%。本研究结果显示,TLS两亚型组中LC3表达水明显高于无TLS组,其中以TLS/GC+亚型组表达最高,并且LC3表达与TLS两功能亚型呈正相关。同时TLS两亚型组中mDC的表达高于其余组,且与功能亚型形成呈正相关。提示LC3激活mDC,通过招募淋巴细胞,促使TLS形成,在促进抗肿瘤免疫的功能中发挥重要作用。
TLS对抗肿瘤免疫的积极作用已在结直肠癌[29]、乳腺癌[23]及非小细胞肺癌[24]等恶性肿瘤中被证实,因而诱导TLS形成已成为抗肿瘤研究的热点。目前,利用抗原呈递细胞、趋化因子或合成支架成为诱导TLS形成的主要方法[2]。因此,深入研究TLS的形成机制,对于寻找有效的促TLS形成途径具有重要意义。为进一步证实LC3、mDC与TLS的形成机制,本实验同步检测了CXCL13和CCL21以及LTβ、IL-17等部分细胞因子,并分析了上述因子与LC3的关系。结果显示,TLS+组中CXCL13与CCL21、LTβ呈高表达,而IL-17则表达较低。同时LC3与NY-ESO-2、LTβ、CXCL13及CCL21的表达均呈正相关,而与IL-17的表达呈负相关。提示LC3、mDC对TLS的影响机制可能是通过自噬促使NY-ESO-2等肿瘤表面抗原释放,进而激活mDC,而由mDC、FDC、T细胞产生的LTβ、CXCL13及CCL2等细胞因子的高表达在调控免疫细胞迁徙、归巢等方面发挥积极作用[24],最终促使TLS形成,成为影响肿瘤免疫的重要因素。作为抑制自噬的促炎性细胞因子IL-17的低表达也在一定程度上推助了TLS的形成[30]。因此,结直肠癌的自噬水平可以成为影响TLS形成并向最强功能亚型发展的重要因素。由此推测,自噬的异常激活导致肿瘤表面抗原暴露增加,驱动mDC活化,促进抗原提呈,进而影响TLS发展与成熟,在抗肿瘤免疫中发挥重要作用。Dieu-Nosjean等[31]在早期非小细胞肺癌中发现mDC的密度及TLS的保护性免疫作用与良好的临床预后高度相关。Calderaro等[32]研究发现,肝细胞癌内TLS的存在与早期复发风险降低显著相关。本研究结果显示,具有TLS结构的115例(64.2%)结直肠癌患者的预后优于无TLS结构组,其5年存活率与既往研究[33]结果相符。COX比例风险回归模型显示,LC3、mDC、TLS及淋巴结转移是影响结直肠癌预后的独立危险因素,进一步证实TLS在一定程度上维持了免疫应答的中心环节。由此推测,在肿瘤微环境中,激活自噬,增强mDC抗原提呈,诱导TLS形成,有效激活T、B淋巴细胞,进而发挥抗肿瘤免疫作用,可能成为影响患者生存和预后的有效途径。
综上所述,结直肠癌的肿瘤细胞自噬水平的异常激活可使肿瘤抗原增加,肿瘤细胞表面抗原决定簇暴露,激活mDC,增加抗原识别及提呈能力,进而招募微环境中的淋巴细胞,最终形成TLS,通过多种细胞因子以增强抗肿瘤免疫反应,有效地避免肿瘤免疫逃逸现象的发生。深入探究自噬与mDC及TLS形成的关系,研究其在抗肿瘤免疫中的潜在作用,将有助于为发现肿瘤免疫治疗靶点提供新思路。然而本研究仅对结直肠癌中自噬与mDC对TLS的形成关系进行了初步探讨,仍需增加样本量并进一步开展实验研究,从而更深层次地揭示其分子机制及意义。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] SCHUMACHER T N, THOMMEN D S. Tertiary lymphoid structures in cancer[J]. Science, 2022, 375(6576): eabf9419.
[3] DI CARO G, BERGOMAS F, GRIZZI F, et al. Occurrence of tertiary lymphoid tissue is associated with T-cell infiltration and predicts better prognosis in early-stage colorectal cancers[J]. Clin Cancer Res, 2014, 20(8): 2147-2158.
[4] 范守仁, 吴淑华, 李扬扬, 等. 结直肠癌中LC3与不同表型肿瘤相关巨噬细胞的相关性及其临床意义[J]. 中国癌症杂志, 2020, 30(11): 849-857.
FAN S R, WU S H, LI Y Y, et al. The correlation between LC3 and tumor-associated macrophages in colorectal cancer and its clinical significance[J]. China Oncol, 2020, 30(11): 849-857.
[5] WHO Classification of Tumours Editorial Board. WHO classification of tumours of digestive system[M].Lyon: IARC Press, 2019.
[6] TANAKA T, MASUDA A, INOUE J, et al. Integrated analysis of tertiary lymphoid structures in relation to tumor-infiltrating lymphocytes and patient survival in pancreatic ductal adenocarcinoma[J]. J Gastroenterol, 2023, 58(3): 277-291.
[7] XIA H J, GREEN D R, ZOU W P. Autophagy in tumour immunity and therapy[J]. Nat Rev Cancer, 2021, 21(5): 281-297.
[8] ZHAO Y, CODOGNO P, ZHANG H. Machinery, regulation and pathophysiological implications of autophagosome maturation[J]. Nat Rev Mol Cell Biol, 2021, 22(11): 733-750.
[9] MÜNZ C. Canonical and non-canonical functions of the
autophagy machinery in MHC restricted antigen presentation
[J]. Front Immunol, 2022, 13: 868888.
[10] ROMAO S, MÜNZ C. LC3-associated phagocytosis[J]. Autophagy, 2014, 10(3): 526-528.
[11]JIN Y, SUN C J, FENG L Q, et al. Regulation of SIV antigen-specific CD4+ T cellular immunity via autophagosome-mediated MHC Ⅱ molecule-targeting antigen presentation in mice[J]. PLoS One, 2014, 9(3): e93143.
[12]SHANTHA KUMARA H M, GRIECO M J, CABALLERO O L, et al. MAGE-A3 is highly expressed in a subset of colorectal cancer patients[J]. Cancer Immun, 2012, 12: 16.
[13]刘梦瑶, 吴淑华, 温菲菲, 等. 结直肠癌中LC3与CD4+、CD8+、CD68+免疫细胞浸润的相关性及其临床意义[J]. 临床与实验病理学杂志, 2018, 34(2): 124-131.
LIU M Y, WU S H, WEN F F, et al. Correlation of LC3 and CD4+, CD8+ and CD68+ cell infiltration in colorectal cancer and its clinical significance[J]. Chin J Clin Exp Pathol, 2018, 34(2): 124-131.
[14]MERAD M, SATHE P, HELFT J, et al. The dendritic cell lineage: ontogeny and function of dendritic cells and their subsets in the steady state and the inflamed setting[J]. Annu Rev Immunol, 2013, 31: 563-604.
[15]MILDNER A, JUNG S. Development and function of dendritic cell subsets[J]. Immunity, 2014, 40(5): 642-656.
[16]COLLIN M, BIGLEY V. Human dendritic cell subsets: an update[J]. Immunology, 2018, 154(1): 3-20.
[17]FRIDMAN W H, MEYLAN M, PETITPREZ F, et al. B cells and tertiary lymphoid structures as determinants of tumour immune contexture and clinical outcome[J]. Nat Rev Clin Oncol, 2022, 19(7): 441-457.
[18]YAMAMOTO K, VENIDA A, YANO J, et al. Autophagy promotes immune evasion of pancreatic cancer by degrading MHC-I[J]. Nature, 2020, 581(7806): 100-105.
[19]TIAN Y, KUO C F, SIR D, et al. Autophagy inhibits oxidative stress and tumor suppressors to exert its dual effect on hepatocarcinogenesis[J]. Cell Death Differ, 2015, 22(6): 1025-1034.
[20]MAOZ A, DENNIS M, GREENSON J K. The Crohn’s-like lymphoid reaction to colorectal cancer-tertiary lymphoid structures with immunologic and potentially therapeutic relevance in colorectal cancer[J]. Front Immunol, 2019, 10: 1884.
[21]SAUTÈS-FRIDMAN C, PETITPREZ F, CALDERARO J, et al. Tertiary lymphoid structures in the era of cancer immunotherapy[J]. Nat Rev Cancer, 2019, 19(6): 307-325.
[22]WANG B, LIU J, HAN Y, et al. The presence of tertiary lymphoid structures provides new insight into the clinicopathological features and prognosis of patients with breast cancer[J]. Front Immunol, 2022, 13: 868155.
[23]SILIŅA K, SOLTERMANN A, ATTAR F M, et al. Germinal centers determine the prognostic relevance of tertiary lymphoid structures and are impaired by corticosteroids in lung squamous cell carcinoma[J]. Cancer Res, 2018, 78(5): 1308-1320.
[24]DING G Y, MA J Q, YUN J P, et al. Distribution and density of tertiary lymphoid structures predict clinical outcome in intrahepatic cholangiocarcinoma[J]. J Hepatol, 2022, 76(3): 608-618.
[25]WEINSTEIN A M, CHEN L, BRZANA E A, et al. Tbet and IL-36γ cooperate in therapeutic DC-mediated promotion of ectopic lymphoid organogenesis in the tumor microenvironment[J]. OncoImmunology, 2017, 6(6): e1322238.
[26]HALLE S, DUJARDIN H C, BAKOCEVIC N, et al. Induced bronchus-associated lymphoid tissue serves as a general priming site for T cells and is maintained by dendritic cells[J]. J Exp Med, 2009, 206(12): 2593-2601.
[27]COLBECK E J, AGER A, GALLIMORE A, et al. Tertiary lymphoid structures in cancer: drivers of antitumor immunity, immunosuppression, or bystander sentinels in disease? [J]. Front Immunol, 2017, 8: 1830.
[28]J GUNDERSON A, RAJAMANICKAM V, BUI C, et al. Germinal center reactions in tertiary lymphoid structures associate with neoantigen burden, humoral immunity and long-term survivorship in pancreatic cancer[J]. Oncoimmunology, 2021, 10(1): 1900635.
[29]WANG Q Y, SHEN X F, AN R, et al. Peritumoral tertiary lymphoid structure and tumor stroma percentage predict the prognosis of patients with non-metastatic colorectal cancer[J]. Front Immunol, 2022, 13: 962056.
[30]LI S, LIN Z, ZHENG W, et al. IL-17A inhibits autophagic activity of HCC cells by inhibiting the degradation of Bcl2[J]. Biochem Biophys Res Commun, 2019, 509(1): 194-200.
[31]DIEU-NOSJEAN M C, GIRALDO N A, KAPLON H, et al. Tertiary lymphoid structures, drivers of the anti-tumor responses in human cancers[J]. Immunol Rev, 2016, 271(1): 260-275.
[32]CALDERARO J, PETITPREZ F, BECHT E, et al. Intra-tumoral tertiary lymphoid structures are associated with a low risk of early recurrence of hepatocellular carcinoma[J]. J Hepatol, 2019, 70(1): 58-65.
[33]ALLEMANI C, MATSUDA T, DI CARLO V, et al. Global surveillance of trends in cancer survival 2000-14 (CONCORD-3): analysis of individual records for 37 513 025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言