STTT:清华大学章薇团队基于表观遗传学药物的免疫疗法治疗神经系统弥漫性中线胶质瘤
2023-01-22 生物世界 生物世界 发表于陕西省
弥漫性中线胶质瘤伴H3K27改变(Diffuse midline glioma,H3 K27-altered)是一类好发于中枢神经系统中线结构的儿童型高级别弥漫性胶质瘤。
弥漫性中线胶质瘤伴H3K27改变(Diffuse midline glioma,H3 K27-altered)是一类好发于中枢神经系统中线结构的儿童型高级别弥漫性胶质瘤,常累及桥脑(Diffuse intrinsic pontine glioma,DIPG)、丘脑、脊髓等神经系统核心功能部位,手术切除难度极大,患者预后极差,2年生存率不足10%,伴有广泛软膜播散转移的晚期患者中位生存期更短,仅有约1.6-3.8个月。数十年来,基于手术和放化疗的传统治疗未有突破,全球大量的基础研究和临床实验尚未能给此类患者带来显著的临床增益。
作为H3K27改变中最为常见的类型,H3K27M,即组蛋白H3第27位赖氨酸(简写为K)至甲硫氨酸(简写为M)突变,是经典的“致癌组蛋白”(oncohistone)突变,由2018年拉斯克奖得主,美国洛克菲勒大学的C. David Allis教授提出并揭示了其致癌分子机理。
H3K27M突变所致的表观遗传学改变(epigenetic alternation),以H3K27位点三甲基化全局下调和乙酰化上调为其鲜明特征,是驱动弥漫性中线胶质瘤发生与恶性进展的核心要素。已有研究表明,表观遗传学药物在杀伤肿瘤的同时可增强或激活机体抗肿瘤的免疫反应。然而,相比于传统治疗,不论作为单药或是联合药物使用,表观遗传学药物尚未能给胶质瘤患者带来生存期增益,更为值得关注的是,其与免疫疗法的联用,尚未在弥漫性中线胶质瘤患者中开展临床研究。
“解铃还须系铃人”,靶向H3K27位点三甲基化降低和乙酰化上调,继而联合免疫治疗,能否为此类肿瘤患者的临床获益带来一线曙光?
2023年1月20日,清华大学章薇团队在 Signal Transduction and Targeted Therapy 期刊发表了题为:Diffuse midline glioma treated with epigenetic agent-based immunotherapy(基于表观遗传学药物的免疫疗法治疗弥漫性中线胶质瘤)的封面论文。
该研究首次报道了运用表观遗传学药物组蛋白去乙酰化酶抑制剂帕比司他(Panobinostat)和组蛋白甲基转移酶抑制剂他泽司他(Tazemetostat),联合免疫检测点PD-1抑制剂帕博丽珠单抗(Pembrolizumab)和CTLA-4抑制剂伊匹木单抗(Ipilimumab),治疗伴有广泛软膜播散转移和/或复发弥漫性中线胶质瘤患者,取得了显著临床疗效。

在数据截止日前(治疗第371日),该患者共接受了长达17周期(3或4周/周期)基于表观遗传学药物的免疫治疗(具体治疗方案参见原文附图2)。患者神经系统内广泛的软膜播散转移灶在影像学上呈持续性缩小(图2a),其中,鞍上区(T1)和延髓背侧(T2)病灶体积缩减超过94%,胸髓(T3)复发病灶在次全切除术后,未再复发的基础上,其体积呈持续性缩小。治疗第367日的增强MRI成像提示,软脑膜及脑室周围强化信号在影像学上已不可测得。在治疗全程中,患者的生活质量得到了显著改善和提高,并在第11疗程回归了日常生活。该患者的总体生存期为20个月,接受基于表观遗传学药物的免疫疗法的生存期为16个月。研究者团队为进一步观察该疗法的有效性,将其应用于治疗其他3名(2-4号患者)复发弥漫性中线胶质瘤伴H3K27改变的患者,亦取得了显著疗效)。
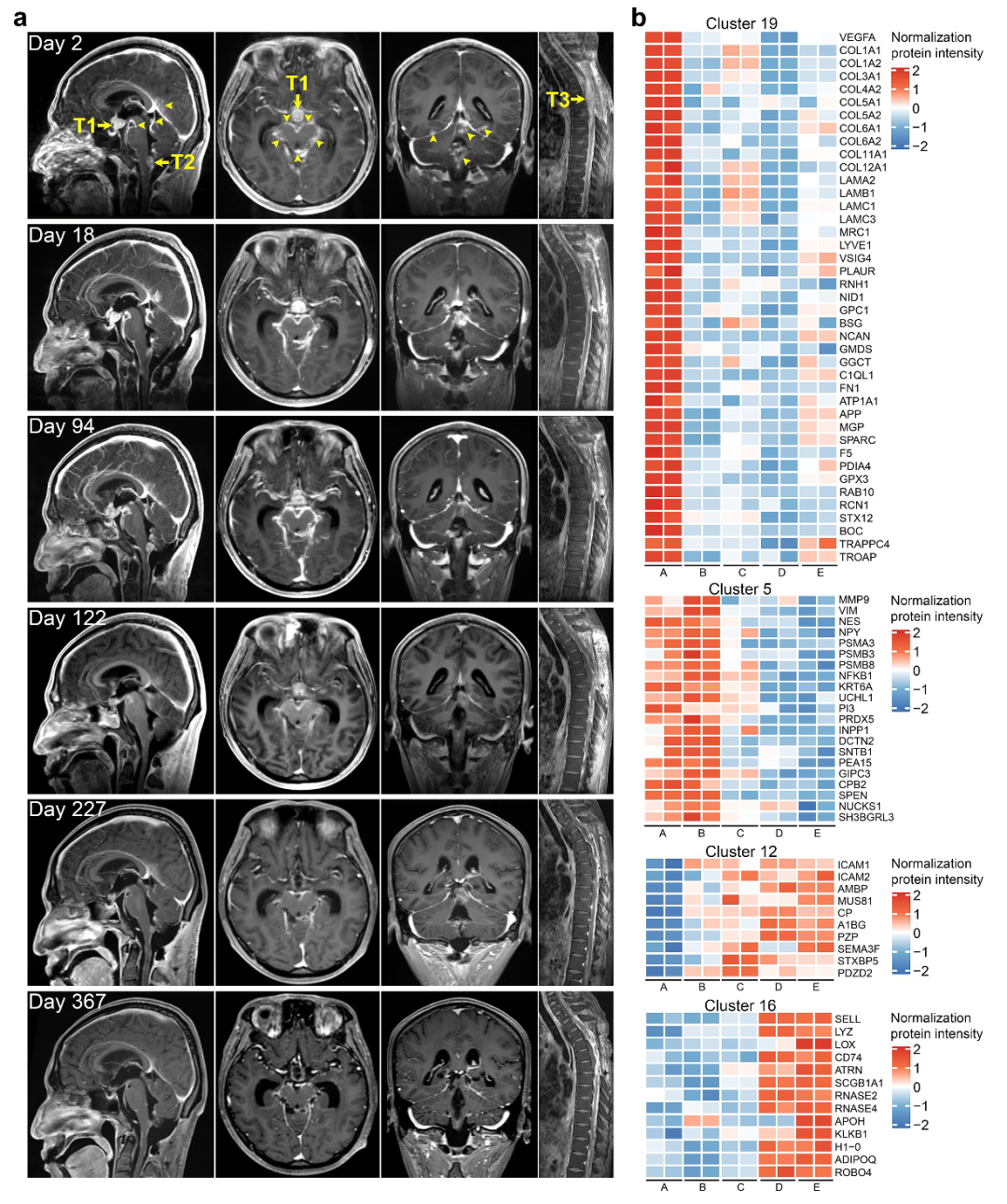 图2:1号患者的治疗反应。a. T1加权增强成像提示肿瘤体积随治疗显著缩小;b. 蛋白组学分析脑脊液中的差异性表达蛋白
图2:1号患者的治疗反应。a. T1加权增强成像提示肿瘤体积随治疗显著缩小;b. 蛋白组学分析脑脊液中的差异性表达蛋白该研究是首次报道将他泽司他作为表观遗传学药物的一种,应用于弥漫性中线胶质瘤患者的临床治疗。与此同时,术后给予免疫检测点PD-1抑制剂治疗,未能给胶质母细胞瘤和具有高突变负荷的胶质瘤患者带来显著的临床获益;此外,用PD-1抑制剂治疗伴有软膜播散转移的恶性肿瘤患者,其中位生存期仅为3.6个月。
目前研究认为,免疫治疗在胶质瘤患者中的疗效不如预期,可能与中枢神经系统肿瘤内高度抑制的免疫微环境、肿瘤浸润性淋巴细胞缺乏等因素密切相关。本研究不仅首次报道了免疫检测点PD-1和CTLA-4抑制剂在弥漫性中线胶质瘤患者中的联合应用,更为表观遗传学药物联合免疫疗法为胶质瘤患者带来临床获益的可能性与可行性,提供了初步探索的数据与经验。
综上所述,清华大学章薇团队通过以弥漫性中线胶质瘤伴H3K27改变的表观遗传学特征为治疗切入点,靶向H3K27位点的三甲基化全局下调和乙酰化上调,通过“欲将取之,必先与之”的治疗策略,运用表观遗传学药物组蛋白去乙酰化酶抑制剂和组蛋白甲基转移酶抑制剂,联合免疫检测点PD-1和CTLA-4抑制剂,在治疗伴有广泛软膜播散转移和/或复发弥漫性中线胶质瘤伴H3K27改变患者中,取得了显著的临床疗效。
该治疗策略不仅为此类患者的临床治疗提供了新思路与新范式,更有望拓展应用至更多以表观遗传学异常驱动的恶性肿瘤之中。
https://www.nature.com/articles/s41392-022-01274-7
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







