血液探秘:乳腺癌多线抗HER2治疗耐药,基因会发生啥变化?
2024-01-13 苏州绘真医学 苏州绘真医学 发表于陕西省
在本研究中,我们使用参加KCSG BR18-14/KM10B试验的患者的血液样本,通过ctDNA分析,探索了经过多线治疗的HER2+ MBC患者的累积基因变异及其临床意义。
本研究探索了参加KCSG BR18-14/KM10B试验的经过多线治疗的HER2+转移性乳腺癌患者的累积基因变异。对92例患者治疗前循环肿瘤DNA(ctDNA)进行靶向测序。还分析了7例获得>12个月持久缓解的患者疾病进展时的ctDNA。在99个样本中发现65个基因存在致病性变异。变异发生率最高的基因是TP53(n = 48),PIK3CA(n = 21)和ERBB3(n = 19)。TP53和PIK3CA突变与较短的无进展生存期(PFS)显著相关,ctDNA分数较高的患者PFS较差。ctDNA中同源重组缺陷(HRD)相关基因突变检出率高于匹配的肿瘤组织,并且这些突变往往与较短的PFS相关。所有7例患者均在治疗结束时发现新的致病性变异,包括BRCA2,VHL,RAD50,RB1,BRIP1,ATM,FANCA和PIK3CA突变。总之,TP53和PIK3CA突变以及较高的ctDNA分数与曲妥珠单抗联合细胞毒性化疗的PFS较差有关。ctDNA中HRD相关基因突变的富集和新发现的变异可能与治疗耐药性有关。
研究背景
已知HER2阳性乳腺癌表现为HER2扩增,驱动癌细胞中的许多致癌过程。目前,已开发了多种抗HER2药物,是HER2阳性转移性乳腺癌(HER2+ MBC)的标准治疗策略。通常推荐HER2双靶向治疗(曲妥珠单抗和帕妥珠单抗)联合细胞毒性化疗和抗HER2抗体-药物偶联物(ADC)[德曲妥珠单抗(T-Dxd)或恩美曲妥珠单抗(T-DM1)] 作为HER2+ MBC的一线或二线治疗。对于后续用药,基于继续抗HER2治疗的概念,推荐抗HER2酪氨酸激酶抑制剂、基因工程抗体或重新使用曲妥珠单抗联合不同化疗。
然而,关于抗HER2治疗可以应用多少次,数据不足,没有相关共识。在经过多线治疗的患者中,预计积累了多种获得性耐药机制,治疗压力下的肿瘤克隆进化可能会改变原发性肿瘤细胞的基因组特征。目前,关于经过多线治疗的HER2+ MBC的分子变异的数据较少。识别与治疗耐药相关的分子变异,可以为这些人群带来新的治疗选择。
基于组织的下一代测序(NGS)仍然是肿瘤基因检测的金标准。然而,多次组织活检的侵入性是一个主要障碍,特别是对于接受多线治疗的患者。此外,肿瘤组织检测在捕获肿瘤内和肿瘤间异质性方面具有局限性,肿瘤异质性是治疗耐药的重要原因。基于血液循环肿瘤DNA(ctDNA)的液体活检是一种有吸引力的替代方案,可以展现肿瘤的异质性面貌,以简单安全的方式跟踪基因动态变化。
在本研究中,我们使用参加KCSG BR18-14/KM10B试验的患者的血液样本,通过ctDNA分析,探索了经过多线治疗的HER2+ MBC患者的累积基因变异及其临床意义。
研究结果
ctDNA靶向测序结果
从93例患者中收集了100个外周血样本。最终分析包括99个样本的ctDNA数据,1个样本未通过质控,被排除在外。总体而言,在筛查时获得了92个样本,并从7例患者中获得了配对的治疗结束时(EOT)样本。1例患者在筛查期间未能提供血液样本,仅收集了EOT样本。在93例患者中,31例还提供了FFPE肿瘤组织。最终数据集包含的患者的临床特征如表1所示。
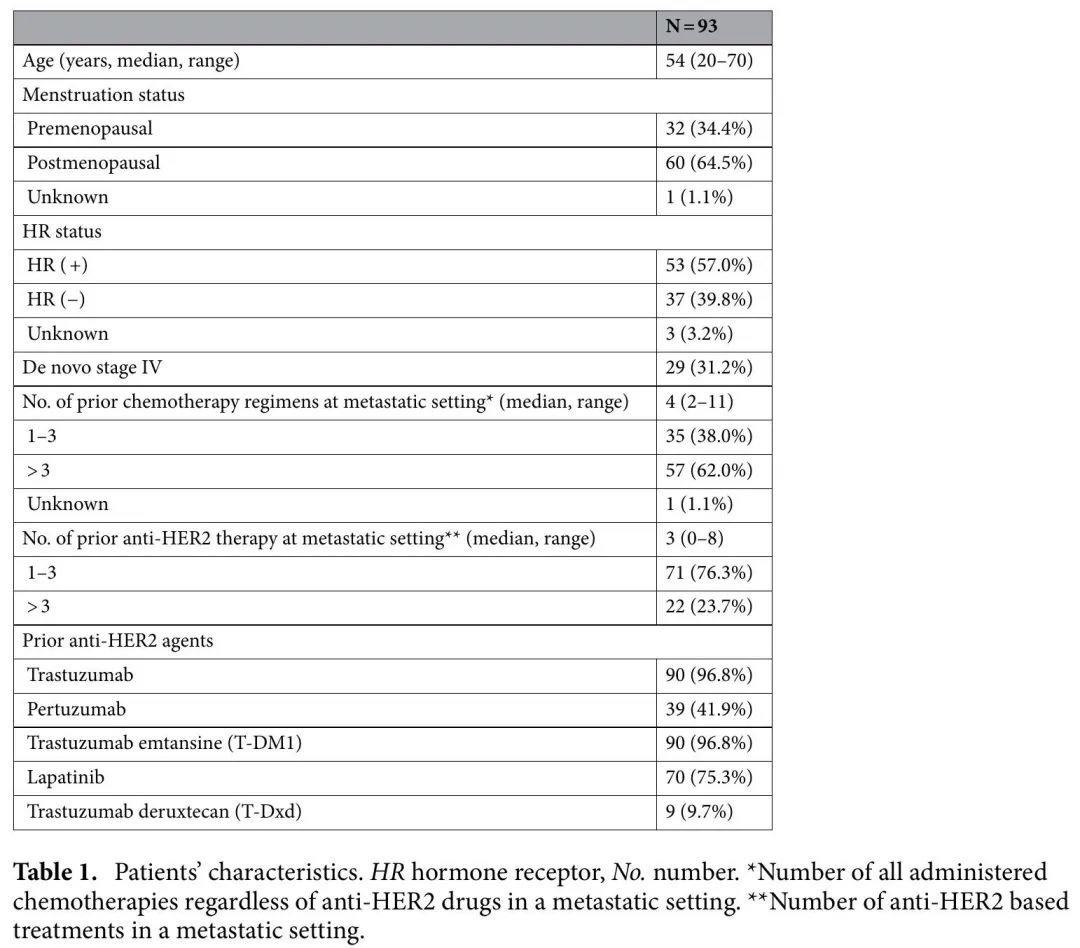
表1. 患者特征
ctDNA突变谱和致病性变异发生率
生成了99个ctDNA样本的突变谱,分析ctDNA致病性变异的发生率和相关性(图1A)。去除胚系、黑名单和克隆性造血变异后,识别了65个基因336个致病性体细胞变异和25个拷贝数变异。TP53变异发生率最高(48/99个样本),其次是PIK3CA(n = 21),ERBB3(n = 19),ATM(n = 17),RAD50(n = 16),ERBB2(n = 15),ARID1A(n = 12)和BRCA2(n = 11)。这与既往乳腺癌研究观察到的特征相似。

图1. MBC ctDNA突变谱
对于合格样本,计算ctDNA分数,评估其作为预后生物标志物的效用。在99个血浆样本中,85个计算了ctDNA分数,使用致病性变异的最高突变丰度,其余14个样本由于没有致病性变异而被排除在分析之外。中位ctDNA分数为3.33%,其分布如图1B所示。
ctDNA与匹配肿瘤组织基因变异的一致性
在同时具有血浆样本和匹配肿瘤组织样本的31例患者中,发现任一样本135个基因存在体细胞变异。为了确定组织和血浆样本的一致性,分析了CancerSCAN和Axen panel均覆盖的61个基因。肿瘤和血浆样本采集的中位时间间隔为42个月(范围2-104个月)。16/31例患者两个样本有26个一致的变异,包括18个SNV,3个indel和5个扩增(图2)。组织和ctDNA样本的基因水平变异一致性从73.8%(45/61)到95.1%(58/61)不等,包括存在或不存在的所有变异。TP53(10/31,32.3%)的基因水平一致性最高,其次是PIK3CA(7/31,22.6%),范围0%(0/31)到32.3%(10/31),与其他乳腺癌研究中报告的一致性相当。
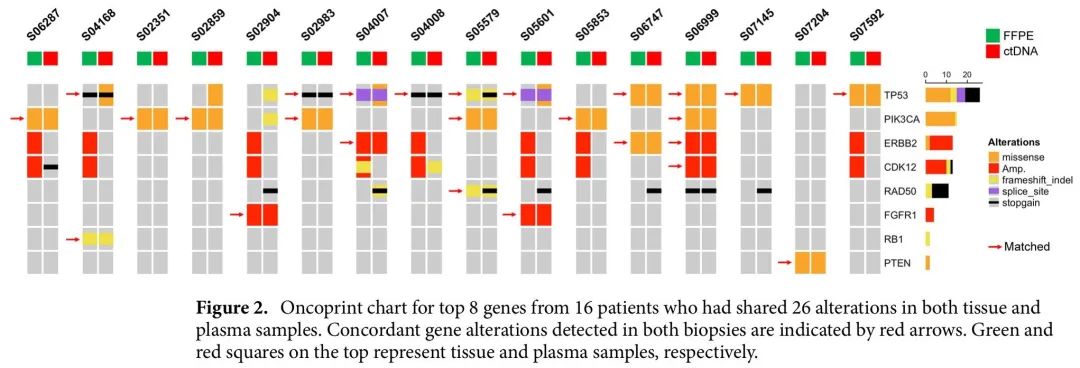
图2. 16例组织和血浆样本有26个一致变异的患者前8个基因Oncoprint图
进一步分析了可能影响一致性的几个因素,例如肿瘤组织采集时间(原发性或转移性组织)、组织和血浆样本采集的时间间隔以及ctDNA分数。根据肿瘤组织采集的时间或组织与血浆采集的时间间隔,一致性没有显著差异。一致组(n = 16)的ctDNA分数显著高于不一致组(n = 15)。这一结果提示,较高的ctDNA分数是影响血浆和组织一致性的主要因素,与先前研究报告的一致。
ctDNA中HRD相关基因突变的富集
发现HRD相关基因(包括ATM,RAD50,BRCA1/2,BRIP1,PALB2,BARD1和CHEK2)致病性变异在ctDNA分析数据中富集(图1)。因此,探索了31对配对的肿瘤组织和ctDNA样本中,HRD相关基因突变的检出率是否不同。在ctDNA中检测到的大多数变异AF低至<1%,然而,ctDNA中致病性变异的总数更高。其中,HRD相关基因突变在肿瘤样本中占7.1%(2/28个致病性变异),在ctDNA样本中占31.1%(51/164个致病性变异)(图3)。
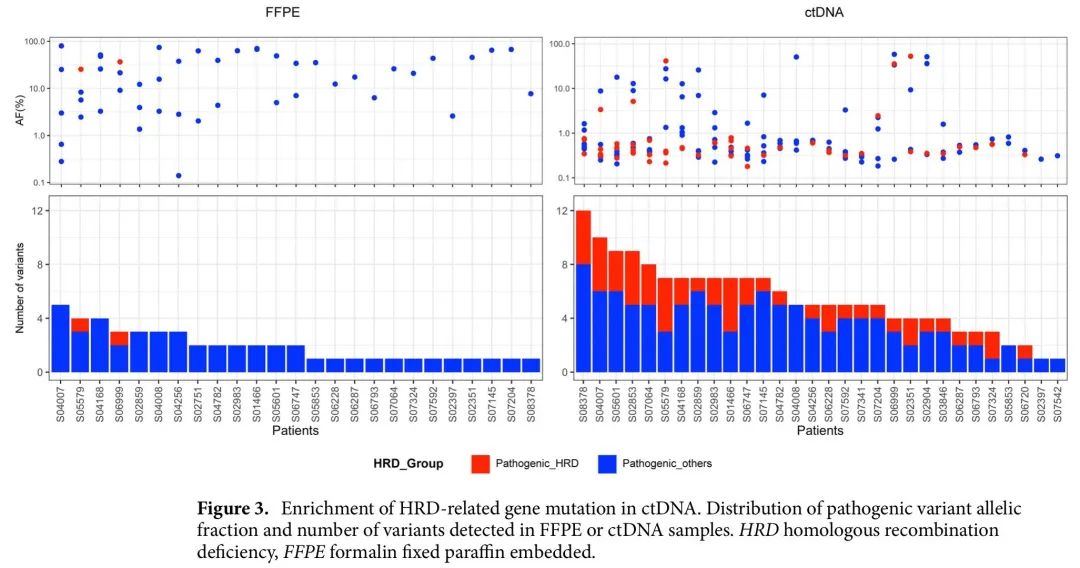
图3. ctDNA中HRD相关基因突变的富集
根据ctDNA基因变异进行生存分析
对89例有生存信息的患者进行生存分析。中位随访时间为12.7个月(95% CI 10.3–15.1),所有89例患者的中位PFS和OS分别为4.6(95% CI 4.0–5.2)和19.7(95% CI 11.8–27.6)个月。如图4所示,PIK3CA(中位2.9 vs 5.6个月,HR = 2.07,95% CI 1.17–3.68,p = 0.010)和TP53(中位3.3 vs 5.8个月,HR = 2.17,95% CI 1.35–3.47,p < 0.001)突变与较短的PFS显著相关。较高的ctDNA分数(>3.33%[中位])也与较差的PFS相关(中位3.3 vs 5.9个月,HR = 1.95,95% CI 1.25–3.05,p = 0.003)。PIK3CA突变、TP53突变和较高的ctDNA分数与较差的OS相关(分别为中位12.6 vs 22.9个月,p = 0.012;12.6 vs 19.7个月,p = 0.002;12.6 vs 22.9个月,p = 0.001)。TP53和PIK3CA突变以及ctDNA分数的预后价值在校正年龄(≤55岁vs >55岁)、既往抗HER2治疗线数(≤3 vs >3)和内脏转移的存在(否vs是)后仍保持一致。仅在15例患者中检测到ERBB2扩增,ERBB2扩增患者的PFS较差(中位3.4 vs 4.9个月,HR = 2.11,95% CI 1.04–4.31,p = 0.034)。值得注意的是,HRD基因突变的患者往往PFS较短,尽管没有统计学意义(中位3.2 vs 4.9个月,HR = 1.66,95% CI 0.91-3.03,p = 0.09)。
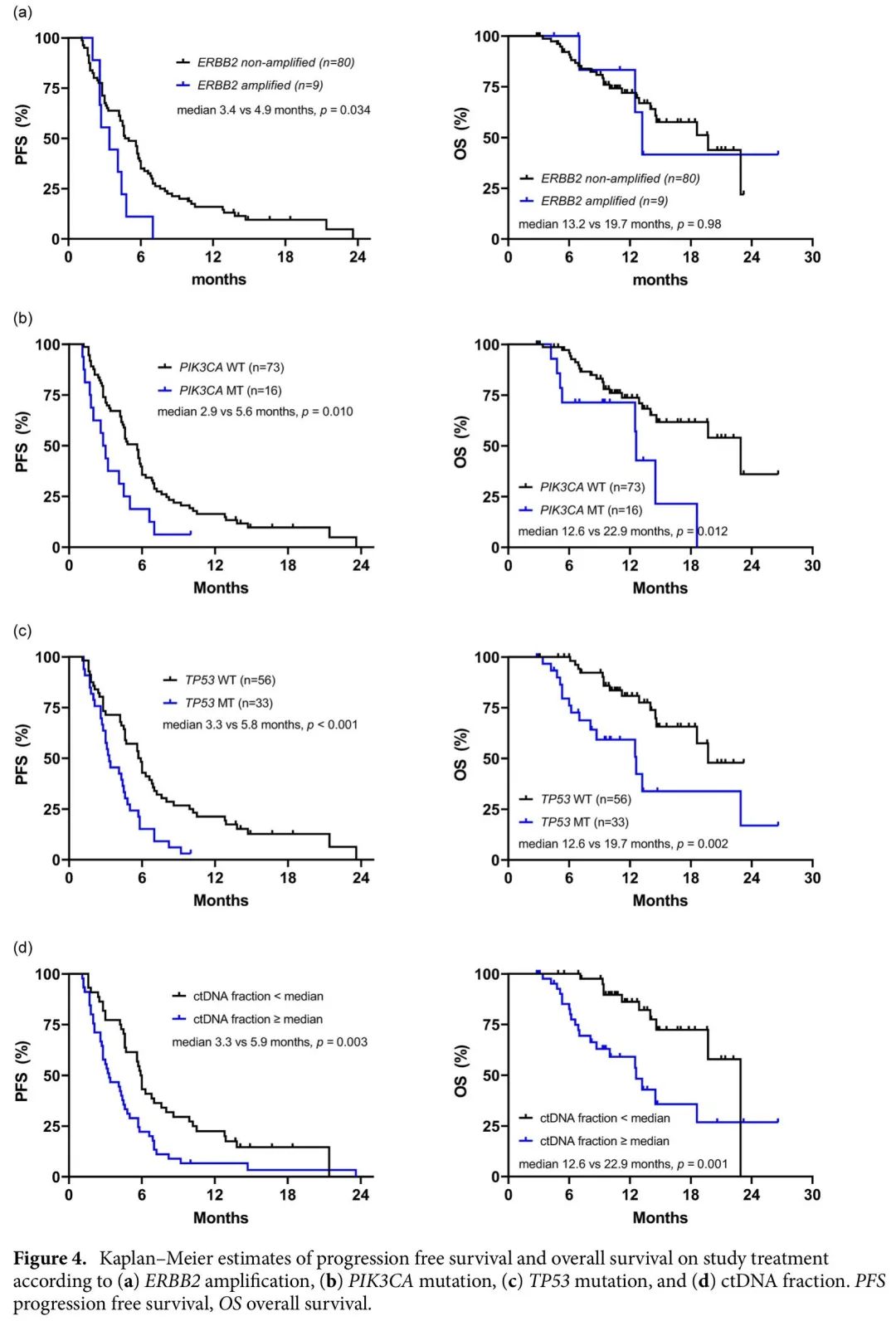
图4. PFS和OS Kaplan-Meier曲线,根据 (a) ERBB2扩增,(b) PIK3CA突变,(c) TP53突变, (d) ctDNA分数分层
配对样本分析发现治疗后克隆进化
为了确定治疗耐药的潜在机制,分析了6例有配对ctDNA(初始和EOT)的患者的致病性变异(图5)。这6例患者的PFS超过12个月,希望通过分析这些患者的样本来确定获得性耐药机制。其中3例患者(S06287,S06793和S02397)也有肿瘤组织样本。对于S06287,在肿瘤组织和初始ctDNA中均检测到PIK3CA_E542K突变,在EOT样本中未发现该突变,而是观察到先前未检测到的BRCA2和CDK12突变。在S04485中,最初未发现PIK3CA_E542K突变,但在EOT样本中检测到高AF的该突变。此外,除S02397外,EOT样本均发现致病性HRD相关基因突变,包括BRCA2、RAD50、ATM、FANCA和BRIP1。

图5. FFPE或连续ctDNA样本致病性变异AF变化
讨 论
HER2过表达是HER2+乳腺癌重要的致癌驱动因素和治疗靶点,然而,已知其分子异质性是抗HER2治疗的重要耐药机制。此外,由于肿瘤的演变和治疗压力,转移性乳腺癌的基因变异可能与原发肿瘤有很大不同,并且在多线治疗后变得更加不同。本研究展示了多线标准抗HER2治疗后疾病进展的HER2+ MBC患者的ctDNA基因突变谱。
与先前的研究一致,TP53和PIK3CA是突变发生率最高的两个基因。已知TP53突变在HER2+乳腺癌中发生率特别高,TP53突变本身与早发性乳腺癌和预后不良有关。最近,Liu等人通过ctDNA分析,表明了TP53突变作为抗HER2疗法(包括基于抗体的药物和TKI)疗效预测标志物的潜力。在本研究中,TP53突变患者的PFS和OS较差。尽管由于单臂研究设计的局限性,无法证明TP53突变的预测作用,但对于预后较差的患者,开发靶向TP53突变的疗法似乎是有必要的。PI3K异常激活也是乳腺癌(包括HER2+亚型)的致癌驱动因素,也是抗HER2治疗的重要耐药机制之一。先前的一项研究表明,携带PIK3CA激活突变的HER2+乳腺癌患者姑息性HER2靶向治疗的病理完全缓解(pCR)率较低,PFS较短。在多种晚期癌症中,血浆ctDNA PIK3CA突变可以预测生存和治疗结果,最近的一项荟萃分析在乳腺癌中证实了这一发现。本研究中,ctDNA检出PIK3CA突变的患者治疗反应较低,生存结果较差。此外,一例患者疾病进展时在ctDNA中检测到高AF的PIK3CA致病性突变,提示该患者可能存在治疗靶点。目前,许多使用PIK3CA抑制剂与抗HER2治疗的临床试验正在进行中,这些研究有望为PIK3CA抑制剂在HER2 +乳腺癌中的作用提供信息。除了检测单基因变异外,我们还计算了ctDNA分数,表明了其在HER2+ MBC中作为预后标志物的潜在作用。有研究表明,ctDNA反映肿瘤负荷,可作为晚期癌症患者的预后和随访工具。几项研究表明,在MBC患者中ctDNA分数可作为预后标志物,最近一项研究提出,在真实世界中,在四种最常见的晚期癌症类型(包括 MBC)中,ctDNA分数作为实用、独立的预后标志物发挥作用。此外,虽然本研究没有涉及,但几项研究发现,早期治疗中ctDNA动力学可预测治疗结果。然而,在实际临床实践中应用ctDNA分数之前,需要解决许多问题,如panel灵敏度,计算ctDNA分数的标准公式以及可靠的阈值。
有趣的是,本研究发现,与肿瘤组织相比,ctDNA中HRD相关基因突变检出率更高,并且HRD相关基因突变的患者往往具有较短的PFS。此外,疾病进展时收集的EOT样本检测到多个致病性HRD基因突变。有限的数据提示,在多个治疗周期中,HRD相关基因变异累积。然而,考虑到HRD相关基因的功能,这种富集提示尽管先前的抗癌治疗导致DNA修复机制受损,仍存在可以存活的肿瘤细胞。这些肿瘤细胞可能对后续治疗耐药。需要进一步的研究来确定是否可以进行相关靶向治疗。
在本研究中,15例患者(16%)检测到ERBB2(HER2)扩增,并通过微滴式数字PCR再次分析和确认。ctDNA HER2阳性率显著低于先前研究报道的转移性HER2+乳腺癌的33-96%和早期乳腺癌的9-31%。ctDNA ERBB2阳性率低可能归因于先前的抗HER2治疗效果。然而,在没有确认相应肿瘤细胞中ERBB2扩增存在情况时,较难得出明确的结论。本研究揭示了ctDNA检出ERBB2扩增与较差PFS之间的有趣关联。假设ctDNA中低水平的ERBB2是由先前的抗HER2治疗导致的,ctDNA中持续高水平ERBB2提示对抗HER2治疗的潜在耐药性。这一观察结果与III期KATHERINE研究的结果一致,该研究中,含曲妥珠单抗的新辅助治疗后残留肿瘤HER2 RNA高表达与曲妥珠单抗辅助治疗组的不良结局相关。此外,CALGB40601 研究显示,在曲妥珠单抗±拉帕替尼等新辅助治疗后存在残留病灶的患者中,HER2富集亚型的无复发生存期较差。考虑到这些发现,ctDNA持续存在高水平ERBB2扩增或可作为抗HER2治疗的潜在生物标志物,值得在未来的研究中进一步验证。本研究是作为与前瞻性临床试验平行的转化研究进行的,但有一些局限性。首先,没有同一时间点采集的肿瘤组织样本可以与ctDNA分析结果进行比较。因此,无法确认ctDNA中新检测到的变异,包括ERBB2扩增。其次,组织和血浆样本采集的时间间隔较长。相对较低的一致性可能是由于长时间内发生了肿瘤进化,不过这需要进一步验证。最后,我们没有收集所有患者的连续随访ctDNA样本。因此,无法获得ctDNA动力学与治疗效果相关性的数据。
总之,在HER2+ MBC患者中,TP53和PIK3CA突变以及较高的ctDNA分数与较差的PFS和OS有关。在ctDNA分析中注意到HRD相关基因突变的积累,其与较短的PFS有关。ctDNA分析可用于预测抗HER2治疗疗效和患者预后,即使在经过多线治疗的人群中也是如此。还可以为这些患者提供有关新治疗靶点的宝贵信息。
参考文献:
Lee K, Lee J, Choi J, Sim SH, Kim JE, Kim MH, Park YH, Kim JH, Koh SJ, Park KH, Kang MJ, Ahn MS, Lee KE, Kim HJ, Ahn HK, Kim HJ, Park KU, Park IH. Genomic analysis of plasma circulating tumor DNA in patients with heavily pretreated HER2 + metastatic breast cancer. Sci Rep. 2023 Jun 19;13(1):9928. doi: 10.1038/s41598-023-35925-8. PMID: 37336919; PMCID: PMC10279711.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#乳腺癌# #耐药# #ctDNA#
36