Blood:tafasitamab±来那度胺+R-CHOP在DLBCL一线的疗效和安全性初探索
2023-07-03 聊聊血液 聊聊血液 发表于上海
一项1b期First-MIND研究,在既往未经治疗的DLBCL患者中评估了tafasitamab±来那度胺联合R-CHOP的安全性和疗效。
R-CHOP+X
弥漫性大B细胞淋巴瘤(DLBCL)的一线治疗标准方案为R-CHOP,但30-40%的患者会发生复发或难治,且在IPI 3-5分(高危)的患者中R-CHOP失败率高达50%。已有多个研究试图在R-CHOP的基础上加入其他药物(R-CHOP+X)来改善疗效,包括伊布替尼、来那度胺、维泊妥珠单抗和硼替佐米等,但均未改善总生存期(OS),仅维泊妥珠单抗联合R-CHP的POLARIX研究证实有无进展生存期(PFS)获益。总的来说,仍需改善初治DLBCL患者的当前标准治疗,尤其是高危患者。
来那度胺加入R-CHOP治疗ABC亚型DLBCL的ROBUST研究未改善PFS或OS,但IPI≥3的患者中PFS有改善的趋势。Tafasitamab是一款靶向CD19的人源化单克隆抗体,在不适合ASCT的R/R DLBCL中,tafasitamab联合来那度胺的ORR达57.5%,CR为41.3%,中位缓解维持时间未达到,中位PFS 11.6个月,中位OS 33.5个月。
David Belada教授等假设,R-CHOP基础上加用tafasitamab±来那度胺可改善一线结局,并首次设计了一项1b期First-MIND研究,在既往未经治疗的DLBCL患者中评估了tafasitamab±来那度胺联合R-CHOP的安全性和疗效。研究结果近日发表于《Blood》。

研究设计&结果
该1b期、开放标签、多中心、随机First-MIND研究在北美和欧洲的53个研究中心开展。纳入患者标准包括:≥18岁;新诊断、既往未经治疗、组织学证实的DLBCL(非特指型);随机化时至少有一个经PET确证的可测量病灶;ECOG体能状态0–2;IPI 2–5;以R-CHOP作为一线治疗的候选药物(图1)。研究排除了已知双打击或三打击淋巴瘤、转化型NHL患者和复合型淋巴瘤患者,以尽量减少研究患者人群的异质性。将患者按1:1比例随机(不分层)分配至R-CHOP+tafasitamab组或R-CHOP+tafasitamab+来那度胺组。
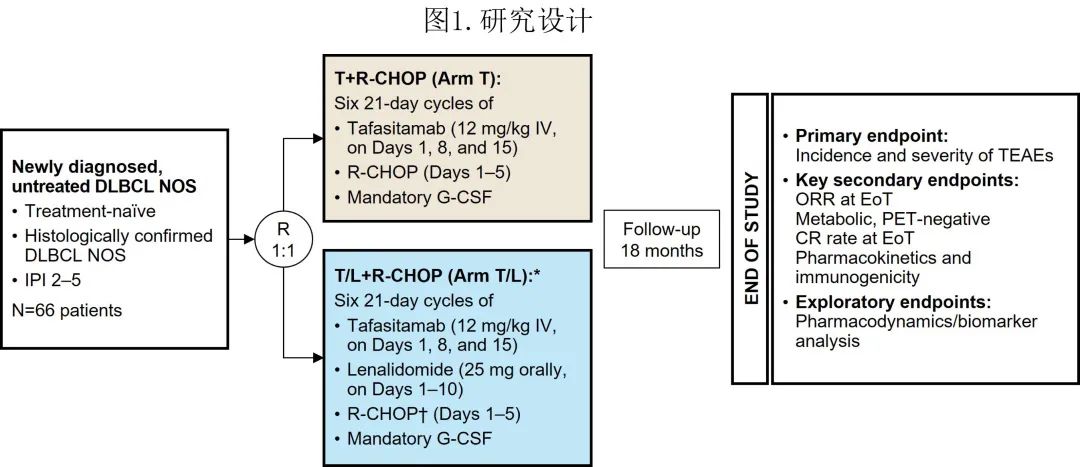
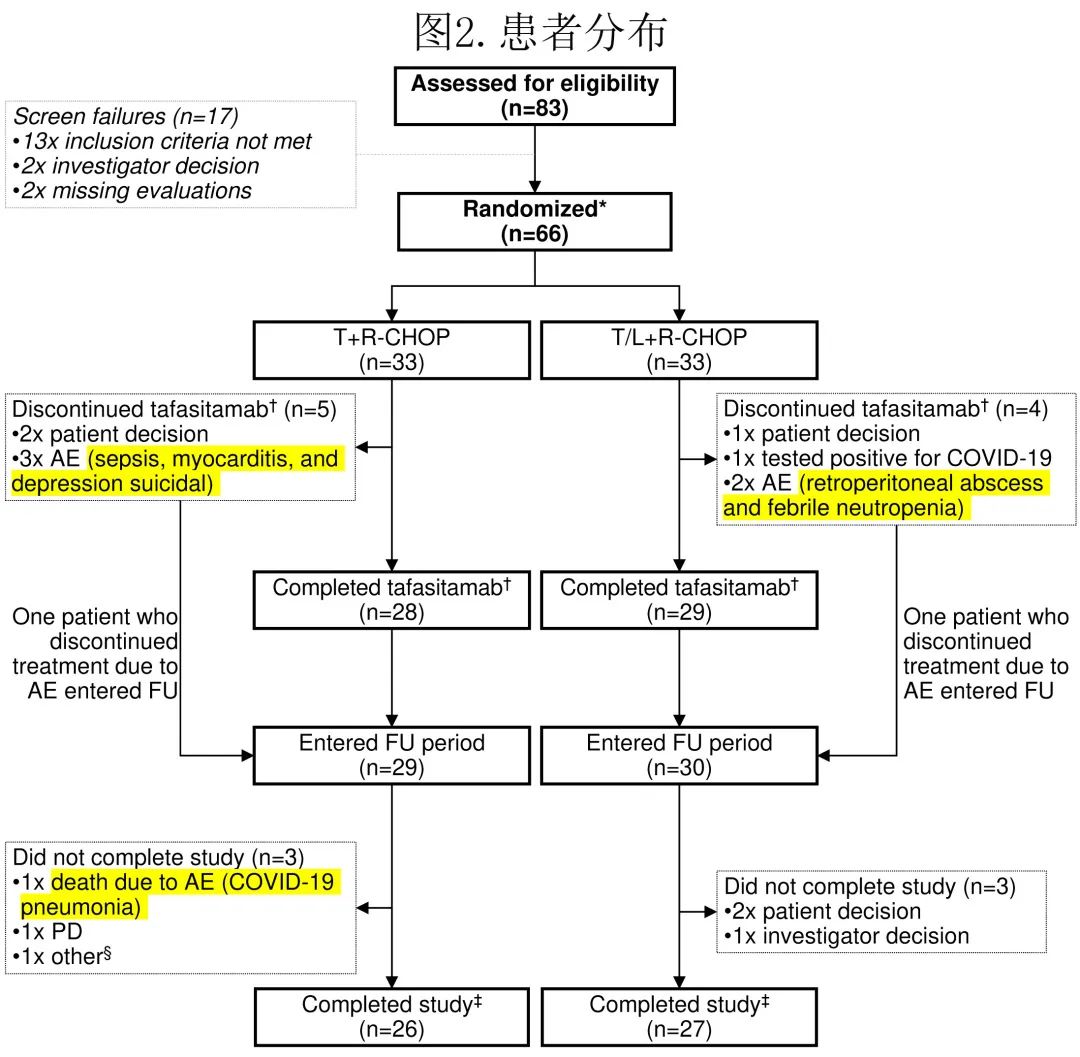
患者
共筛选83例患者,排除17例后剩余66例入组,每组均为33例(图2),接受至少一剂研究药物并进行安全性和有效性评估(即全分析集和安全性分析集相同)。主要疗效分析包括EoT时的ORR,18个月的DoR、DoCR和安全性最终分析,最终数据库锁定日期为2023年2月24日以包括PFS和OS的24个月数据。
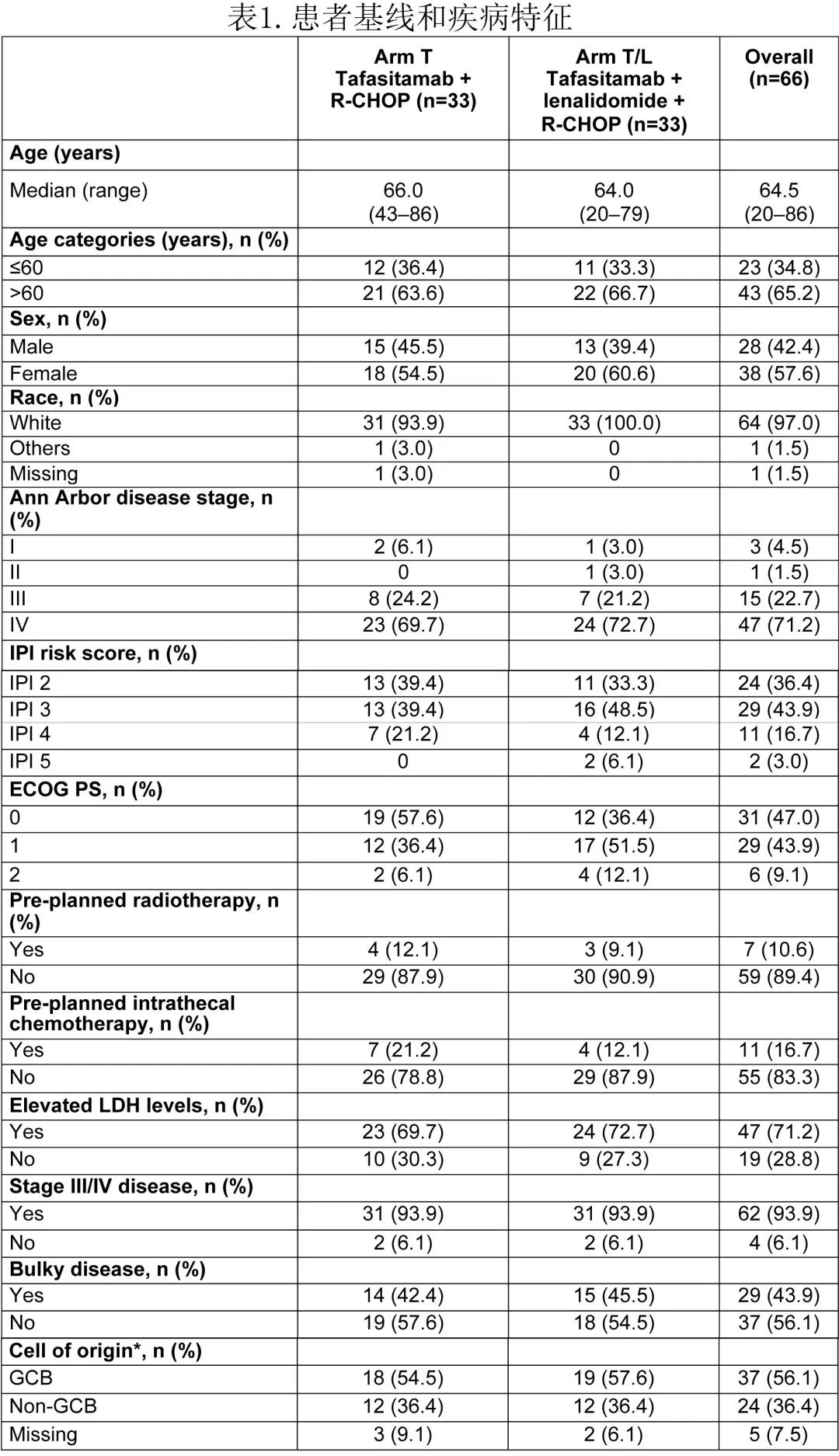
T组(R-CHOP+ tafasitamab)和T/L组(R-CHOP + tafasitamab +来那度胺)之间的基线特征保持平衡(表1)。入组患者的中位年龄为64.5岁;65%的患者>60岁,58%为女性。基线时患者具有高度不良预后因素,如Ann Arbor IV期 (71%)、Ann Arbor III或IV期(94%)和巨大肿瘤(44%)。根据中心评估,36%、44%和20%的患者的IPI评分分别为2、3和4-5,56%的患者具有GCB的COO,而非GCB为36%(8%缺失数据)。
安全性
在安全性导入期未观察到非预期安全性信号(每组n=12),因此继续在主研究阶段每组额外入组21例患者。总体而言,T组26例(78.8%)患者和T/L组27例(81.8%)患者完成了研究治疗(FAS);T组7例患者和T/L组6例患者因退出、AE和新冠肺炎而中止研究(图2)。T组28/33例(84.8%)患者和T/L组29/33例(87.9%)患者完成了所有6个周期的tafasitamab治疗;T/L组中27例(81.8%)患者完成来那度胺治疗。
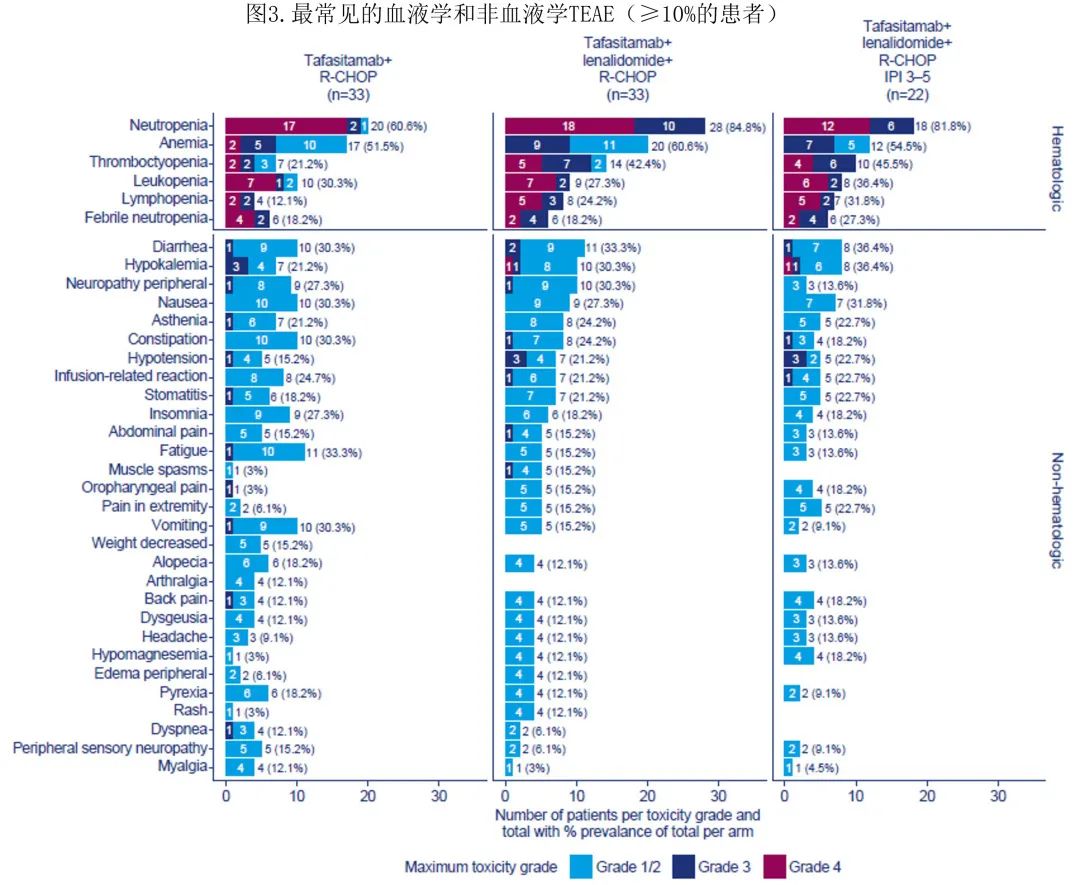
所有66例患者均发生至少1起TEAE,任一治疗组中至少10%的患者发生的最常见血液学和非血液学TEAE总结见图3。总体而言,86%的患者发生至少1起≥3级TEAE(T组中81.8%的患者,T/L组中90.9%的患者)。大多数TEAE为1-2级(T组422/590起事件[72%],T/L组420/658起事件[64%])。T组中2例(6.1%)患者(由于败血症和心脏疾病)和T/L组中1例(3.0%)患者(由于腹膜后脓肿)由于AE而停止研究治疗。3例患者撤回知情同意书(T组n=2,T/L组n=1)。6例(9.1%)患者永久停用tafasitamab(每组3例[9.1%]:T组,脓毒症、心肌炎和抑郁自杀各1例;T/L组,新冠肺炎、腹膜后脓肿和发热性中性粒细胞减少症各1例);T/L组5例(15.2%)患者停止来那度胺给药(新冠肺炎、腹膜后脓肿、中性粒细胞减少各1例,肺栓塞2例[两例患者均接受阿司匹林或低分子量肝素预防静脉血栓栓塞])。未报告第二原发恶性肿瘤(这是来那度胺特别关注的TEAE)。T组中有一例肿瘤溶解综合征。
31/66例(47.0%)患者(T组n=14,T/L组n=17)发生严重TEAE。有3例神经系统严重TEAE,均在T/L组:1例全身性强直阵挛性发作(4级)和2例晕厥(均为3级)。发生6例死亡,包括治疗结束(EoT)后进展导致的1例死亡(T组)和AE导致的5例死亡;EoT前1例(败血症,T组)和EoT后4例(T组,尿脓毒症和新冠肺炎各1例;T/L组,新冠肺炎2例)。
最常发生的血液学TEAE(所有级别)为中性粒细胞减少 (72.7%,n=48/66)、贫血(56.1%,n=37/66)、血小板减少(31.8%,n=21/66)和白细胞减少 (28.8%,n=19/66)。T组和T/L组中分别有57.6%(n=19/33)和84.8%(n=28/33)的患者发生≥3级中性粒细胞减少,分别有12.1%(n=4/33)的患者和36.4%(n=12/33)的患者发生≥3级血小板减少(图3)。
T组中9.1% (n=3/33)的患者需要血小板输注,T/L组为21.2% (n=7/33)。尽管T/L组中≥3级中性粒细胞减少的发生率在数值上增加,但≥3级发热性中性粒细胞减少的发生率均为6例(18.2%)患者。T组中4例发热性中性粒细胞减少患者在14天内恢复;1例患者在16天内恢复,1例患者在数据截止时发热性中性粒细胞减少仍持续存在;在T/L组发生发热性中性粒细胞减少的所有6名患者均在14天内恢复。
最常发生的非血液学TEAE(所有级别)为胃肠道疾病(71.2%)、神经系统疾病(62.1%,包括两组中仅发生的一起3级事件[周围神经病变])、全身性疾病和给药部位反应(60.6%)、感染和侵染(51.5%),及肌肉骨骼和结缔组织疾病(45.5%)。T组无患者发生利妥昔单抗或tafasitamab相关的≥3级IRR;T/L组1例(3.0%)患者发生利妥昔单抗相关3级IRR。T组16例(48.5%)患者发生37起感染/侵染(任何级别)事件,T/L组18例(54.5%)患者发生32起感染事件。安全性方面报告了多种类型的感染,没有优势感染类型。T组4例(12.1%)患者和T/L组3例(9.1%)患者报告重度感染。T组7例(21.2%)患者和T/L组9例(27.3%)患者发生了≥3级治疗后出现的感染和/或侵染;基线时,T/L组报告了1例巨细胞病毒感染和1例尿路感染。未发生>3级皮下反应;T组33例患者中的8例(24.2%)和T/L组33例患者中的13例(39.4%)发生1-2级皮下反应,未发生3级事件。
T组中R-CHOP的平均相对剂量强度(ARDI)为89.7±24.2%,T/L组为94.0±20.4%,表明增加tafasitamab或tafasitamab+来那度胺不会显著影响R-CHOP的ARDI。来那度胺的平均ARDI为78.8±28.0%(来那度胺的平均暴露持续时间:48.8天,最长60天)。T组和T/L组的tafasitamab平均ARDI分别为96.5±14.5%和97.1±12.7%(T组和T/L组的tafasitamab平均暴露持续时间为112.9天和117.3天)。根据方案,使用G-CSF或聚乙二醇化G-CSF进行一级中性粒细胞减少预防是强制性的。
T组的9例(27.3%)患者和T/L组的7例(21.2%)患者在至少一起TEAE后中断tafasitamab给药。第一周期4例(6.1%)患者由于IRR中断tafasitamab给药,每组2例患者,均完成了给药。所有IRR事件均发生在首次输注期间;后续输注期间未发生中断。每组各有4例(12.1%)患者在输注期间发生利妥昔单抗中断,但均完成给药。6例(18.2%)患者由于血液学和非血液学毒性(各3例患者[9.1%])和其他原因(给药错误;2例[6.1%]患者)接受了至少一次来那度胺剂量减低。T/L组中22例(66.7%)患者跳过至少一次来那度胺给药。18/66例(27.3%)患者因AE延迟至少一次R-CHOP给药(任何组分);T组中11例(33.3%),T/L组中7例(21.2%)。
疗效
T组和T/L组在EoT访视时的ORR分别为75.8% (25/33)和81.8% (27/33),CR分别为72.7% (24/33)和66.7% (22/33)。在最终分析时,T组的最佳ORR(研究期间至少证实一次CR或PR的患者比例)为90.9%(CR率87.9%;PR率3.0%),T/L组为93.9%(CR率75.8%;PR率18.2%)。
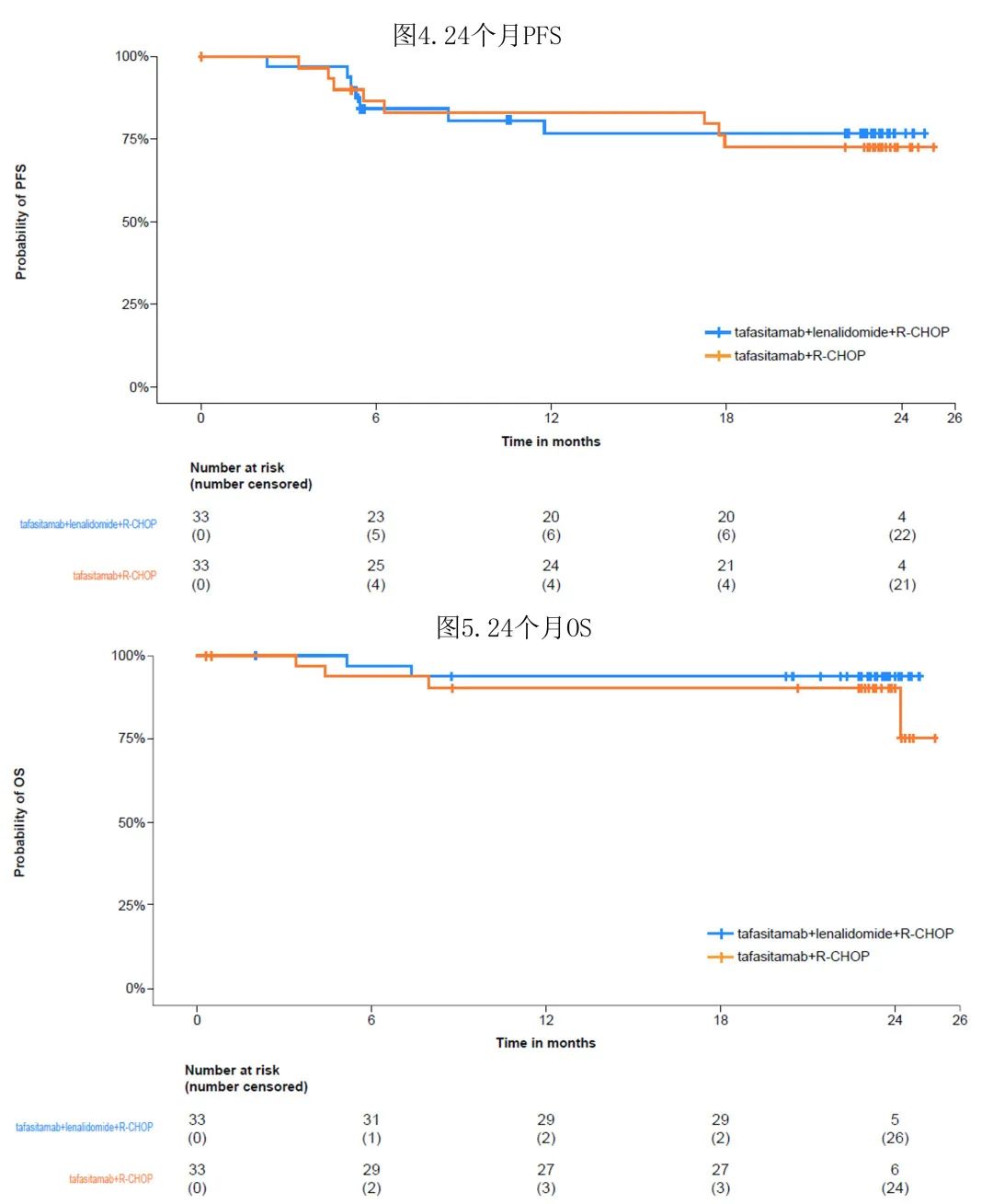
在最终分析时(所有患者在EoT访视后≥18个月随访),T组的18个月DoR和DoCR率分别为72.7%和74.5%,T/L组为78.7%和86.5%(表2)。
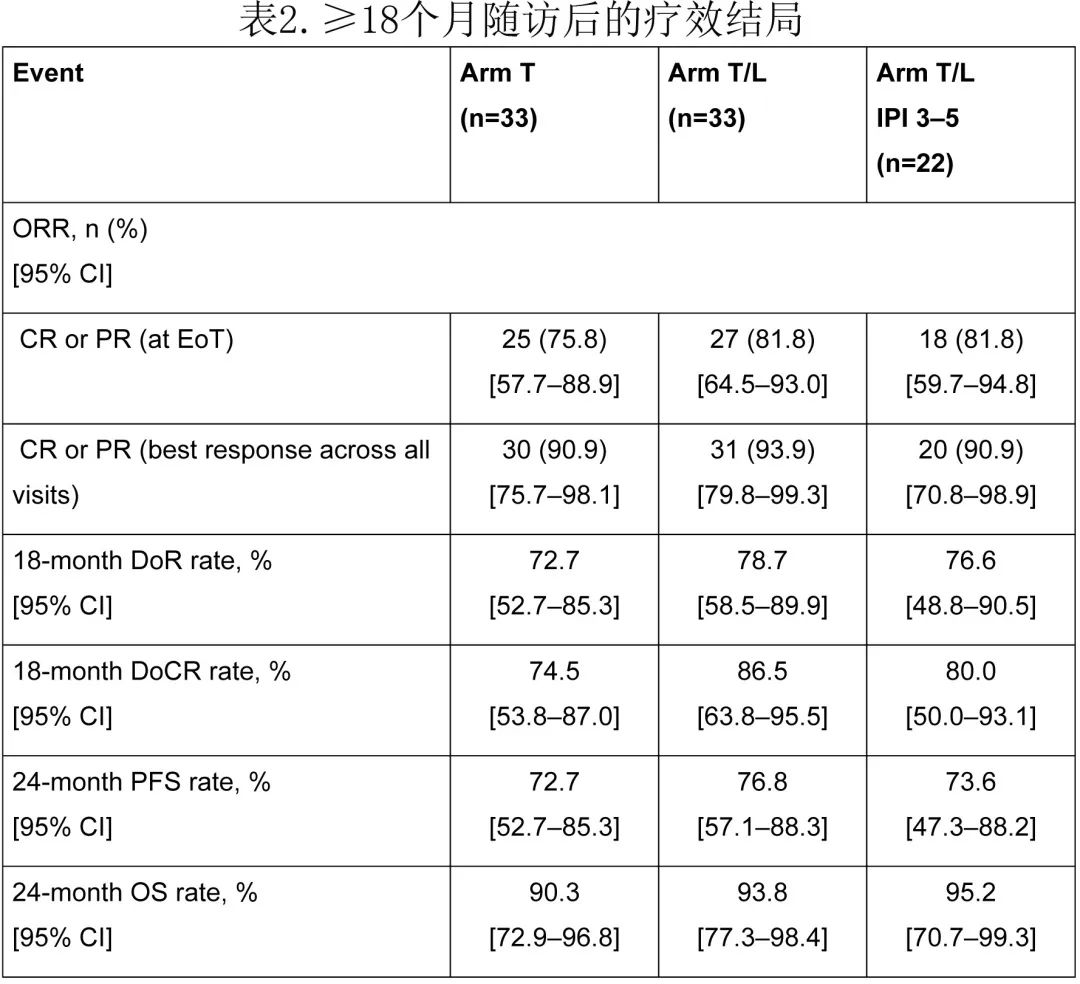
此外,在24个月随访时,T组的PFS率为72.7%,T/L组为76.8%(图4)。24个月OS率分别为90.3%和93.8%(图5)。
事后分析
T组中总计60.6%患者和T/L组中66.7%患者的IPI评分为3-5分。在T/L组中IPI评分为3-5分的患者(n=22)中,ORR、18个月DoR和DoCR、24个月PFS和OS率与T/L组总体治疗队列相当(表2),安全性也与整个T/L组队列相当(图3)。
总结
R-CHOP+tafasitamab+来那度胺组和R-CHOP+tafasitamab组各33/组患者。所有患者均发生≥1起治疗后出现的不良事件,大多数为1/2级;T组57.6%和12.1%的患者发生≥3级中性粒细胞减少和血小板减少,T/L组则分别为 84.8%和36.4%。两组间非血液学毒性发生率相似。两组中R-CHOP的平均相对剂量强度为≥89%。T组EoT时的ORR为75.8% (CR 72.7%),T/L组为81.8% (CR 66.7%),最佳ORR分别为90.0%和93.9%。18个月缓解持续时间和CR持续时间分别为72.7%和74.5%(T组)以及78.7%和86.5%(T组/L);24个月无进展生存率和总生存率分别为72.7%和90.3%(T组)以及76.8%和93.8%(T组/L)。两组中均观察到可管理的安全性和有效信号。
该研究确定了在IPI 2–5 DLBCL患者的一线治疗中,在R-CHOP中添加tafasitamab±来那度胺的可行性,证明了其安全性特征可管理。III期frontMIND(NCT04824092)正在评估R-CHOP中添加tafasitamab+来那度胺的潜在获益,刚完成招募,初步结果可能于2025年公布。
参考文献
Belada D,et al. Safety and efficacy of tafasitamab ± lenalidomide added to first-line R CHOP for DLBCL: Phase 1b First-MIND study.Blood . 2023 Jun 27;blood.2023020637. doi: 10.1182/blood.2023020637.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














厉害
43