Cell:脑脊液免疫失调是导致阿尔茨海默病等认知障碍新的罪魁祸首
2022-12-20 生物世界 生物世界 发表于上海
这项研究表明,脑脊液免疫系统在阿尔茨海默病等认知障碍疾病中发挥重要作用,并发现CXCL16-CXCR6信号通路是抗原特异性T细胞进入大脑的分子机制。
阿尔茨海默病(Alzheimer's disease, AD),俗称“老年痴呆症”,是一种严重的神经退行性疾病,患者通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。目前,全球约有5000万人罹患阿尔茨海默病。随着人类平均寿命增长,老年化社会加剧,阿尔茨海默病的患病率也在不断上升,预计到2050年,阿尔茨海默病患者将增加至1.5亿以上。
仅在中国,65岁以上人群中阿尔茨海默病的发病率是5%,且每增加10岁,发病率就增加5%。也就是说,在85岁的人群中,每2-3个高龄老人就有一个是阿尔茨海默病患者,这对家庭、社会造成巨大负担。因此,如果能揭示阿尔茨海默病的具体病因,对该疾病的药物研发和患者治疗至关重要。
2022年12月13日,美国西北大学范伯格医学院的研究人员在 Cell 上发表了题为:Cerebrospinal fluid immune dysregulation during healthy brain aging and cognitive impairment(健康大脑衰老与认知障碍期间的脑脊液免疫失调)的研究论文。
该研究发现,随着年龄的增长,老年人的脑脊液免疫系统会逐渐失调。并且,在患有阿尔茨海默病等认知障碍疾病的人中,脑脊液免疫系统的分子特征与健康个体截然不同。这些结果揭示了脑脊液免疫失调可能是导致阿尔茨海默病等认知障碍的罪魁祸首。

神经炎症是与年龄相关的神经退行性疾病的病理标志,而脑脊液(CSF)免疫系统是大脑免疫的关键因素。最近的研究表明,脑脊液向颅骨骨髓的免疫细胞提供分子线索,以改变小鼠脑脊液中的髓系细胞群。
然而,关于衰老调节脑脊液免疫系统的分子机制,以及脑脊液免疫如何随着年龄增长或神经变性疾病而改变,科学家们仍然缺乏认知。
因此,在这项最新研究中,研究团队通过单细胞RNA测序技术分析了健康个体和认知障碍患者的脑脊液免疫系统。研究的第一部分分析了45名54-83岁健康个体的脑脊液,第二部分则将健康组的统计数据与14名阿尔茨海默病患者和认知障碍患者的脑脊液进行了比较。
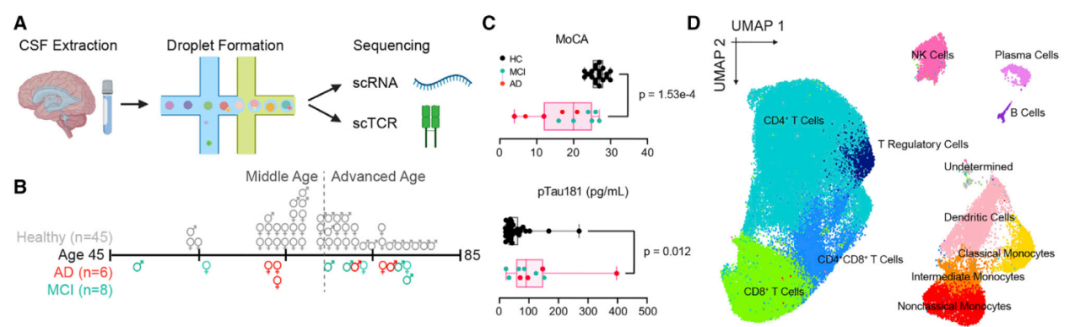
研究设计和脑脊液免疫细胞基因表达变化的线性建模
研究团队在健康老年人的脑脊液免疫细胞中观察到基因变化,这些变化使免疫细胞随着年龄的增长变得更加活跃并导致炎症。打个形象的比喻,老年人的脑脊液免疫细胞像是一个发脾气的“老顽童”,这种愤怒可能会使这些细胞功能减弱,导致大脑免疫系统失调。
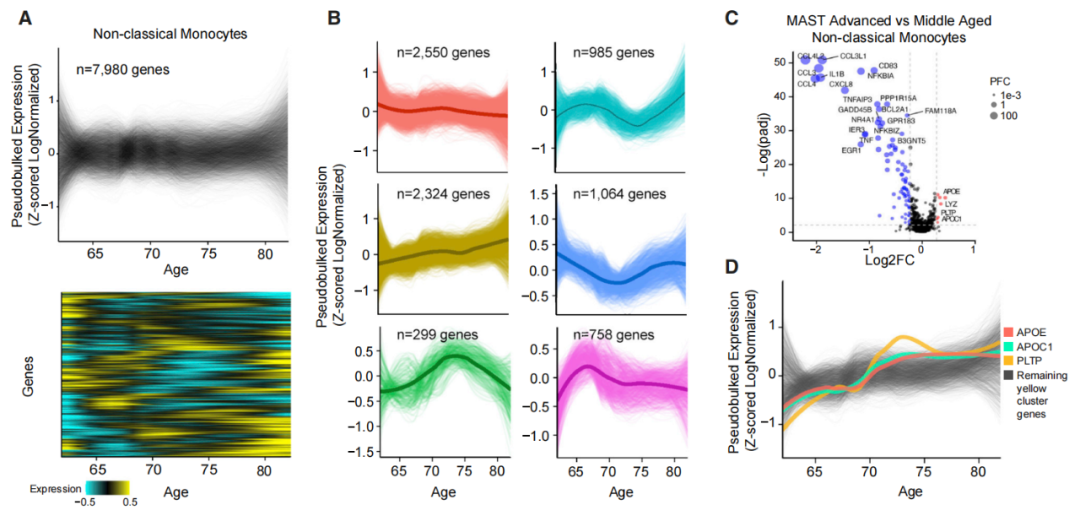
随年龄的增大,健康老年人的脑脊液免疫细胞的基因表达发生变化
不仅如此,研究团队还发现,在认知障碍患者中,单核细胞脂质转运基因的下调与CD8 T细胞的细胞因子信号转导改变同时发生。克隆性CD8效应性记忆细胞上调认知障碍患者的C-X-C基序趋化因子受体6(CXCR6)。
值得注意的是,CXCR6的配体——C-X-C趋化因子配体16(CXCR6),在认知障碍受试者的脑脊液中升高,表明CXCL16-CXCR6信号通路是抗原特异性T细胞进入大脑的机制。这些细胞有过量的细胞受体——CXCR6,它起着天线的作用,这种受体从退化的大脑小胶质细胞接收CXCL16信号而进入大脑。
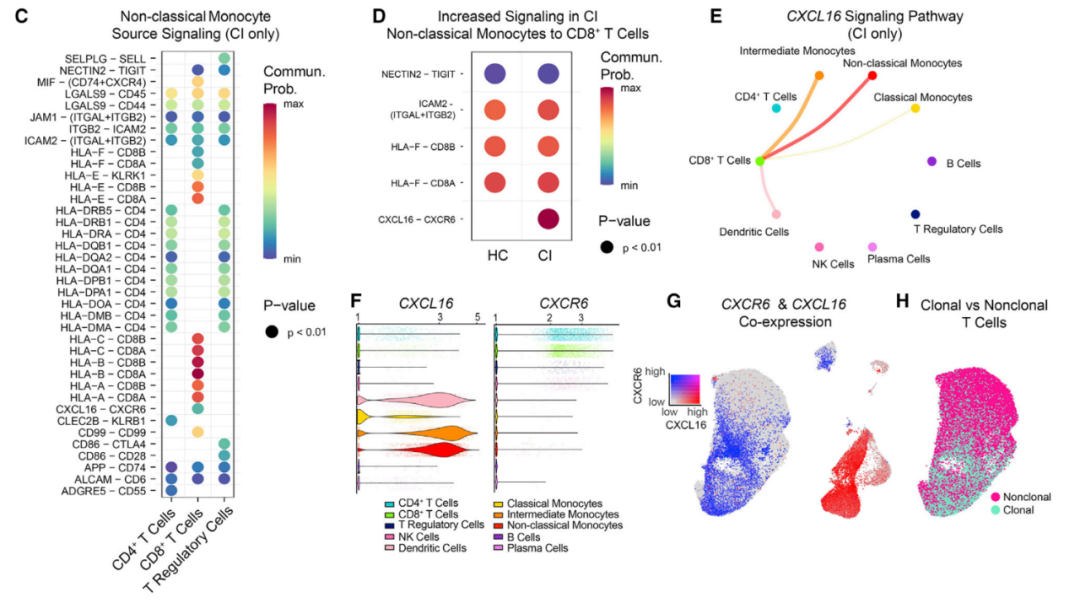
在认知障碍患者的脑脊液中,单核细胞通过CXCL16-CXCR6信号通路与CD8+ T细胞通信
这些结果表明,认知障碍患者退化的大脑激活了抗原特异性T细胞,使它们自我克隆并进入大脑,由于这些细胞原本并不属于那里,因此很可能对大脑造成损伤。如果事实的确如此,那么就能找到一种治疗认知障碍的策略——阻断CXCL16信号或抑制CXCR6受体。
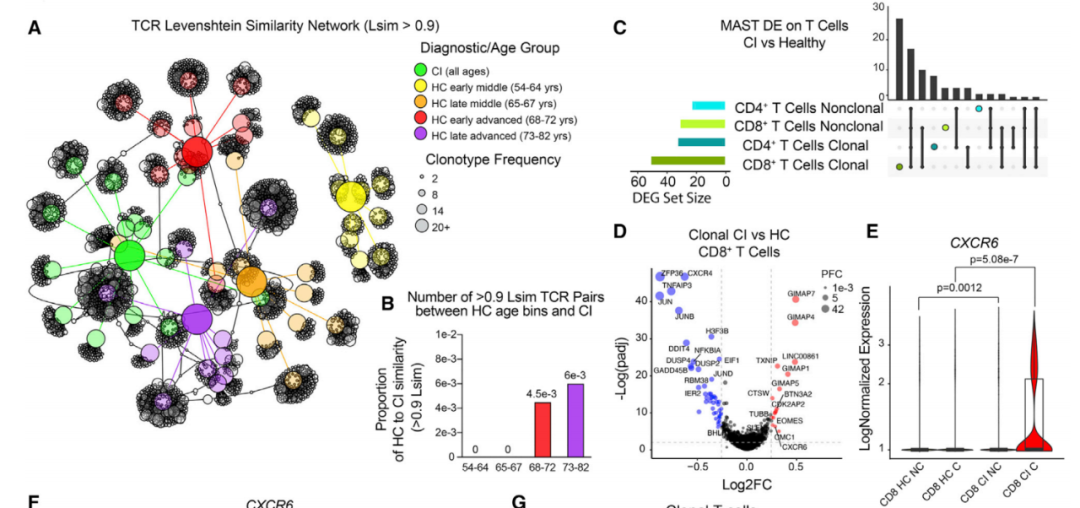
在认知功能障碍患者的脑脊液中,克隆扩张的T细胞对大脑造成损伤
总而言之,这项研究表明,脑脊液免疫系统在阿尔茨海默病等认知障碍疾病中发挥重要作用,并发现CXCL16-CXCR6信号通路是抗原特异性T细胞进入大脑的分子机制。这些结果揭示了健康大脑衰老与认知障碍期间的脑脊液免疫失调,为认知障碍相关的脑部炎症的诊断和治疗提供关键基础。
论文链接:
https://doi.org/10.1016/j.cell.2022.11.019
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










学习了
46
好文章,谢谢分享。
43