eGastroenterology:基于原发性硬化性胆管炎(PSC)背景下胆管癌的诊疗进展
2024-05-15 eGastroenterology eGastroenterology 发表于上海
文章系统阐述了基于原发性硬化性胆管炎(PSC)背景下胆管癌的病因、分型及相应诊疗进展。
导 读
原发性硬化性胆管炎(Primary sclerosing cholangitis, PSC)是一种罕见的胆汁淤积性肝病,其特征是持续的胆道炎症导致胆道纤维化和多灶性狭窄。该疾病包括无症状到发展为终末期胆汁性肝硬化,甚至进展为胆道癌(biliary tract cancer, BTC),特别是胆管癌(cholangiocarcinoma, CCA)的风险增加。PSC是年轻人发生CCA最重要的危险因素,据报道其终生患病率在6%至13%之间。其中肝门周围CCA(perihilar CCA, pCCA)涉及肝管分叉,是最常见的CCA,约占所有病例的50%,而位于肝实质内的肝内CCA(intrahepatic CCA, iCCA)占不到10%(见图1)。
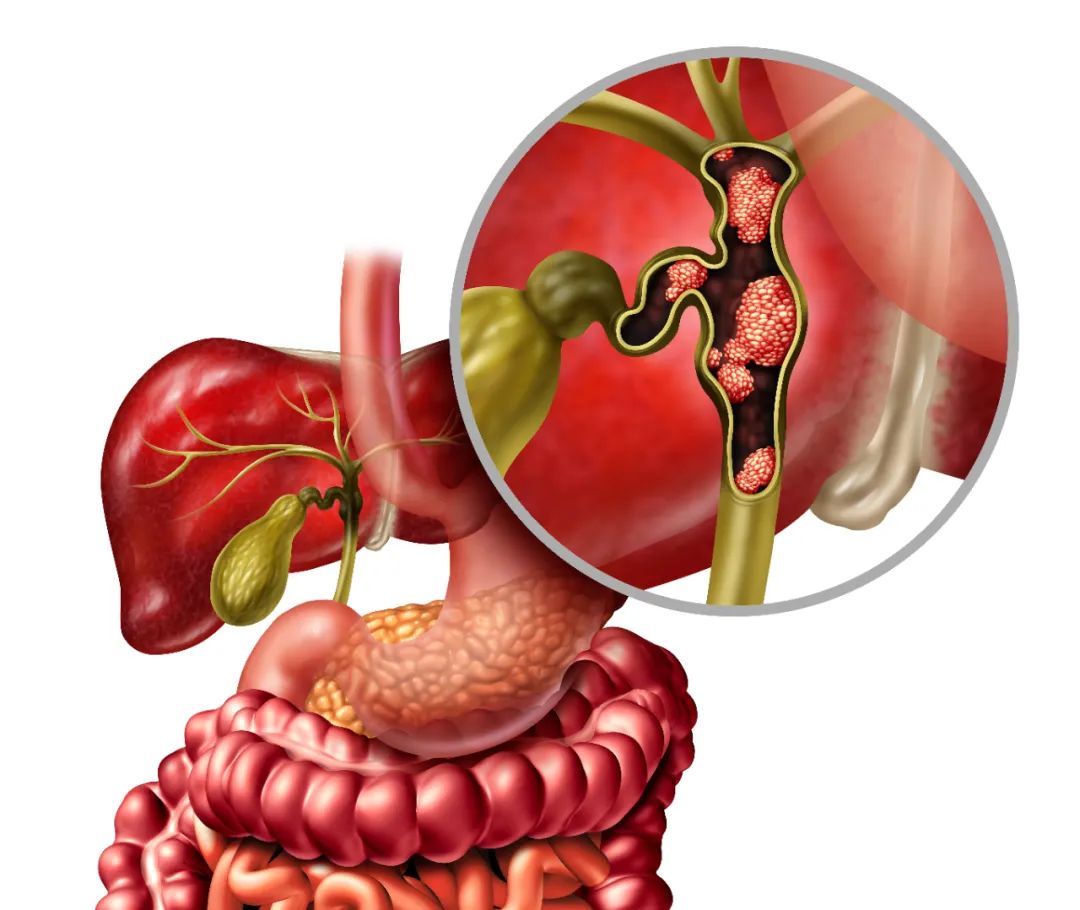
图1:胆管癌的表现形式
CCA是一种侵袭性肿瘤,只有少数患者适合手术切除以达到治疗目的。根治性肝切除术和肝移植是PSC患者在没有出现转移或局部晚期疾病的情况下潜在的治疗手段,而对于不能切除的pCCA患者可以考虑肝移植联合新辅助放化疗。最近的报道表明,iCCA肿瘤较小的移植患者和局部晚期疾病患者在新辅助治疗后相较于iCCA移植的患者会取得较好的预后。
目前CCA的治疗主要面临无法早期诊断的关键问题,从而导致预后不佳。本综述旨在聚焦于PSC-CCA患者的诊断及治疗的最新进展。
鉴于此,近期,瑞典卡罗林斯卡医学院Christina Villard教授团队在eGastroenterology上发表了题为“Treatment of cholangiocarcinoma in patients with primary sclerosing cholangitis: a comprehensive review”的综述文章,系统阐述了基于原发性硬化性胆管炎(PSC)背景下胆管癌的病因、分型及相应诊疗进展。

原发性硬化性胆管炎(PSC)是什么?
PSC是一种罕见的胆汁淤积性肝病,其特征是持续的胆道炎症导致胆管纤维化和多灶狭窄。疾病囊括无症状到发展为终末期胆汁性肝硬化,以及胆道癌(BTC),特别是胆管癌(CCA)的风险增加。从早期到成年晚期,PSC主要影响30 - 40岁的男性。PSC与炎症性肠病(inflammatory bowel disease, IBD)密切相关,PSC-IBD代表了一种最明确的表型,其结直肠发育不良的发病率增加。小管型PSC主要累及外周胆管,症状较少,而大胆管型或经典PSC主要累及较大胆管,更易出现胆汁淤积症状。伴有自身免疫性肝炎(autoimmune hepatitis, AIH)特征的PSC通常影响年轻患者。一部分PSC患者血清IgG4水平升高,这与较差的临床结果相关。目前针对PSC的治疗没有药物能够根治性治疗,仅仅去氧胆酸能够改善肝功能等指标。因此,肝移植仍然是终末期肝病唯一可能治愈的治疗选择。最终,CCA成为PSC患者最常见的死亡原因,与一般人群相比,PSC患者出现CCA的风险增加了100倍,在PSC诊断后的第一年内,CCA的风险最高,其次是每年0.2%-1.5%的风险,这表明CCA与PSC的持续时间无关。其中PSC患者的CCA与合并IBD相关,特别是溃疡性结肠炎以及高龄PSC患者,而具有AIH和小导管疾病特征的患者发生CCA的风险较低。
PSC背景下胆管癌的病因、分型及诊断
PSC的发病机制与遗传易感性和环境因素之间的相互作用有关,通过多种免疫介导的胆管细胞的慢性损伤。PSC患者的CCA发病机制同样归因于由于胆管细胞持续炎症而导致胆管细胞的异常增殖并最终演变为癌症。与一般的CCA的分布类似,PSC-CCA可以发生在胆道树的任何部位,其中最常见的是汇合部的肝门周围CCA (pCCA),其次是胆总管远端的远端CCA(dCCA),以及肝内CCA(iCCA)(见图2)。pCCA在形态学上可分为导管内、导管周围和肿块型三种。其中管周亚型是最常见的亚型,具有典型的纵向生长方式,可引起胆道狭窄。与iCCA相关的遗传改变包括异柠檬酸脱氢酶加氢酶1和2(IDH1/2)、神经母细胞瘤RAS癌基因(NRAS)和成纤维细胞生长因子受体2(fibroblast growth factor receptor 2, FGFR2),而肿瘤蛋白p53、kirsten大鼠肉瘤病毒癌基因、v-raf小鼠肉瘤病毒癌基因同源物B1和抗四肢癫瘫转录因子抑制因子4的突变在肝外CCA中更为普遍。通过基因组方法评估,已经描述了iCCA的两个分子亚群:以炎症信号通路的激活为特征的炎症亚群和以参与细胞周期调节的细胞信号为特征的增殖亚群,后者与病人的较差预后有关。此外,PSC患者同样增加了患胆囊息肉的恶性癌变,导致患胆囊癌的风险增加。
由于诊断局限性和无特异性症状,在PSC患者中识别CCA仍然很困难。pCCA和dCCA患者通常表现为肿瘤导致的胆道梗阻,而iCCA的症状通常不具有特异性。当怀疑PSC-CCA时,MRI/磁共振胆管素造影术(MRI/MRCP)是首选的成像方式。PSC患者的CCA被归因于严重狭窄的发展,即显性/高级狭窄。然而,占主导地位的/高度的狭窄可能没有症状,并且在PSC诊断时大约50%的患者中存在。另一种类似恶性胆道狭窄的疾病是IgG4相关的全身性疾病,这是一种以IgG4阳性浆细胞浸润为特征的全身性炎症综合征。这种对糖皮质激素反应良好的全身性炎症,当仅影响胆管时,可能难以与CCA区分。PSC的恶性狭窄尤其是在没有明细肿块时很难识别,通常需要获取组织病检。通过刷细胞学和互补荧光原位杂交(fluorescence in situ hybridisation, FISH)通过内窥镜逆行胆管胰胆管造影术获得的组织样本提高了恶性狭窄的诊断,但灵敏度较差,约为70%。超声内镜下细针抽吸可用于诊断dCCA,但若考虑肝移植则应避免此操作。在肝移植体中偶然发现的CCA的数量从1%到7%不等,进一步说明了早期发现CCA的困难。目前正在寻找可早期检测CCA的生物标志物。糖链抗原19-9(CA19-9)是癌细胞分泌的一种糖类,是CCA最常用的生物标志物。CA19-9水平升高,特别是在没有细菌性胆管炎和存在可疑病变的情况下,与CCA有关,但CA19-9的测定对预测CCA的价值有限。CA19-9的合成也依赖于岩藻糖转移酶2和3,这些酶的基因分型已被证明可以提高CA19-9在PSC患者中检测BTC的诊断诊断价值,灵敏度接近80%。
CCA的早期监测
早期监测PSC患者的CCA发生具有潜在生存获益。来自三级诊疗中心的回顾性研究报道接受定期监测的患者的能够获得较好的生存获益和/或较低肝胆癌相关死亡风险。尽管证据有限,但建议PSC患者定期进行影像学检查。然而,在最近的一项前瞻性监测队列研究中,在未选择的PSC患者队列中,发现每年MRI/MRCP对早期诊断CCA无效。相反,在PSC诊断时,如果出现新症状,可能建议患者进行MRI/MRCP监测,并更定期地对疾病晚期患者进行监测。
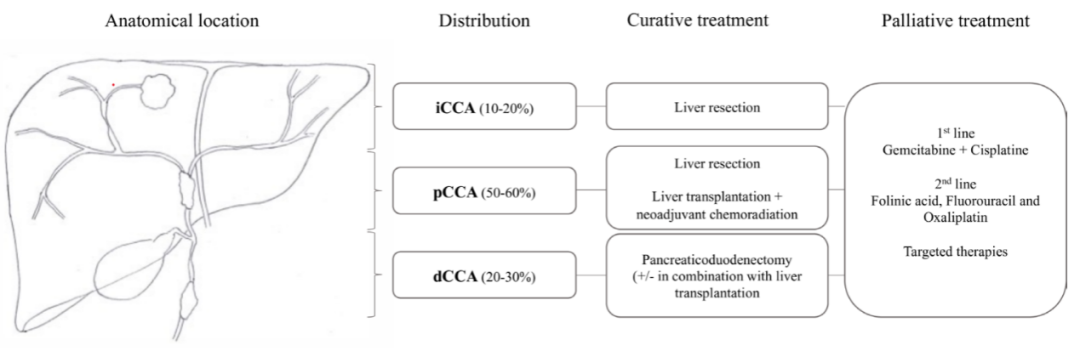
图2:原发性硬化性胆管炎背景下肝内、肝门及远端胆管癌的解剖位置、分布及治疗方案。
注:dCCA, , distal cholangiocarcinoma, 远端胆管癌; iCCA, intrahepatic cholangiocarcinoma, 肝内胆管癌; pCCA, perihilar cholangiocarcinoma, 肝门周围胆管癌。
图源:原文图1
PSC背景下胆管癌的诊疗
对于原发CCA患者和PSC背景的CCA患者,相关治疗手段通常相似,但PSC患者的潜在肝脏疾病可能影响治疗方案。以下部分首先根据胆管癌的分型初步描述CCA的一般治疗,再进一步根据PSC背景的患者提供具体诊疗方案。
1. 肝门部胆管癌(pCCA)的诊疗方案
■ 手术切除
对于pCCA的治疗,如果能在保留肝功能的情况下实现根治,肝切除术是一种潜在的根治性方案。估计未来肝残量(future liver remnant, FLR)用于避免术后肝功能不全,肝功能正常患者的FLR最低为20%,慢性肝病患者的FLR最低为40%。pCCA的手术切除十分复杂,因为它通常需要扩大切除和血管重建。尽管如此,根治性切除也很难完成,且术后并发症发病率很高而长期生存率仍然很低,据报道5年生存率仅为20%至40%。根据目前的指南,切除BTC的患者需要接受6个月的卡培他滨辅助化疗。由于潜在的实质肝脏疾病和跳跃式癌变进展的倾向,PSC-pCCA的肝脏切除术更具挑战性,尽管切除时间延长,但往往导致窄切缘、高发病率和死亡率。瞬时弹性成像可用于评估肝纤维化,并有助于确定PSC-pCCA患者是否可以切除大肝并保留足够的肝体积。在移植肿瘤学时代,PSC相关的pCCA被认为是不可切除的,最近关于PSC患者接受肝脏切除的数据是有限的,这是可以理解的。2018年的一项北美多中心研究报告了伴有和不伴有PSC的可切除pCCA患者的类似结果,其5年总生存率(overall survival, OS)和无病生存率(disease-free survival, DFS)约为20%。研究证实淋巴结受累、血管侵犯、肿瘤分化低和年龄越大,OS越差。最近的一项多中心研究报告,移植组的5年生存率为64%,而切除组为18%。与切除患者相比,移植患者更年轻,PSC发生率更高。在手术切除和肝移植两组患者之间的临床病理特征差异,包括可切除性和淋巴结状态,这些能够筛选手术方式但会影响两种治疗方式之间的对比结果。目前,法国正在进行一项无PSC的CCA的随机意向治疗多中心试验,比较新辅助放化疗后肝移植与肝切除术的效果。
■ 肝移植
在过去的几十年里,肝移植已经成为PSC和原发CCA患者中pCCA的潜在治疗选择。这里描述了肝移植治疗pCCA的范式转变,特别是关于PSC-CCA。最初肝移植治疗pCCA的特点是复发率高,生存率低。1993年,梅奥诊所制定了一项方案,用于治疗不可切除的,新生的早期pCCA或PSC中出现的早期pCCA,在放化疗后进行肝移植。
梅奥协议[1]:根据梅奥方案选择符合治疗条件的患者是根据以下标准:胆管造影显示为恶性狭窄,并符合以下条件之一:(1)刷片细胞学或组织活检阳性或强烈怀疑CCA,(2)CA19 - 9水平>100U/mL,无急性细菌性胆管炎,(3)FISH多体或径向直径<3cm的肿块形成病变。肝外疾病患者,既往腹部经皮放射治疗。经肝肿瘤活检和排除肝移植的条件不适合治疗。严格遵守梅奥协议的选择标准能够使肝移植治疗后患者获得较好的预后。
■ 姑息治疗
大多数pCCA患者在诊断时已经丧失了根治性肝切除术或肝移植手术的机会。在双侧二级胆管受累、双侧或对侧肝动脉或门静脉包裹、肝内或肝外转移和远端淋巴结转移的情况下,pCCA被认为不可切除。此外,根据梅奥标准,患者能够进行放化疗和肝移植。根据欧洲最近的一项研究,这一比例只有5%。此外,由于疾病进展、治疗不耐受和死亡,移植前病例失访约占10%到60%。不可切除的pCCA预后较差,无论是PSC相关的CCA患者还是原发CCA患者,吉西他滨联合顺铂作为一线化疗,FOLFOX(folinic acid, fluorouracil and oxaliplatin, 亚叶酸、氟尿嘧啶和奥沙利铂)作为二线化疗方案,其中位生存期不到一年。大约20%的患者不符合积极姑息治疗的条件,只能接受支持治疗。
■ 靶向药物治疗
Durvalumab是一种与程序性死亡配体1(programmed death ligand 1, PDL1)结合并通过抑制T细胞效应功能诱导细胞凋亡的单克隆抗体[2]。据报道,durvalumab联合吉西他滨和顺铂的治疗方案能够延长晚期BTC患者的生存期。IDH1/2基因的突变导致过量产生一种重要的肿瘤代谢物。在iCCA患者中,使用IDH1抑制剂Ivosidenib(艾伏尼布)治疗后取得临床获益。CCA中克隆性FGFR2基因融合导致促进肿瘤进展的多个信号网络的激活。目前有一项正在进行的III期试验,采用选择性抑制FGFR2英菲格拉替尼(Infigratinib)治疗FGFR2突变的iCCA患者。
2. 肝内胆管癌(iCCA)的诊疗方案
■ 手术切除
对于一般的iCCA,如果有足够的残肝体积,则推荐根治性肝切除术,其5年生存率约为30%-40%[3]。门静脉阻断、肝静脉阻断和两期肝切除包括联合肝分区和门静脉结扎进行分阶段肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)是优化FLR容量和实现根治性切除的手术策略。除了主要的肝脏切除外,淋巴结切除术也常用于改善预后。在选定的患者中可以考虑微创肝脏手术。肝切除术后复发的风险约为60%-70%,与血管侵犯、侵袭性生物学特征、手术窄切缘和淋巴结转移有关,且大多数复发出现在肝脏。与pCCA患者实施肝切除类似,切除的iCCA患者可以给予卡培他滨辅助治疗以改善OS和DFS。对于前期可切除的iCCA患者,新辅助化疗并不常规提供,但已证明可在部分晚期iCCA患者中实现切除。在iCCA研究中,PSC患者的数量很少。在20年的时间里,830名PSC患者中,19名患者发展为iCCA。7例患者被切除,其余12例患者为晚期和/或弥散性疾病。所有19例患者的5年OS为12%。
■ 肝移植
由于iCCA成活率低,长期以来被认为是肝移植的禁忌症。然而当移植患者的生存获益被报道时,这一观点受到了挑战,在移植患者中,iCCA <2cm首次发现于原生肝脏。随后的一项研究在iCCA <5cm和>2cm的患者中也发现了一个获益的结果,该研究比较了移植患者和切除患者的5年DFS分别为67%和36%切。对局部晚期iCCA进行新辅助治疗后的肝移植也进行了评估,在12例前瞻性病例系列中取得了令人鼓舞的结果。非肝硬化、局部晚期无肝外疾病或血管累及的iCCA患者在吉西他滨化疗后接受肝移植治疗在至少6个月的放射反应或稳定后,患者被列入肝移植名单5年OS为83%,5年DFS为50%在21例纳入评估的患者中,9例患者因肝外疾病被认为不合格,2例患者被降级为可切除的疾病。在12例列入肝移植的患者中,6例患者已进行肝移植,3例患者在研究结束时等待肝移植,2例患者因粘连严重未接受移植,1例患者在探查时发现可切除的疾病而行部分肝切除术。目前正在进行前瞻性临床试验来评估iCCA患者的肝移植。一项以北美和西班牙为基础的前瞻性临床试验评估了因下肝脏疾病而不适合肝切除术的小iCCA患者的肝移植,同一系列研究的一部分也探讨了新辅助化疗后局部晚期iCCA的肝移植效果。此外,挪威的一项试验正在研究新辅助化疗后不可切除的iCCA患者肝移植的结果
■ 姑息治疗
由于缺乏PSC相关iCCA的具体数据,这些患者被视为新发iCCA患者。iCCA是CCA中预后最差的一种,在PSC患者和无PSC的对照组中,iCCA通常出现在晚期,不到30%的患者可以接受根治性手术切除。iCCA主要转移到肺、远处淋巴结和骨,而pCCA和dCCA更常转移到肝脏和腹膜。不可切除的iCCA患者给予姑息性化疗,与pCCA类似,吉西他滨和顺铂联合化疗为一线化疗,FOLFOX为二线化疗。由于iCCA诊断晚、恶化快和存在肝功能障碍,PSC患者接受积极姑息治疗的可能性也较小。有研究对于肝脏局部治疗(locoregional therapies, LRTs)的局部晚期、不可切除疾病患者进行了评估,经动脉化疗栓塞、外放射治疗(external bean radiotherapy, EBRT)、肝动脉灌注化疗和经动脉化疗栓塞的总生存期从13到21个月不等。但到目前为止,LRT还没有被认为是不可切除iCCA的标准治疗方法。此外,患者可以接受靶向治疗,如上关于pCCA姑息治疗一节所述。
3. 远端胆管癌(dCCA)的诊疗方案
■ 胰十二指肠切除术
胰十二指肠切除术是一种潜在的治疗dCCA的手术治疗方法,据报道其5年生存率为22%。切除的患者给予卡培他滨辅助治疗在dCCA和同时自发性pCCA的情况下,胰十二指肠切除术可以考虑同时或桥接进行肝移植。流行病学研究中报道的PSC患者胰腺癌发病率较高的部分原因可能实际上是dCCA。
■ 姑息治疗
对于不可切除的iCCA和pCCA,采用吉西他滨联合顺铂作为一线化疗方案,FOLFOX作为二线化疗方案。关于PSC患者不可切除的dCCA的具体研究数据有限。此外,患者亦可考虑接受靶向治疗,如pCCA姑息治疗部分所述。
结论
在过去的几十年里,PSC-pCCA的治疗方法不断发展,在经验丰富的临床中心,可以针对特定患者进行相应的治疗手段能够取得不错的预后,但最关键的问题仍是尽早发现pCCA以实现治疗。尽管随着诸如FISH及影像学鉴别胆管恶性狭窄的不断进步,早期诊断也不断改善,但目前大多数患者仍然是晚期被诊断出来的,无法得到治愈。因此,在目前更先进的监测策略或早期诊断测试出现并实施之前,应该建议降低诊断阈值,特别是在癌症风险高的患者中,例如,高质量的MRI/MRCP在PSC诊断时具有最高价值。同时,在出现新的临床症状时,可进行复查监测,并定期用于疾病晚期患者。肝移植治疗方式治疗CCA的模式转变已经在pCCA中发生,可能在iCCA中进一步发展,但高度依赖于符合条件的患者群体的特征和评估新辅助化疗。因此,针对PSC-CCA的不同类型,能够综合采用手术切除、肝移植、化疗乃至靶向治疗手段可获得较好的预后。
引证本文
Villard C, Jorns C, Bergquist A. “Treatment of cholangiocarcinoma in patients with primary sclerosing cholangitis: a comprehensive review.” eGastroenterology, 2024;0:e100045.
https://egastroenterology.bmj.com/content/2/1/e100045
参考文献
1.Heimbach J, Gores G, Haddock M, et al. Liver transplantation for unresectable perihilar cholangiocarcinoma. Semin Liver Dis, 2004;24:201–7.
2. Stewart R, Morrow M, Hammond SA, et al. Identification and characterization of MEDI4736, an antagonistic anti-PD-L1
monoclonal antibody. Cancer Immunol Res 2015;3:1052–62.
3. de Jong MC, Nathan H, Sotiropoulos GC, et al. Intrahepatic cholangiocarcinoma: an international multi-institutional analysis
of prognostic factors and lymph node assessment. J Clin Oncol 2011;29:3140–5.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#胆管癌# #原发性硬化性胆管炎#
10