又一大利好消息!Moderna新冠疫苗三期临床试验有效性高达94.5%
2020-11-16 JACKZHAO MedSci原创
mRNA-1273三期临床试验初步数据有效性达94.5%
本周一,美国疫苗平台公司Moderna宣布,其研发的新冠疫苗mRNA-1273三期试验初步试验数据有效性达94.5%(p <0.0001)这份首次中期分析评估了3万人的COVE研究中的95例确诊的新冠肺炎患者,95例新冠病例包括15名老年人(65岁以上)和20名参与者,这些参与者来自不同的社区(包括12名西班牙裔或拉丁裔,4名黑人或非裔美国人,3名亚裔和1名多种族)。

https://investors.modernatx.com/node/10316/pdf
在安慰剂组中观察到90例Covid-19病例,而在接受两剂疫苗的组中观察到了5例。次要终点分析了COVID-19的严重病例,并在此首次中期分析中纳入了11例严重病例(在研究方案中定义)。所有11例病例均发生在安慰剂组,而在mRNA-1273接种组中均未发生。
中期分析包括DSMB对可用的第3阶段COVE研究安全性数据的同时审查,但没有报告任何重大的安全隐患。Moderna表示,没有“重大”的安全隐患,并补充说该疫苗通常是安全的,并且具有良好的耐受性,参与者的大多数不良反应被标记为轻度或中度。副作用包括注射部位的疼痛,以及第二剂后的疲劳,肌肉疼痛和头痛。
第一次给药后频率大于或等于2%的3级(严重)事件包括注射部位疼痛(2.7%),第二次给药后包括疲劳(9.7%),肌痛(8.9%),关节痛(5.2%),头痛(4.5%),疼痛(4.1%)和注射部位的红斑/发红(2.0%)。这些引起的不良事件通常是短暂的。这些数据可能会根据对第三阶段COVE研究数据的进一步分析和最终分析而变化。
Moderna打算在未来几周内向美国FDA申请紧急使用授权(EUA),并希望该EUA基于对151例病例的最终分析,并且平均随访时间超过2个月。Moderna还计划向全球监管机构提交授权申请。该试验为美国国立过敏与传染病研究所(NIAID)和生物医学合作进行高级研究与发展局(BARDA)应对响应新冠病毒一部分。
Moderna正在与美国CDC,Warp Warp Speed和McKesson合作,这是美国政府签定的COVID-19疫苗分销商,并与全球利益相关方合作,为分销mRNA-1273,如果它获得EUA和类似的全球授权。
在辉瑞公司上周表示,其疫苗的有效性超过90%之后,投资者期望Moderna的疫苗高效。Moderna疫苗和辉瑞疫苗都使用相同的技术来生产疫苗。它基于称为mRNA或信使RNA的分子技术。这是一种使用遗传物质激发免疫反应的疫苗新方法。
Moderna还表示,其疫苗可在华氏36至46度(-4摄氏度)(标准家用或医用冰箱的温度)下稳定长达30天(一般的疫苗储存温度标准都是在零下36华氏度至46华氏度),最多可以存储六个月,这将简化疫苗的分发。相比之下,辉瑞的疫苗的储存温度为零下华氏94度(-70℃)。
该公司称,到今年年底,Moderna预计将准备向美国运送约2000万剂这种疫苗。它表示,它有望在2021年全球制造5亿至10亿剂。
该公司已经在北美,中东和世界其他地区达成了供应协议。它在八月份宣布已经与美国政府达成协议,将提供一亿剂疫苗。该协议使联邦政府可以选择购买多达4亿剂额外剂量。该公司当时表示,美国已经在Moderna的新冠疫苗开发方面投资了9.55亿美元,使其总投资额达到24.8亿美元。
今年八月,Moderna表示,它对某些客户的疫苗收费在每剂32至37美元之间,价格更低。该公司表示,正在讨论价格较低的大批量协议。
这款mRNA-1273新冠mRNA疫苗,它编码Spike(S)蛋白的融合前稳定形式,由Moderna和美国NIAID疫苗研究中心的研究人员共同开发。由流行病预防创新联盟资助的第一批临床试验于2020年2月7日完成,并进行了分析测试。从序列选择开始的42天,它于2月24日被运送到NIH。由NIAID领导的mRNA-1273的1期研究的第一位参与者在3月16日(从序列选择到1期研究给药)的第63天给药。 5月12日,FDA授予了mRNA-1273快速通道标识。 5月29日,每个年龄组的首批参与者:mRNA-1273的2期研究中接受了18-55岁的成年人(n = 300)和55岁及以上的成年人(n = 300)的研究。 2月研究已于7月8日完成注册。
9月29日,《新英格兰医学》发表了由NIH主导的56-70岁和71岁以上年龄组中的mRNA-1273的第一阶段研究的第二次中期分析结果。 7月28日,《新英格兰医学杂志》发表了一项非人类灵长类动物临床前病毒攻击研究的评估mRNA-1273的结果。 7月14日,在《新英格兰医学》上发表了一项由NIH主导的mRNA-1273的1期研究初始队列的中期分析。 mRNA-1273当前未获任何监管机构批准使用。
CNBC
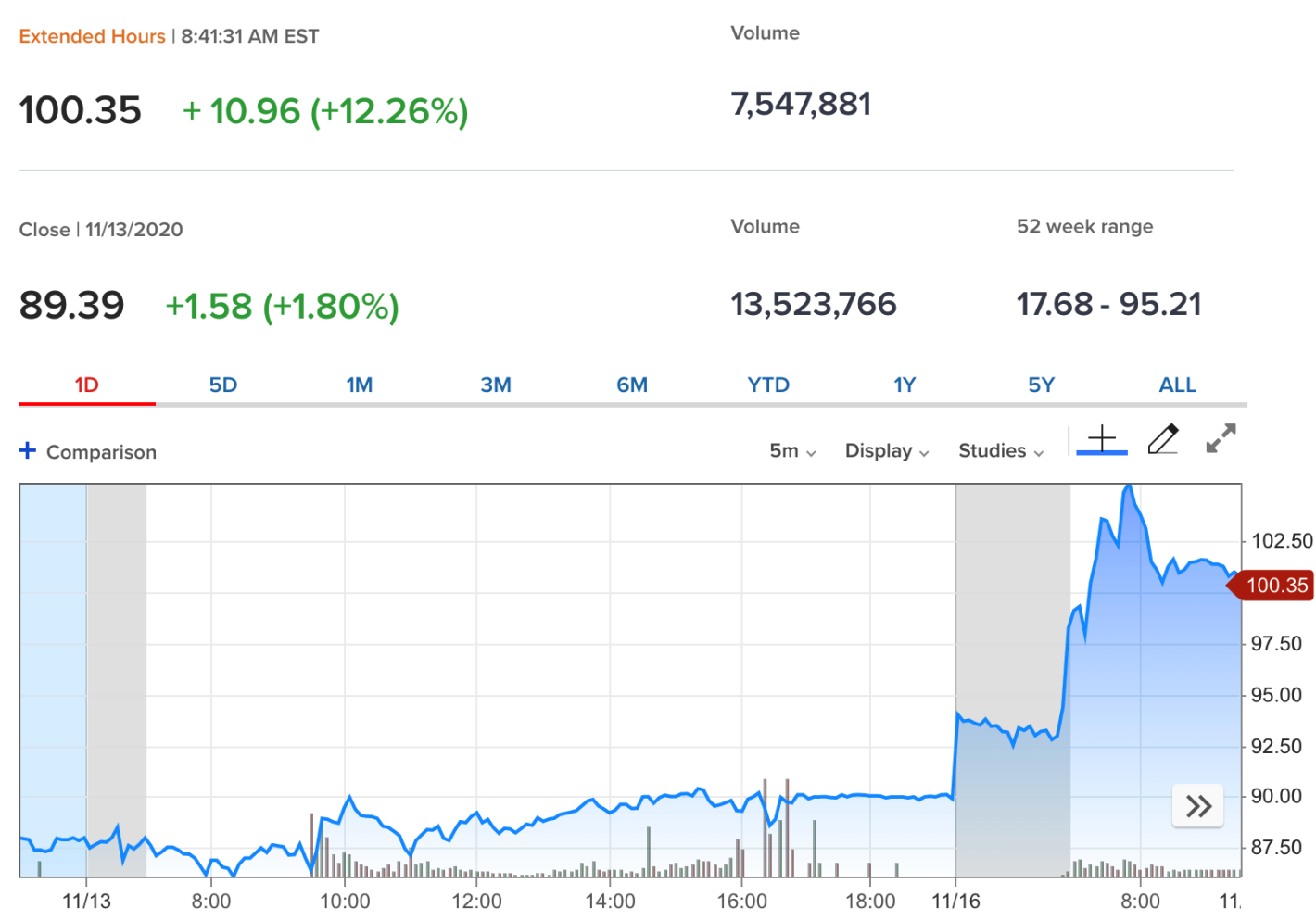
而Moderna新冠疫苗三期临床试验有效性高达94.5%消息一出,该公司的股票在盘前交易中上涨了17%以上。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#三期临床#
49
#三期临床试验#
44
#eRNA#
31
希望更多高效安全疫苗问世!
113
看好Moderna#新冠疫苗#!
195
新冠肺炎,疫情何时才能消失
58
#新冠肺炎#温度存储要优势
129