Adv Sci:段晨阳/李涛/刘良明团队发现急性缺血缺氧状态下Drp1通过细胞骨架引起细胞器互作紊乱的关键机制
2023-11-16 医药加学习班 医药加学习班 发表于上海
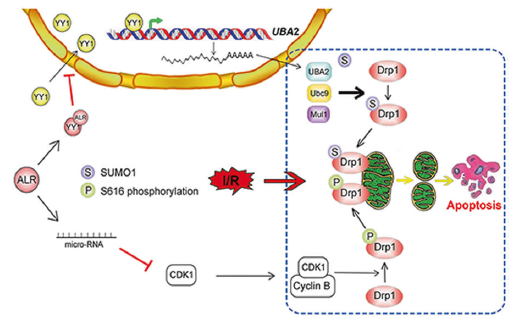
研究团队发现,在急性缺血缺氧损伤情况下,细胞质中的Drp1在被招募到线粒体之前,已经开始发生活性修饰,并参与到线粒体分裂的准备阶段。
急性缺血缺氧损伤是围术期常见危重症的病理过程之一,而线粒体作为细胞有氧呼吸的主要场所,也是缺血缺氧后较早发生损害的细胞器。我们前期系列研究表明,围术期危重症后多器官线粒体质量平衡被明显打破,主要表现为线粒体过度分裂和线粒体融合不足,其中动力蛋白Drp1介导线粒体质量失衡是危重症多器官损害发生发展的共同通路。以往研究认为,只有在内质网和线粒体互作(即ER-Mito接触)引起线粒体收缩后才会招募Drp1到线粒体上参与线粒体分裂过程。然而我们观察发现,即使在病理状态下Drp1发生转位并介导线粒体过度分裂,仍然有大量Drp1存在于细胞质中,其中的生物学意义一直未得到阐明。
2023年11月1日,重庆医科大学附属第二医院的段晨阳教授团队和陆军特色医学中心的李涛、刘良明教授团队在Advanced Science 上发表了题为“Activated Drp1 Initiates the Formation of Endoplasmic Reticulum-Mitochondrial Contacts via Shrm4-Mediated Actin Bundling”的最新研究论著,揭示了以往认为不具备功能的细胞质Drp1同样具有调控功能。研究团队发现,在急性缺血缺氧损伤情况下,细胞质中的Drp1在被招募到线粒体之前,已经开始发生活性修饰,并参与到线粒体分裂的准备阶段。

首先,研究团队通过长时程录像观察记录了Drp1活性修饰、Drp1转位、ER-Mito接触形成、线粒体分裂等多个细胞生物学过程在缺血缺氧病理状态下的时相变化规律。在细胞和整体水平均发现,缺血缺氧病理情况下细胞质Drp1活性修饰与ER-Mito接触形成的发生要早于大量Drp1转位到线粒体与线粒体过度分裂的发生(图1-3)。
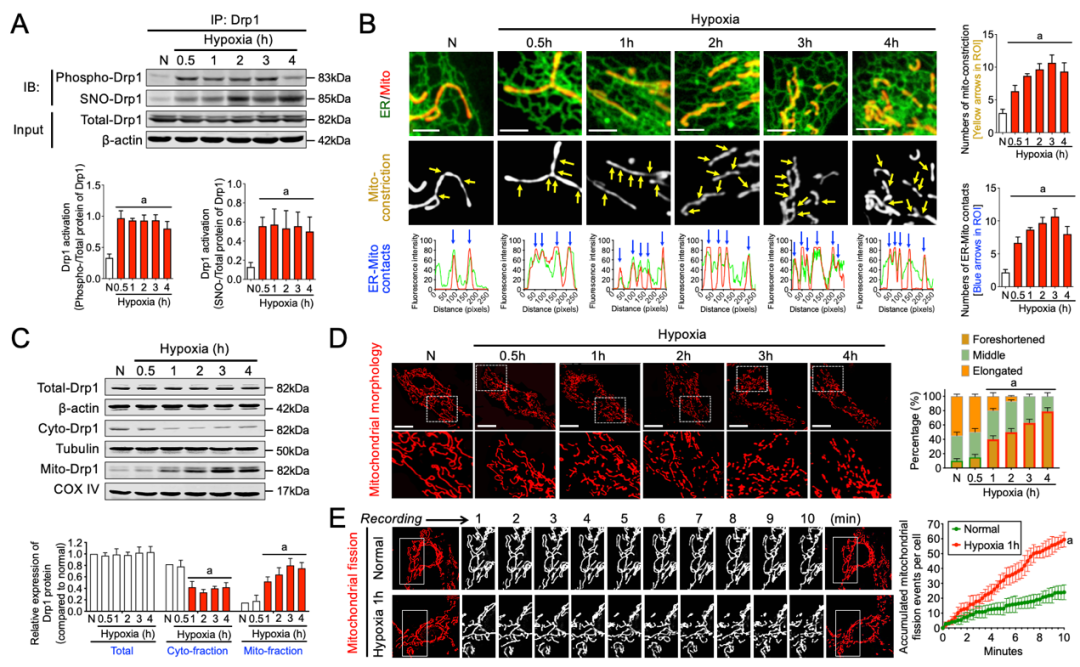
图1. Drp1活性修饰、Drp1转位、ER-Mito接触形成、线粒体分裂等细胞生物学过程在细胞缺氧条件下的时相变化规律
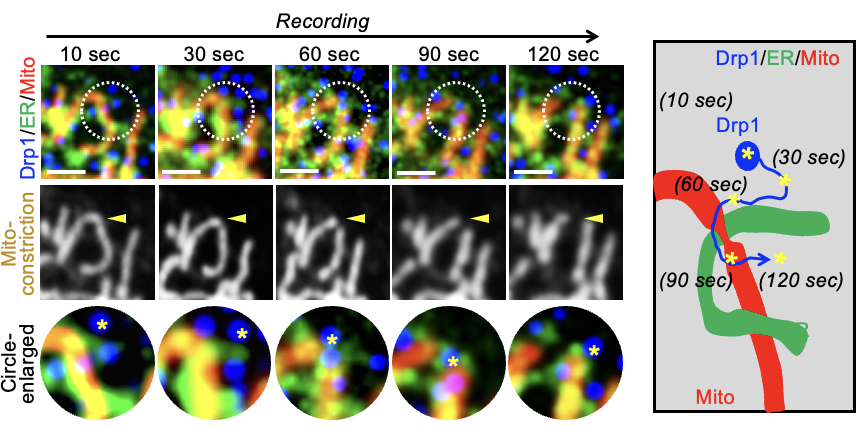
图2. 荧光多标活细胞录像Drp1单分子轨迹追踪

图3. Drp1活性修饰、Drp1转位、ER-Mito接触形成、线粒体分裂等细胞生物学过程在动物缺血休克条件下的时相变化规律
为了排除是由于平面观察视野偶然性所造成的假阳性结果,作者对细胞质Drp1活化情况下内质网和线粒体互作情况进行了电镜三维重构(图4),进一步证实了病理情况下细胞质Drp1活化与ER-Mito接触形成的同步性。而缺血缺氧情况下干扰Drp1后, ER-Mito接触形成情况明显减少,内质网与线粒体的互作方式由锚定模式转变为一种相对滑性运动(图5)。
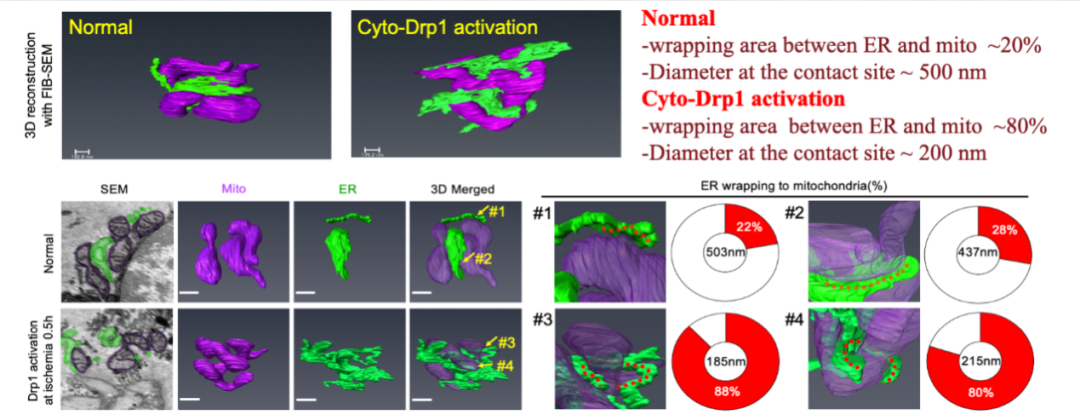
图4. 细胞质Drp1活化情况下内质网和线粒体互作情况的电镜三维重构结果

图5. 缺氧情况下干扰Drp1后高频录像观察内质网与线粒体的互作关系
研究团队进一步使用Drp1敲除动物疾病模型进行测序分析发现缺血缺氧后细胞质Drp1启动ER-Mito接触可能与骨架调节蛋白Shrm4诱导细胞骨架重构有关。缺血缺氧后细胞质Drp1会与Shrm4形成复合体促使肌动蛋白丝束化,通过干扰Drp1或者Shrm4破坏复合体形成后,肌动蛋白束化情况明显减少(图6)
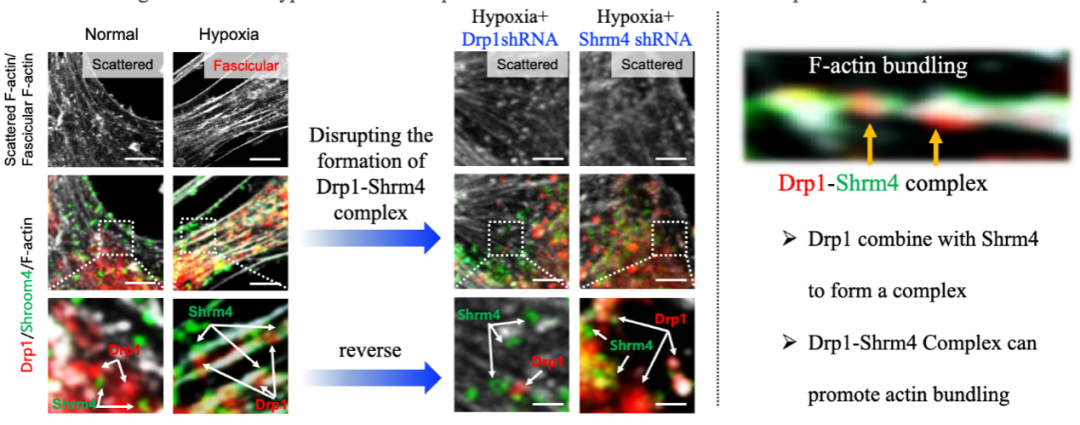
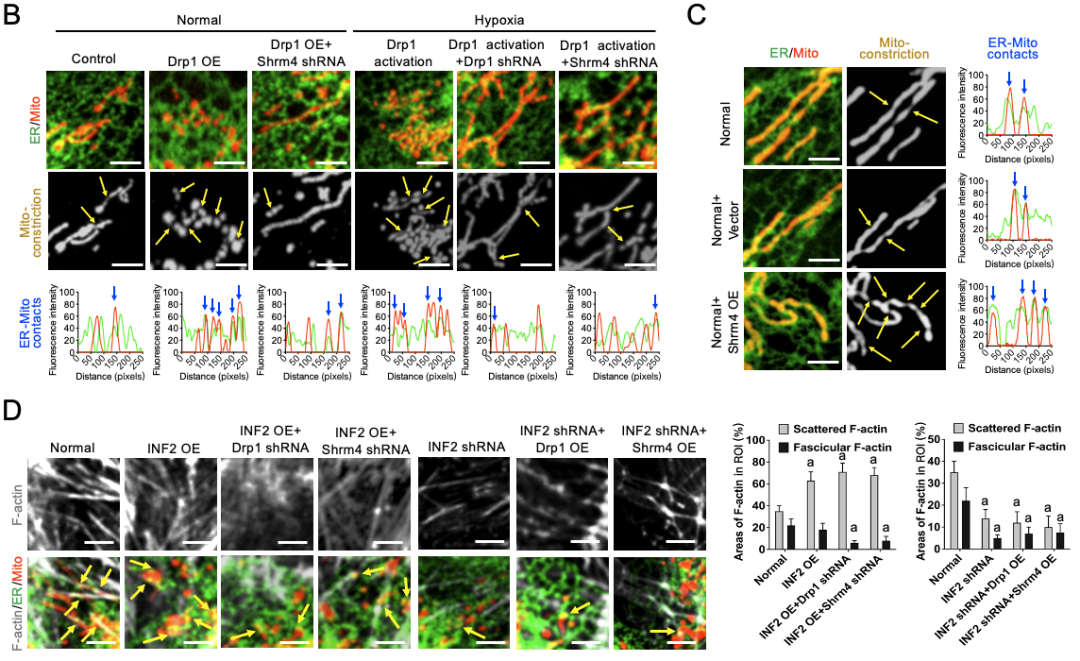
图6.破坏Drp1-Shrm4复合体形成对肌动蛋白束化和ER-Mito接触形成的影响
以往研究显示,定位于内质网上的INF2蛋白同样在ER-Mito接触形成过程中发挥了重要作用,作者为了探究Drp1-Shrm4通路与传统认知的INF2通路在介导ER-Mito接触中的关系,通过过表达INF2处理,束化肌动蛋白没有明显增加,证实INF2无法诱导束化过程。而缺氧后干扰INF2后,束化肌动蛋白明显减少,即使进一步促进Drp1-Shrm4复合体形成,束化肌动蛋白数量依然无明显增加。说明在缺失INF2介导肌动蛋白丝情况下,Drp1-Shrm4复合物是无法完成肌动蛋白成束的(图7)。

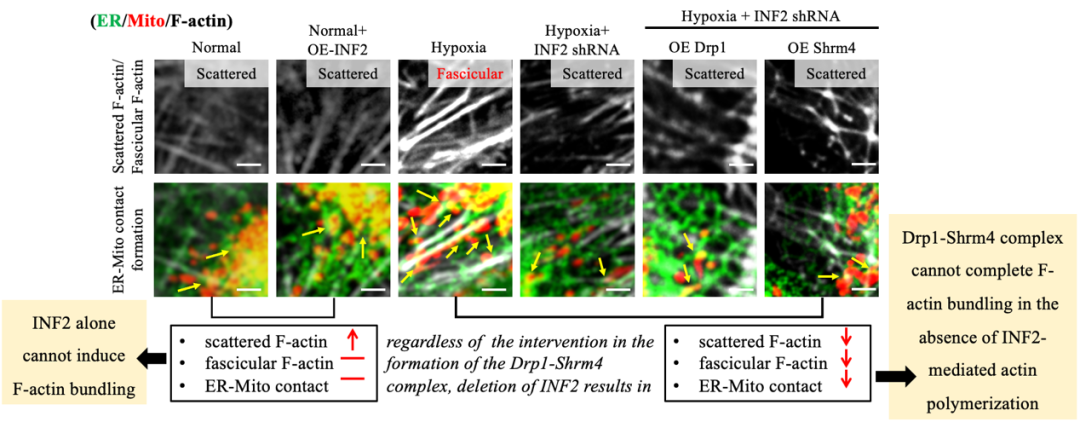
图7.干预INF2对肌动蛋白束化和ER-Mito接触形成的影响
总之,该研究发现:INF2将内质网和线粒体间G-actin积聚成F-actin肌动蛋白丝,是ER-Mito接触形成的结构基础。而缺血缺氧等病理状态下细胞质活化Drp1通过结合Shrm4引起肌动蛋白丝成束,是增强内质网与线粒体互作牵引力、引起大量ER-Mito接触和线粒体收缩的启动机制(图8)。
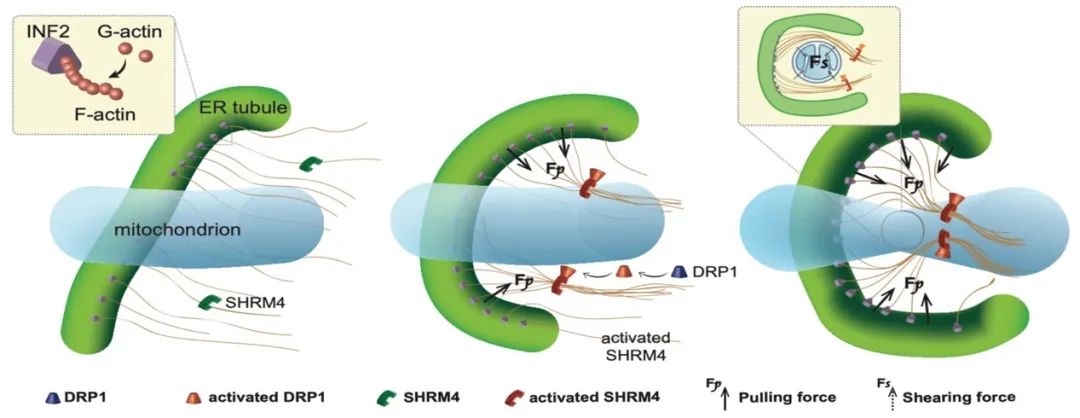
图8. 机制示意图
重庆医科大学附属第二医院麻醉科段晨阳副教授为本文独立第一作者兼共同通讯作者,陆军军医大学陆军特色医学中心李涛研究员、刘良明研究员为本文的通讯作者。本课题受到国家自然科学基金、重庆市中青年医学高端人才项目的资助和支持。
原文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202304885
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言