STTT:魏于全/杨阳/陆方团队开发双AAV载体先导编辑,治疗遗传性失明
2023-02-11 生物世界 生物世界 发表于上海
该研究通过优化基于断裂蛋白质内含子(split intein)和双AAV载体的先导编辑器,对Rep65基因无义突变的先天性黑蒙症小鼠模型进行了有效且精确的基因治疗,并实现了相当程度的视力恢复和维持。
遗传性视网膜疾病(IRD)是全球范围内致盲的主要原因,其特征是光感受器和/或视网膜色素上皮(RPE)变性,这是一组与超过250个基因突变相关的异质性疾病。这组疾病的遗传模式各不相同,尽管在过去的十年中,这些疾病的治疗方法取得了一些突破性进展,例如,REP65基因突变相关的先天性黑朦症(LCA)的AAV基因治疗已获得FDA批准上市,还有一些隐性遗传的IRD疾病获批开展了临床试验也得到了批准,但绝大多数IRD疾病仍然无药可医。
基于CRISPR的基因编辑技术快速发展,为治疗广泛的基因突变导致的疾病成为可能。先导编辑(Prime Editor,PE)是刘如谦(David Liu)团队开发的一种新型精准基因编辑工具,可以在不依赖DNA双链断裂或外源供体DNA模板的情况下进行精确的基因组编辑。先导编辑可以编辑几乎任何改变的基因组,包括所有的12种单碱基之间的自由转换、多碱基的精准插入和删除,以及它们之间的组合。刘如谦团队进一步开发的双先导编辑(Twin Prime Editing,TwinPE)还能够实现可编程的大片段DNA的删除、替换、整合和倒位。
这为治疗包括遗传性视网膜疾病(IRD)在内的广泛突变谱的复杂人类遗传疾病提供了有效工具。
近日,四川大学华西医院魏于全院士、杨阳研究员、陆方教授等在 Signal Transduction and Targeted Therapy 期刊发表了题为:Dual-AAV split prime editor corrects the mutation and phenotype in mice with inherited retinal degeneration 的研究论文。
该研究以断裂蛋白质内含子(split intein)和双AAV载体为基础,对先导编辑(PE)进行优化,并对先天性黑蒙症小鼠模型进行治疗,精确且高效(最高编辑效率达16%)修复了小鼠视网膜细胞的致病基因突变,恢复了RPE65蛋白的表达,挽救了视网膜和视觉功能,且没有检测到脱靶编辑。这项研究为通过先导编辑治疗遗传性视网膜疾病(IRD)奠定了基础。

为了提高先导编辑(PE)的基因编辑效率,一些研究团队在先导编辑器本身上做了很多努力。然而,杨阳团队认为,通过优化先导编辑的递送途径来提高体内基因编辑效率,是另一种选择。同时,先导编辑在体内安全高效的给药是其临床应用前需要解决的一个重大问题。
腺相关病毒(AAV)由于其良好的安全性,成为目前最常用的体内基因治疗递送载体。然而,AAV载体的缺点也很明显,它的载体容量有限(仅4.7kb),这对于6.3kb的先导编辑系统来说显然不够。
为了解决先导编辑在体内递送的问题,研究团队使用了一种断裂-再连接策略,将先导编辑器分为N端和C端两部分,分别使用一个AAV载体递送,然后再通过反式剪接重新组装成完整的先导编辑器。
断裂蛋白质内含子(split intein)在蛋白质内含子中部区域特定位点发生断裂,形成N端片段和C端片段,断裂蛋白质内含子的N端片段和C端片段通过非共价键相互识别,重建催化活性中心,介导蛋白质反式剪接。在这项研究中,研究团队通过体外筛选断裂蛋白质内含子(split intein)和断裂位点,以提高split-PE系统的编辑效率,还研究了pegRNA和切口sgRNA取向对优化的split-PE系统的编辑效率的影响。
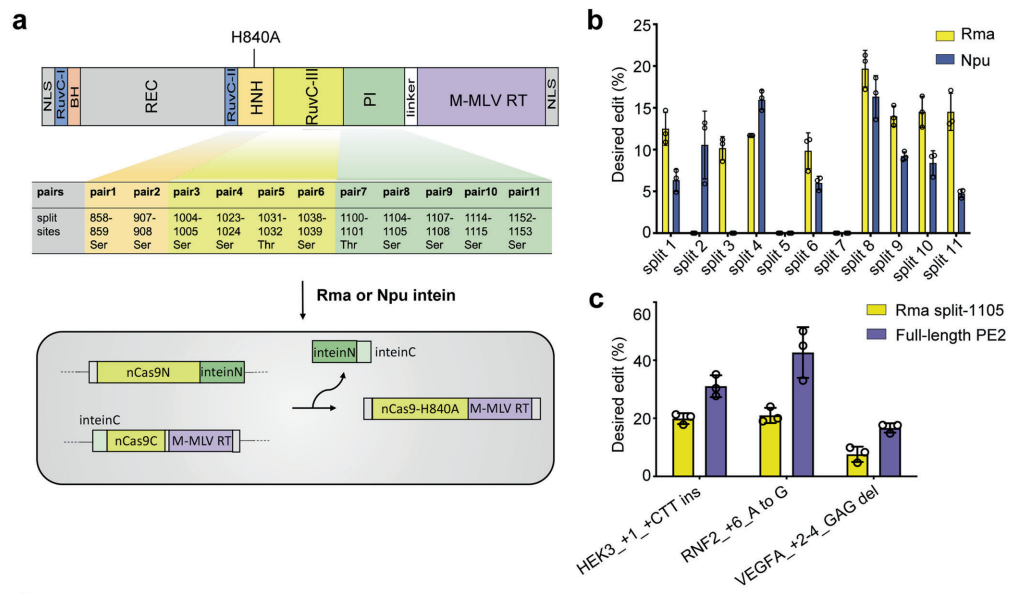
为了测试体内编辑效率,研究团队将优化的split-PE系统整合到双AAV载体中,然后对Rep65基因无义突变(单碱基突变导致终止密码子提前,蛋白质翻译提前终止)的先天性黑蒙症小鼠模型进行治疗。
结果显示,双AAV载体提送的split-PE系统的视网膜递送,能够精确修复小鼠模型的致病基因突变,在高剂量治疗组(每只眼睛注射1×10E10 GC AAV8)的基因编辑效率高达16%,成功恢复了RPE65蛋白的表达,更重要的是,高剂量治疗组挽救了小鼠的视网膜和视觉功能,并且能够其光感受器过快退化,此外,没有检测到脱靶编辑。
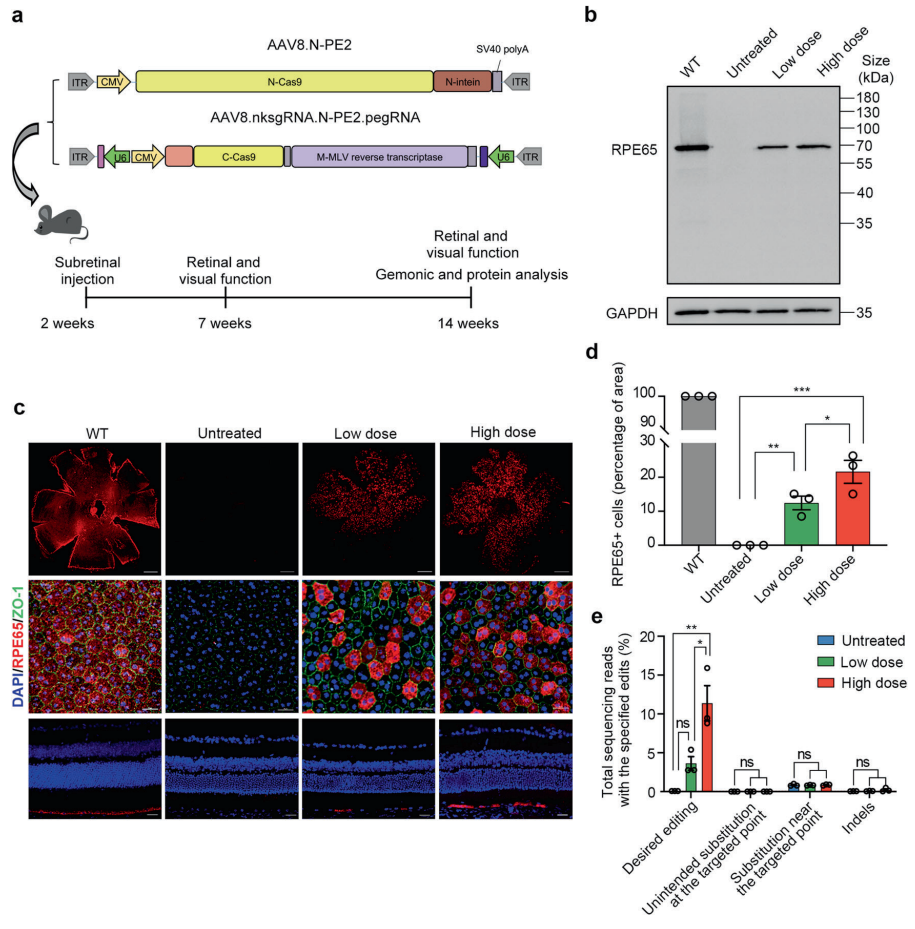
总的来说,该研究通过优化基于断裂蛋白质内含子(split intein)和双AAV载体的先导编辑器,对Rep65基因无义突变的先天性黑蒙症小鼠模型进行了有效且精确的基因治疗,并实现了相当程度的视力恢复和维持。这表明了先导编辑在纠正导致遗传性视网膜疾病(IRD)的基因突变和恢复视觉功能方面具有临床应用潜力。这也为研究为针对不同突变引起的其他遗传性视网膜疾病(IRD)的先导编辑疗法的临床前开发提供了思路。
论文链接:
https://www.nature.com/articles/s41392-022-01234-1
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









