Neuron:TREM2 独立介导小胶质细胞增生促进Tau介导的神经变性
2023-05-12 brainnew神内神外 网络 发表于上海
相关结果说明了在APOE4存在的情况下,Tau病理依赖性的小胶质细胞增生;即TREM2非依赖性的小胶质细胞增多,在ApoE4存在的情况下促进了Tau介导的神经退行性变。
导读:神经炎症在阿尔茨海默病 (AD) 中起着重要作用,同时小胶质细胞是参与神经炎症的重要免疫细胞。相关研究发现APOE4 加剧了 P301S Tau 小鼠的 Tau 相关神经变性和炎症,去除小胶质细胞可阻断Tau依赖性神经变性。TREM2作为能够调节小胶质细胞功能的上一个重要靶点,那么TREM2 KO 是否会阻断表达 APOE4 (TE4) 的 P301S Tau 小鼠的神经退行性变呢?
近期,《Neuron》期刊发表了题为“TREM2-independent microgliosis promotes tau-mediated neurodegeneration in the presence of APOE4”的论文,作者团队发现尽管依赖TREM2的小胶质细胞减少,但是TE4-T2KO与TE4小鼠的神经退行性变和tau病理加重。相关结果说明了在APOE4存在的情况下,Tau病理依赖性的小胶质细胞增生;即TREM2非依赖性的小胶质细胞增多,在ApoE4存在的情况下促进了Tau介导的神经退行性变。

为了研究TREM2和ApoE4在肌萎缩侧索硬化症、炎症和神经变性中的相互作用,作者团队使用了P301S-tau小鼠模型。该模型到9.5个月龄时,在海马区和内嗅/梨状皮质(EC/PC)出现明显的tau过度磷酸化和聚集、胶质增生、突触和神经元丢失。作者团队在人类载脂蛋白E4-KI(TE4)或载脂蛋白E-KO(TEKO)的条件下,建立了敲除或不敲除TREM2的P301S小鼠模型,产生了4组小鼠:TE4,TEKO,TE4-T2KO和TEKO-T2KO。
在这一模型中,这四个组小鼠在发生神经变性之前,即在3个月龄时没有检测到脑体积的变化(图S1B)。但在9.5月龄时,与表达ApoE4的小鼠相比,ApoE-KO显著减轻了小鼠的脑萎缩(图1A-1D),与先前的报道类似。此前作者团队发现9.5月龄表达小鼠APOE且缺失TREM2的P301S小鼠发生EC/PC萎缩的程度显著低于表达TREM2的P301S小鼠,体积分析显示,与TEKO和TEKO-T2KO小鼠相比,TE4-T2KO小鼠的海马体体积显著减少(27%),EC/PC体积减少(35%)(图1A-1C)。有趣的是,与TE4小鼠相比,TE4-T2KO小鼠的海马体和EC/PC体积甚至更小。此外,TE4鼠齿状回颗粒细胞层明显比TEKO鼠薄,且与TREM2缺失无关(图1D)。接下来,作者团队测量了血浆神经丝轻链(NFL)的蛋白水平,而NFL是神经轴突损伤和神经变性的标志。作者团队观察到TE4鼠与不依赖TREM2的TEKO鼠相比,血浆NFL显著增加(图1E)。在没有Tau突变的根据年龄匹配的同窝出生的仔畜中,几乎检测不到NFL水平(图S1C)。TE4组和TE4-T2KO组之间的NFL水平没有差异,可能是因为其水平已经达到了平台期。在神经退行性变之前的3个月龄时,这些组的NFL水平也没有差异(图S1C)。作者团队通过量化海马突触后(PSD95)点来衡量TREM2对TE4小鼠突触丢失的影响。作者团队观察到与TEKO小鼠相比,TE4鼠的PSD95点减少,与TREM2的存在无关(图1F和1G)。因此,在ApoE4存在的情况下,TREM2缺失会增加Tau介导的脑萎缩。
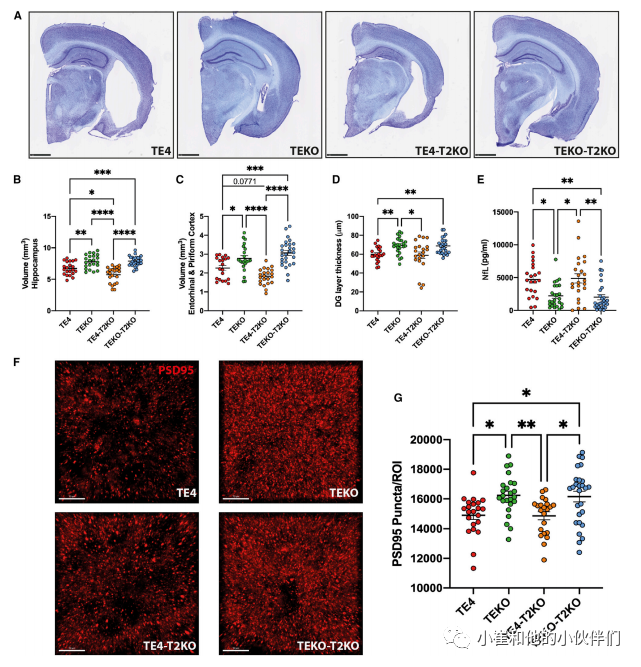
图1. TREM2缺失增加了ApoE4对海马萎缩的影响,但并没有抵消ApoE4对9月龄TE4小鼠tau蛋白介导的突触丢失的有害影响
为了确定载脂蛋白E4对脑萎缩和突触丢失的TREM2非依赖性作用是否与Tau病理增加有关,作者团队使用AT8(pS202/pT205)和AT180(PT231)对这些小鼠的脑切片进行p-Tau免疫染色,并使用MC1对病理Tau构象进行免疫染色。作者团队观察到,与其他组相比,TE4-T2KO组大鼠海马区AT8(图2A和2D)和AT180(图2B和2E)的染色显著增加,而TE4-T2KO组与TEKO和TEKO-T2KO组(图2C和2F)相比,海马区MC1染色增强。TE4-T2KO与TEKO和TEKO-T2KO相比(图2B、2C、2H和2I),在EC/PC中AT8染色无显著差异(图2A和2G),但在 EC/PC中AT180和MC1染色增加(图2B、2C、2H和2I)。令人惊讶的是,尽管在EC/PC中,TE4小鼠与Teko和Teko-T2KO相比,其MC1染色有所增加(图2C和2I),但在TE4小鼠的海马区/内嗅皮层,p-tau染色与Teko或Teko-T2KO组没有差异,这与作者团队以前的发现不同。作者团队对RIPA和Sarkosyl不溶性组分中的AT8和AT180 p-Tau标记进行了蛋白质印迹分析(图2J-2Q),并对可溶性和不溶性磷酸化和总Tau水平进行了ELISA法分析(图2R-2U)。
在RIPA、p-tau和总Tau的可溶组分方面,两组之间没有差异。然而,与TEKO和/或TEKO-T2KO小鼠相比,TE4-T2KO(图2O-2Q和2T)和TE4小鼠(图2O、2T和2U)的不溶性ptau和总tau水平增加,证实了TE4中聚集的p-Tau和Tau的增加,这不会因TREM2缺失而减弱。最后,作者团队分析了与进展性病理Tau/神经退行性变阶段相关的海马区p-Tau染色模式(图2V;类型1-4)。TEKO小鼠高度富含1型和2型模式。相比之下,TE4小鼠主要有3型和4型模式,这与更晚期的tau分期和神经变性有关(图2V)。值得注意的是,TREM2在Teko小鼠中的缺失强烈地阻止了病理tau阶段的进展,导致这些小鼠几乎完全是1型和2型模式。虽然更为微妙,但TE4-T2KO小鼠与TE4小鼠相比,存在从3型模式到4型模式的转换。这种p-tau模式分析证实了ApoE4增强了p-tau病理,并强调了TREM2在Tau病理中的复杂作用。有趣的是,作者团队没有在表达缺乏TREM2的小鼠ApoE的P301S小鼠中观察到p-Tau病理增加,这表明人ApoE4对Tau病理的影响不同于先前研究中使用的小鼠ApoE。

图2. TREM2缺失并不减少9个月龄TE4小鼠的tau病理
小胶质细胞的反应性在驱动Tau病理和Tau介导的神经变性方面起着至关重要的作用,ApoE4加剧了这一过程,并依赖于TREM2。为了破译与神经退化相关的特定小胶质细胞状态,作者团队使用免疫标记PU.1从E4,TE4和Teko的海马区分离了小胶质细胞核(图3A),并进行了SnRNA-Seq(图3B和S3;表S1)。在对差异表达的标记基因进行分析后,作者团队确定了10个簇。大多数细胞核不同程度地表达CX3CR1、CSF1R和Hexb mRNA(图3D)。这些标记在三个簇中高度表达,它们的基因表达基本上是相同的,并且通常类似于转录切割状态,俗称为“内稳态”(图3E)。动态平衡的小胶质细胞在PU.1+核中所占比例最大,达到占70%。根据差异表达的标记基因(图3C、3E和S4),其他较小的簇被鉴定为血管周围/边缘相关的巨噬细胞、炎症、MHCII或增殖(图3C、3E和S4),并且在不同组之间确实存在显著差异。稳态小胶质细胞的比例在E4和E4-T2KO小鼠中最高,其次是缺乏ApoE的小鼠,而稳态小胶质细胞在TE4和TE4-T2KO中显著减少(图3G;表S2)。在TE4和TE4-T2KO小鼠中,一个主要表达干扰素反应基因的小胶质细胞簇(图3H和3I)显著增加。
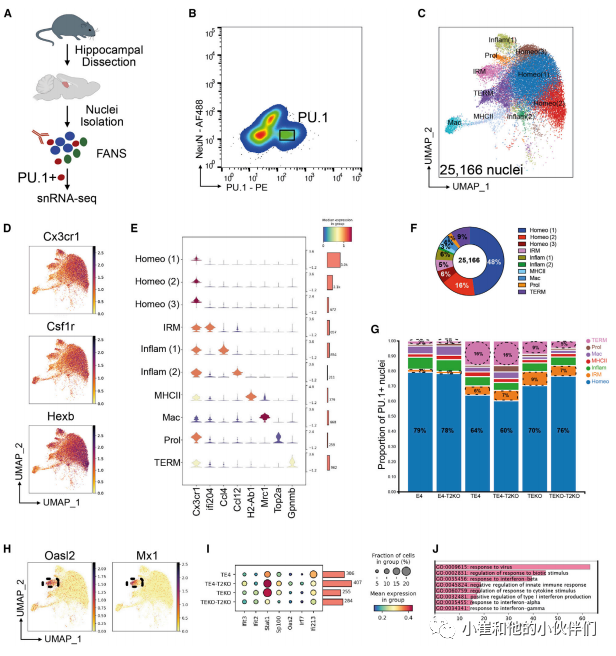
图3.小胶质细胞的snRNA-seq揭示了pu1+核中受TREM2去除、ApoE4和tau病理调控的变化
当其中一个簇与淀粉样蛋白小鼠中疾病相关小胶质细胞样的小胶质细胞相似,但有一些不同,并在TE4和TE4-T2KO组中丰富。为了便于讨论,作者团队将这个簇标记为Tau/ApoE4反应性小胶质细胞(TERM)(图4A;表S3),表明这些小胶质细胞对突变的tau病理做出反应,同时ApoE4的反应性增加,这与作者团队之前在TE4小鼠中观察到的情况一致。TREM簇显示LPL和Spp1上调,而稳态标记物,如P2ry12和SALL1下调(图4B)。在440个上调的基因中,有与溶酶体功能相关的基因(如CTSB、CD63、CD68和CSTD)(图4C和4D)。其他GO术语包括细胞迁移和细胞黏附、GTP酶活性、自噬、内体运输以及细胞因子产生和神经细胞死亡的调节。早前作者团队发现SnRNA-seq簇的比例可能无法反映对基因表达的中间效应;因此,作者团队评估了与先前报道的转录图谱相关的基因的表达。作者团队首先比较了动态平衡标记物(图4E和4F)的表达,所有这些标记物在TE4中都比其他组减少了。与此观察一致的是,作者团队观察到TE4中P2RY12的染色显著减少,但这种染色减少在TE4-T2KO小鼠中明显减弱(图4G和4H)。因此,在存在严重的tau病理和神经退变的情况下,TREM2缺陷保留了动态平衡相关的小胶质细胞基因的表达。
淀粉样蛋白小鼠疾病相关小胶质细胞中的基因亚群被发现依赖于TREM2和其他独立的基因。因此,作者团队基于先前描述的对TREM2的依赖来评估基因的表达水平(表S4)。TE4和TE4TKO小鼠与Teko和Teko-T2KO相比,均表现出CTSB、CTSD、Fth1和Lyz2的表达增加(图4I),这表明TREM2独立的小胶质细胞对tau病理和神经变性的反应。相反,作者团队检测到SPP1、LPL、CD9、Lilrb4、CSF1 Ccl6和Itgax在TE4-T2KO和TEKO-T2KO中的表达降低(图4J),类似于先前报道的依赖TREM2的疾病相关小胶质细胞基因在淀粉样蛋白中的表达。作者团队还检测到TE4-T2KO与TEKOT2KO相比,TEKOT2KO中疾病相关小胶质细胞相关的Clec7a免疫染色显著减少(图4K和4L)。有趣的是,与TE4-T2KO相比,TEKO-T2KO对Clec7a的下调作用更强,这表明尽管没有TREM2,但在tau病理存在的情况下,ApoE4的存在可以增加Clec7a+小胶质细胞。重要的是,与Teko小鼠相比,TE4小鼠表达更高水平的反应性小胶质细胞标记物Spp1、LPL、CTSB、Ctsd和Lyz2mRNA(图4I和4J)。作者团队的SnRNA-Seq数据表明,在P301S小鼠中,反应性小胶质细胞表型具有一些疾病相关小胶质细胞的特征,而在人ApoE4的存在下,这种表型会增加。虽然TREM2缺乏增加了海马萎缩,并且没有改变tau病理,但作者团队仍然观察到,在淀粉样蛋白和tau病理模型中,几个先前被描述为依赖TREM2的基因表达减少。
然而,在TE4-T2KO中,TREM2非依赖的反应性小胶质细胞基因表达增加,这表明在ApoE4存在的情况下,TREM2非依赖的小胶质细胞增生促进了Tau介导的神经变性。有趣的是,一些不依赖于TREM2的小胶质细胞基因(CTSD和CTSB)在TE4-T2KO小鼠中的表达高于TE4小鼠(图4I)。CTSD和CTSB编码组织蛋白D和B,这是一种溶酶体蛋白,在蛋白质降解和免疫反应中发挥作用。Reifschneider等人最近证明,在原颗粒蛋白缺乏的模型中,TREM2的缺失可以挽救小胶质细胞的过度激活,但不能拯救溶酶体缺陷和神经毒性,这导致作者团队假设TE4-T2KO小鼠表现出溶酶体表型的改变。
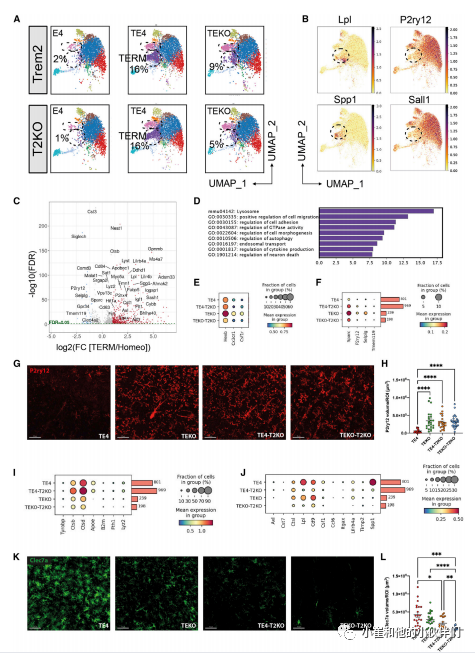
图4.TREM2缺失的9个月龄TE4和TEKO小鼠的小胶质细胞反应谱
除了CTSD和CTSB,作者团队还评估了溶酶体标记在疾病相关小胶质细胞样的簇中的表达。与Teko小鼠(图5A和5B)相比,TE4和TE4-T2KO均表达更高水平的Grn、CD68、Lamp2、Timp2、Galc和Lipa,这表明ApoE4表达的tau病理小鼠的溶酶体负荷更高。一些溶酶体基因在TE4-T2KO小鼠中表现出比TE4小鼠更高的表达,这与TE4-T2KO中溶酶体的变化一致。作者团队通过CD68染色扩展了这些观察,发现与包括TE4在内的其他组相比,TE4T2KO组小鼠每个小胶质细胞的CD68+吞噬酶体量增加(图5C和5D)。此外,作者团队还发现,与TEKO小鼠相比,TE4和TE4-T2KO小鼠每个细胞的小胶质细胞LAMP1体积增加(图5G和5H)。与TEKO小鼠相比,GFAP+的TE4和TE4T2KO小鼠的每个细胞的LAMP1体积也增加(图5G和5I),这表明TE4和TE4T2KO小鼠溶酶体体积的增加延伸到星形胶质细胞。
接下来,作者团队测试了TREM2和ApoE4对应激条件下髓系细胞体外溶酶体形态的影响(图S2)。将E4、E4-T2KO、EKO或EKO-T2KO小鼠的骨髓来源的巨噬细胞(BMDM)在含CSF1的L细胞条件培养液(L929)中孵育6h,浓度范围从最佳到缺乏(10%~0.5%)。当培养在含有10%L929的培养液中时,BMDM显示相似的LAMP1+囊泡面积/细胞,其与ApoE4或TREM2的存在无关。然而,在L929介质缺乏时,在E4-T2KO和EKO-T2KO中,LAMP1+囊泡面积显著增加,这表明在应激条件下,是TREM2缺失而不是ApoE4缺失,可以扩大髓系细胞中溶酶体的体积,就像在TE4-T2KO小鼠中观察到的那样。为了进一步表征有或没有TREM2的TE4小鼠小胶质细胞中溶酶体的表型,作者团队测量了小胶质细胞中受损溶酶体的标记物Galectin-3,32-34(图6A和6B)。作者团队观察到,与TEKO小鼠相比,TE4小鼠的小胶质细胞Galectin-3增加,与TREM2的存在无关(图6B),这表明TREM2独立和ApoE4介导的溶酶体损伤。作者团队还使用LipidTox染色评估了CD68+小胶质细胞吞噬酶体内的中性脂质在小胶质细胞溶酶体中的积聚(图6C和6D)。溶酶体在脂质代谢和维持细胞内脂平衡中起主要作用,溶酶体脂代谢缺陷会损害必要的溶酶体功能,如溶酶体脂储存疾病所见的一样。有趣的是,最近的一份报告表明,ApoE4介导的小胶质细胞脂质积累损害了小胶质细胞对神经元网络活动的监控。作者团队观察到与TEKO小鼠相比,TE4小胶质细胞CD68+囊泡中的脂质积累增加,这与TREM2的存在无关(图6C和6D),表明TREM2非依赖性和ApoE4介导的溶酶体脂积累潜在地加剧了溶酶体损伤。
为了进一步研究溶酶体脂质堆积是否依赖于ApoE4,作者团队评估了表达小鼠APOE的P301S小鼠的溶酶体LipidTox染色。虽然不是作者团队小鼠簇中同窝出生的鼠仔,但这些小鼠表现出相同的人类tau突变,并且与其他被分析的小鼠的年龄和性别进行匹配。有趣的是,作者团队观察到,与TE4小鼠相比,表达小鼠APOE的P301S小鼠的小胶质细胞溶酶体脂质堆积减少。在表达小鼠APOE的P301S小鼠中,脂质积累与在Teko和Teko-T2KO小鼠中发现的相似(图S7),这表明ApoE4促进了P301S小鼠中溶酶体脂的异常积累。考虑到先前描述的依赖于小胶质细胞的TREM2基因的子集在TE4-T2KO中仍然升高,作者团队接下来评估这些基因是否在溶酶体功能中断后通过激活CLEAR(协调的溶酶体表达和调节)网络而上调。TFEB调节溶酶体的功能并通过与属于CLEAR网络的基因的启动子的E-box结合来调节基因的表达。
作者团队首先评估了上调的基因(n=157;与TE4相比,TE4-T2KO小胶质细胞的PADJ<0.05)。GO分析显示,从TE4-T2KO小鼠的海马区分离的小胶质细胞中,与溶酶体相关的术语丰富。接下来,作者团队评估了小胶质细胞TE4-T2KO中上调的基因与CLEAR网络的重叠。作者团队使用交互式TFEBexplorer来识别及预测TFEB上调的基因。在TFEB中的157个差异表达的上调基因中,其中78个(49.7%)被TFEB上调(图6E;表S5),支持CLEAR网络的参与和增加溶酶体的负担。为了更好地理解TE4-T2KO小鼠脑萎缩加剧的机制,作者团队还评估了这些小鼠是否表现出补体成分或NLRP3途径的变化,这两者都是先前显示在体内驱动Tau病理和影响Tau介导的通路。

图5.尽管TREM2缺失,但TE4小鼠的溶酶体负担和
小胶质细胞的突触吞噬均增加

图6.尽管TREM2缺失,TE4小鼠的溶酶体损伤和异常溶酶体脂质积累
为了研究带有或不带有TREM2的TE4小鼠的小胶质细胞特征是否与人类AD相关,作者团队分析了来自AD捐赠者顶叶皮质的小胶质细胞SnRNA-seq,这些小胶质细胞至少有一个APOE4副本和TREM2共同变体(CV),或者AD相关的p.R47H或p.R62H变体(E4-T2car)(图7A)。Micro.0和Micro.1簇之间的小胶质基因特征比较证实,与 Micro.1 相比,Micro.0 中的稳态基因特征明显更高,而 Micro.1 对反应性小胶质细胞表现出统计学上更强的基因特征评分(图 7B 和 7C)。然后作者团队专门比较了Micro.1反应簇中E4-T2CV和E4-T2car大脑之间的基因表达,类似于作者团队之前在TE4小鼠中的分析(图7D和7E)。令人惊讶的是,与E4-T2car相比,患有E4-T2CV的AD大脑的动态平衡基因特征更高,静息小胶质细胞基因CX3CR1和P2RY12的表达增加。然而,其他动态平衡基因如HEXB和TMEM119在E4-T2car脑中的表达较高,这表明在T2CV和T2car存在的情况下,动态平衡基因的表达与APOE4存在复杂的调节。尽管如此,E4-T2car 并未完全概括稳态特征,因为特征得分中位数 <0,与 Micro.1 的反应状态一致。接下来,作者团队根据疾病相关小胶质细胞的转录谱评估了基因子集的表达水平(图 7D 和 7E),类似于作者团队在 TE4 小鼠中的分析(图 4I 和 4J)。作者团队检测到 E4-T2car 中 AXL、CD9、SPP1、LPL、CD9、LILRB4 和 ITGAX 的表达较低(图 7D 和 7E),类似于在 TE4-T2KO 中观察到的情况。根据作者团队在 TE4 与 TE4-T2KO 中的观察,E4T2CV 和 E4-T2car 大脑之间的 TREM2 独立的疾病相关小胶质细胞样转录组学状态相似(图 7D 和 7E)。最后,作者团队评估了 AD 大脑小胶质细胞中溶酶体相关基因的表达。尽管 AD-E4-T2car 中的基因特征评分略低,但 E4-T2car 中的几个溶酶体相关基因表达水平较高,例如 DMXL2、GALC、GNS、LGMN、SCARB2 和 TIMP2(图 7D 和 7E) ,类似于 TE4-T2KO 中的溶酶体改变。作者团队还分析了 ROSMAP 人类前额叶皮层 snRNA-seq 数据的一个子集,代表两个 TREM2 类别中的 APOE4 供体,并证实与 AD-E4-T2CV 相比,AD-E4-T2car 中的 TREM2 独立基因特征评分更高(图 S6)。AD-E4-T2car 和 AD-E4-T2CV 组之间的稳态基因特征和 TREM2 依赖性基因特征的评分没有统计学显着变化(图 S6D),但在多次检验校正后更强,但没有统计学意义(标称 p = 1.9e2;adj. p > 0.05),AD-E4-T2car 中存在溶酶体相关基因特征评分。这些人类数据支持 TE4 小鼠的发现,表明尽管 TREM2 部分功能丧失,但在 ApoE4 和 tau 病理学存在的情况下,存在持续的 TREM2 独立性小胶质细胞增生和溶酶体活性。
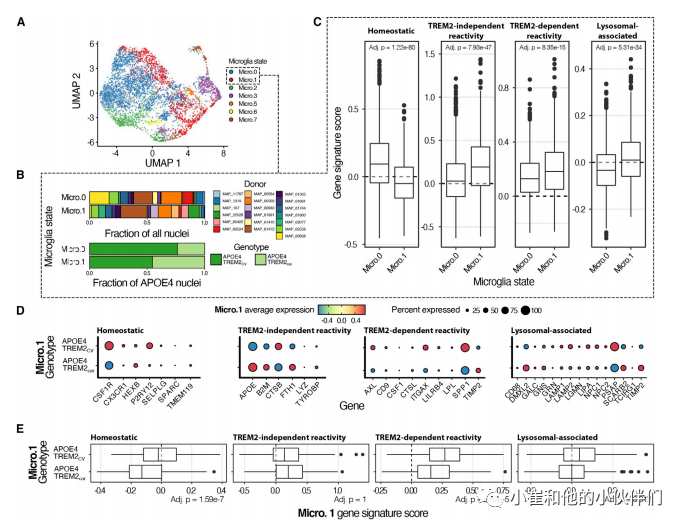 图7.AD-E4患者的人类SnRNA-seq在TREM2变异携带者(p.R47H和p.R62H)与TREM2常见变异携带者(TE4小鼠)中显示出类似的小胶质细胞特征
图7.AD-E4患者的人类SnRNA-seq在TREM2变异携带者(p.R47H和p.R62H)与TREM2常见变异携带者(TE4小鼠)中显示出类似的小胶质细胞特征
作者团队以前描述过,在具有小鼠 Apoe 的 P301S 小鼠中,TREM2 功能丧失降低了突触吞噬作用。作者团队评估了小胶质细胞CD68+吞噬溶酶体中 PSD-95 斑点的数量,观察到TE4-T2KO 中CD68+吞噬溶酶体体积增加。并发现与 TEKO 相比,TE4 小鼠的 HC 中每个小胶质细胞的CD68+囊泡中的 PSD-95 斑点显著增加,且与 TREM2 的存在无关(图 5C-5F),与 TE4 和 TE4-T2KO 中突触密度降低一致。因此,在 ApoE4 存在的情况下,小胶质细胞吞噬 Tau 损伤的突触不需要 TREM2。
早前作者团队描述了 TREM2 缺失或功能丧失减少了表达小鼠 Apoe 的 P301S 小鼠的星形胶质细胞增生,同时减少了神经变性。因此作者团队评估了星形胶质细胞增生是否在 TE4-T2KO 小鼠中受到影响,并观察到与 TE4 小鼠、TEKO 和 TEKO-T2KO 小鼠的比较,TE4-T2KO 小鼠的HC 中 GFAP 覆盖的体积增加(图 S8A 和 S8B)。此外,由于之前描述的星形胶质细胞 ApoE4 对 Tau介导的突触丢失和神经变性的功能,故而作者团队还评估了神经胶质细胞中的 ApoE 水平。
有趣的是,与 TE4 小鼠相比,在 TE4-T2KO 中观察到每个 GFAP+ 细胞和每个 Iba1+ 细胞的 ApoE 免疫反应水平增加(图 8D 和 8E)。与 TE4 小鼠相比,作者团队没有观察到 TE4-T2KO 小胶质细胞中更高的 ApoE RNA 水平(图 4I),这可能表明 ApoE4 降解存在缺陷而不是产量增加。接下来,作者团队通过评估小鼠小胶质细胞和星形胶质细胞中与 LAMP1 共定位的 ApoE 来测量 ApoE4 本身是否在 TE4-T2KO 的溶酶体中积累(图 8F–8H)。有趣的是,在 TE4 小鼠的 LAMP1 囊泡中发现小胶质细胞中只有一半的 ApoE 免疫染色,与 Trem2 状态无关。关于星形胶质细胞,与 TE4 小鼠相比,TE4-T2KO 小鼠中较少的 ApoE 与 LAMP1 共定位(图 8G)。这可能是因为较少的 ApoE4 到达 TE4T2KO 小鼠的 LAMP1+ 囊泡,导致该隔室外有更多的 ApoE。

图8. TREM2缺失增加了TE4小鼠的GFAP+星形胶质细胞和ApoE水平
作者团队发现在表达 ApoE4 的小鼠中,不依赖于TREM2 的小胶质细胞反应性驱动 tau 蛋白病诱导的脑萎缩和突触丢失。尽管 TREM2 缺失降低了疾病相关小胶质细胞样基因子集的表达,但溶酶体相关基因在小胶质细胞和星形胶质细胞中仍然升高,同时突触和吞噬作用较高,这至少可以部分解释神经保护作用的缺失。进一步了解在 AD 和原发性 Tau 疾病中驱动神经变性的特定小胶质细胞特征,并对于开发针对 TREM2 和小胶质细胞的新型治疗策略至关重要。
原文:
Gratuze M, Schlachetzki JCM, D'Oliveira Albanus R, Jain N, Novotny B, Brase L, Rodriguez L, Mansel C, Kipnis M, O'Brien S, Pasillas MP, Lee C, Manis M, Colonna M, Harari O, Glass CK, Ulrich JD, Holtzman DM. TREM2-independent microgliosis promotes tau-mediated neurodegeneration in the presence of ApoE4. Neuron. 2023 Jan 18;111(2):202-219.e7.

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言