2024 FDA指南:REMS逻辑模型:将程序设计与评估联系起来的框架
美国食品和药物管理局(FDA)宣布推出一份名为“REMS逻辑模型:将程序设计与评估联系起来的框架”的行业指南草案。该指南描述了FDA的风险评估和缓解策略(REMS)逻辑模型。
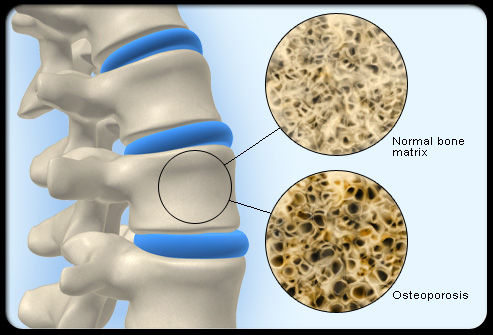
无源植入类医疗器械上市后安全性评价专家共识
结合我国医疗器械不良事件监测现状,将无源植入类医疗器械的上市后安全性评价分为工作体系和技术指导原则,为开展无源植入类医疗器械上市后安全性评价提供参考依据,促进上市后的医疗器械安全性评价工作规范化。
【解读分享】2024 FDA指南:统一血液和血液成分容器标签标准的认可和使用
根据美国法律法规,认可2024年1月2024年1月发布的题为“使用ISBT 128统一标记血液和血液成分的美国行业共识标准”4.0.0版。本指南取代2014年6月的同名指南。