药物和生物制剂,不包括疫苗上市后个别病例安全性报告的提交【英文版】
本技术规范文件旨在协助相关方向食品药品监督管理局(FDA或管理局)药品评价及研究中心(CDER)和生物评价及研究中心(CBER)电子提交个别病例安全性报告(ICSR)(和ICSR附件)。
药物和生物制剂,不包括疫苗上市后个别病例安全性报告的提交【中文版】
本技术规范文件旨在协助相关方向食品药品监督管理局(FDA或管理局)药品评价及研究中心(CDER)和生物评价及研究中心(CBER)电子提交个别病例安全性报告(ICSR)(和ICSR附件)。
复发性唇疱疹:治疗和预防药物的研发【中文版】
本指南草案聚焦来自于抗病毒产品部门(DAVP)制药发起人、学术团体和公众的持久的辩论2。本指南不包括治疗系统性、生殖器的或播散性疱疹病毒感染,或免疫抑制群体的唇疱疹。
复方首乌地黄丸说明书修订要求
根据药品不良反应评估结果,为进一步保障公众用药安全,国家药品监督管理局决定对复方首乌地黄丸说明书中的警示语及【不良反应】、【禁忌】和【注意事项】项进行统一修订。
《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)(征求意见稿)》起草说明
本文为《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)(征求意见稿)》起草说明。
已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)(征求意见稿)
本文为《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)(征求意见稿)》。
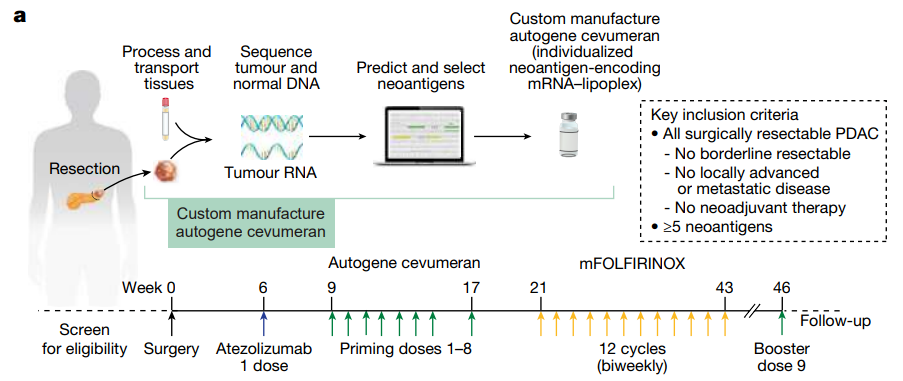
mRNA肿瘤疫苗联合PD-1治疗最新数据公布,复发或死亡风险降低49%!
与Keytruda单药治疗相比,mRNA-4157(V940)联合Keytruda持续显示出临床意义上的无复发生存期(RFS)和无远处转移生存期(DMFS)改善,将复发或死亡风险降低49%、远处转移或