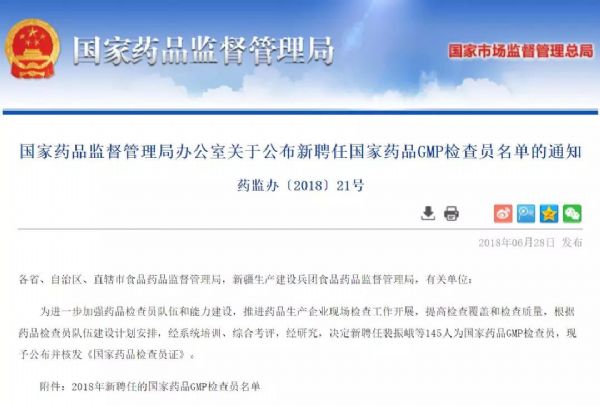
热议:大胆预测几年之后的制药行业
随着仿制药一致性评价如火如荼的进行,第二轮带量采购的开始、上市许可持有人、原辅包关联审评审批、建立专业的检查员队伍等政策的逐步落实,制药行业的天开始要变了。
蒲公英 - 药企,上市许可持有人制度,飞检,带量采购 - 2019-09-15
加快境外上市新药审评审批获积极进展
党中央、国务院高度重视药品医疗器械审评审批制度改革工作,加快境外上市新药的审评审批是其中重要一环。今年4月、6月,李克强总理先后主持召开国务院常务会议,就加快进口新药上市作出系列重要部署。6月22日,在国务院新闻办召开的国务院政策例行吹风会上(以下简称吹风会),国家药品监督管理局局长焦红介绍,加快境外上市新药审评审批工作取得积极进展,简化境外上市新药审批政策效果初步显现。4月12日至今,有7个防治
中国医药报 - 境外上市新药,审评审批 - 2018-06-25
国家食药监管总局划定2017年6项药品监管重点工作!
日前,全国药品监管工作会议在京召开。会议认真贯彻落实全国食品药品监督管理工作和表彰先进会议暨党风廉政建设工作会议精神,全面总结2016年药品监管工作情况,部署了2017年重点工作。国家食品药品监督管理总局副局长吴浈出席会议并讲话。会议指出,一年来,全国药品监管战线扎实推进药品监管工作,取得了显著成效。坚持问题导向,严厉整治突出问题,部署开展药品流通、生产领域违法经营行为专项整治,使生产经营秩序进一
中国医药报 - 国家药品监督管理局,监管 - 2017-02-20
国家药监局:让群众尽早用上境外上市新药
审批速度明显提高国家药监局药品化妆品注册管理司司长王立丰介绍,目前在我国获批的境外上市药品共3800余个,其中化学药品3400余个、生物制品300余个、中药70余个,基本涵盖了抗癌、抗病毒、抗高血压等主要治疗领域。从审批数量看,近5年平均每年批准进口药品临床试验336件,每年递增7%。平均每年批准进口药品上市56件,每年递增16%;从临床审批和上市审批的总时限看,我国新药审批法定时限与发达国家接
新华网 - 药监局,境外,新药 - 2018-06-23
这些方面将严管,医疗器械行业新规要来了
近日,第四届中国药品监管科学大会(2019)分论坛之一——医疗器械监管论坛在北京会议中心举办,来自监管部门、药企、协会等近200名代表参加。
中国医药报 - 医疗器械行业,新规 - 2019-10-28
国家药监局部署工作重点 要烧审批制度改革这把火
4月17日,国家药品监督管理局召开干部大会,深入贯彻落实党中央、国务院决策部署,动员部署机构改革工作,研究谋划药品监管事业改革发展思路和举措。国家药品监督管理局党组书记、副局长李利发表讲话,国家药品监督管理局局长焦红主持。李利指出,深化党和国家机构改革,是以习近平同志为核心的党中央作出的重大决策,是新时代推进国家治理体系和治理能力现代化的一项重大部署。广大干部职工要充分认识这次机构改革的重要性、必
国家药监局 - 审批制度 - 2018-04-18
试行跨区域监管,“长三角医疗器械注册人制度”又迈出一步
沪苏浙皖药品监督管理局对医疗器械注册人和受托生产企业,可开展监督检查、监督抽检、投诉举报
澎湃新闻 - 区域监管,医疗器械,注册人 - 2020-03-11
9家中国药企收到FDA禁令!
导读 如今,国内药企不仅面临各级药监部门飞行检查、数据核查的压力,在国际市场同样如此。 越来越多的中国药企在美国申报仿制药。但是,进入美国医药市场绝非易事。近年来,FDA更是大幅度增加了对中国药企的检查员人数和次数,“重拳”频频出现。今年才过去4个月份,在FDA官网上发布66-40项下的针对中国公司的进口禁令(因GMP检查不符合而不经过实物检查直接在海关扣留)已到9
蒲公英 - 中国药企,仿制药,FDA - 2016-05-06
食药监总局:临床试验中弄虚作假、捏造数据将被严处
谈及改革临床试验管理,国家食品药品监督管理总局医疗器械注册司司长王者雄今日表示,将会同国家卫生计生委联合出台临床试验机构的备案条件和备案管理办法,建立医疗器械临床试验机构和临床试验项目备案管理信息系统,加强监督检查
中新网 - 食药监总局,临床试验,弄虚作假 - 2017-10-09
《药品检查办法》征求意见稿出炉!
为进一步规范药品检查行为,保证检查质量,1月5日,食品药品监管总局办公厅发布了《药品检查办法(征求意见稿)》,向社会公开征求意见。
CFDA - 药品检查办法,意见稿 - 2018-01-06
药物临床试验的不良事件管理--DIA中国年会AE上报的挑战及最佳实践分会场专家讨论荟萃
新药临床试验是为药物有效性和安全性提供客观的循证医学证据,药物的安全性, 风险收益比更是药监部门评审新药临床试验的关注点。自2015年我国国家药品监督管理局开展新药注册申请相关的GCP 核查工作以来,安全性事件的报告,尤其是不良事件的漏报是核查中发生频次最高的不合格项目1。为什么会存在频发的不良事件漏报,这样的漏报对药物安全性的评估会造成什么样的影响,有什么解决之道? 本界DIA年会0406分会场
DIA - DIA中国年会,药物临床试验,不良事件管理 - 2018-06-08
FDA将启动试点计划确保药品供应链安全
两年的试点计划将会帮助美国食品药品管理局(FDA)更进一步评价向美国出口药物的日益增多的公司和国家。安全供应链试点计划允许大约100家技术先进并符合试点计划的公司或原料药生产商的产品加快进入美国,以帮助FDA根除掺假的、商标不确切的或未经批准的药物。FDA首次产生试点计划的想法要追溯到2009年,并于2012年对该计划进行了修订,以便更好地满足潜在申请企业的需要。制药公司可以在9月15日至12月3
dxy - FDA,药品供应链 - 2013-08-23
为您找到相关结果约500个