陈峰等学者呼吁新冠肺炎临床试验应规范和谨慎
截至2020年2月22日上午10:00,在中国临床试验注册中心(http://www. chictr.org.cn/)注册的以COVID-19为题目或疾病名称的各类研究已经多达200项。其中,治疗性临床试验139项,诊断性研究9项,观察性研究44项,其他类型研究8项。对此,陈峰等公共卫生专家学者共同在《中华流行病学杂志》上呼吁,临床试验应科学、规范和谨慎,尽量避免对临床救治产生干扰,否则就是对患者
中华流行病学杂志 - 新冠肺炎,临床试验 - 2020-02-25
多家媒体曝光之后:临床试验招募工作会走上正轨吗?
“5天五千块”、“试药人受控中介”、“灰色产业链”、“数据造假”等等内容,让近年来本就不够太平的临床试验再起涟漪。不过,不同于以往,本次事件被曝光的重点不再是“临床试验”造假行为,而是另一环节~受试者招募。当然,所有相关新闻报道均来源于网络,其真实性和可靠性还需考究,不过,临床试验受试者在招募过程中的种种“造假”、“违规”行为,却是圈内人士知而不言的陈年诟病。
生物谷 - 临床试验招募,正轨 - 2016-12-22
中国新冠病毒灭活疫苗获批进入临床试验
新华社记者14日从国务院联防联控机制科研攻关组获悉,我国两款新冠病毒灭活疫苗获得国家药品监督管理局一二期合并的临床试验许可,相关临床试验同步启动。这是首批获得临床研究批件的新冠病毒灭活疫苗。
新华网 - 新冠疫苗,新冠疫苗试验 - 2020-04-14
丙型肝炎直接抗病毒药物临床试验评价专家建议
目前国内已有越来越多的临床医师和医疗单位在不同程度上参与DAA的药物临床试验工作,但国内尚无相关指南或规范,为使这方面的工作更规范、更符合国内新药评价的要求并与国际接轨,“重大疾病新药临床评价研究综合技术平台建设”课题组就丙型肝炎DAA的新药临床试验的相关问题进行了广泛讨论,并参考国内外相关文献,形成了《
中华肝脏病杂志 - 肝炎病毒,丙型,直接抗病毒药物 - 2016-05-11
4种H7N9流感病毒疫苗获准临床试验
北京市研制的H7N9流感病毒裂解疫苗、H7N9流感病毒裂解疫苗(佐剂)、H7N9流感全病毒灭活疫苗、H7N9流感病毒裂解疫苗(30μg/剂)等4种H7N9流感防控药品,近日已经取得国家食品药品监督管理总局药物临床试验批件,获准进入临床试验阶段。
科技日报 - H7N9,疫苗 - 2017-02-17
瑞德西韦治疗新冠肺炎的临床试验在武汉启动!
在科技部、国家卫健委、国家药监局等多部门支持下,抗病毒药物瑞德西韦(remdesivir)已完成临床试验的注册审批工作,第一批病例入组工作也已就位。2月5日,瑞德西韦临床试验项目负责人、中日友好医院副院长曹彬教授讲解项目内容(新华社记者 程敏 摄)瑞德西韦临床试验项目负责人、中日友好医院副院长曹彬教授介绍,瑞德西韦是美国吉利德公司的在研药物,在
新华社 - 瑞德西韦,新冠肺炎 - 2020-02-07
南方会临床试验论坛:科研已经进入循证医学2.0时代
在4月12日第17届南方会、由国家心血管病中心医学统计部(MRBC-NCCD)发起的“临床试验方法学论坛”上,李卫教授说。临床试验方法学论坛部分专家合影 李卫教授指出,符合统计学原则的研究设计是临床试验成功的基础,而科学合理的试验设计和评价是保证高质
中国循环杂志 - 科研,循证医学 - 2015-04-15
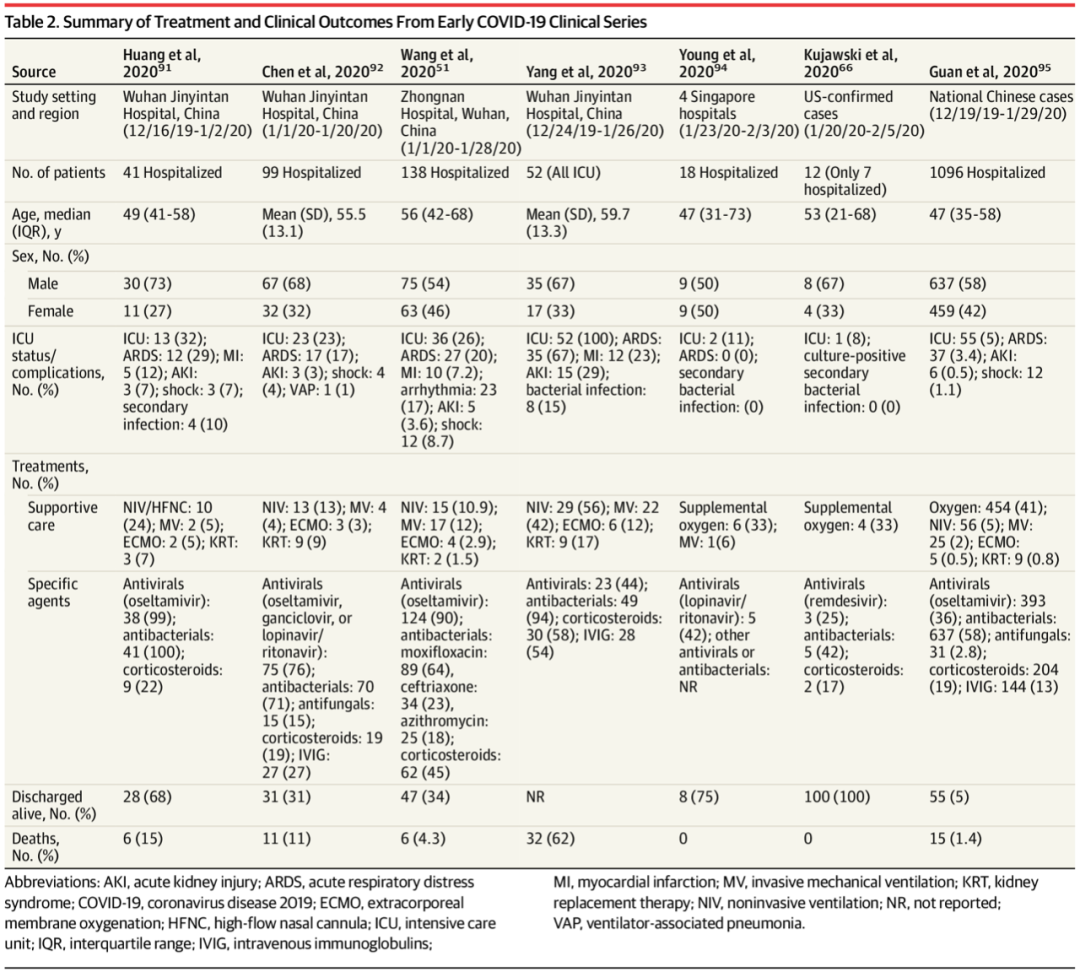
JAMA超详细综述:盘点COVID-19治疗药物及临床试验进展
美国约翰斯·霍普金斯大学实时统计数据显示,截至北京时间2020年4月21日10时,全球COVID-19的确诊病例已达到247万多例。
医咖会 - 药物,Covid-19 - 2020-04-22
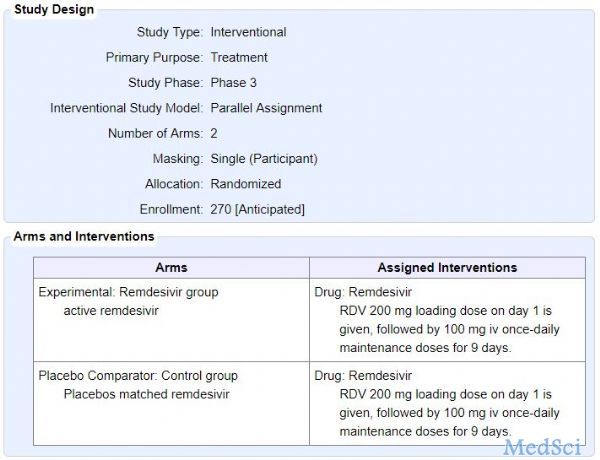
深度解析:瑞德西韦用于新冠肺炎的临床试验详情
研究试验的名称:A Phase 3 Randomized, Double-blind, Placebo-controlled Multicenter Study to Eva
MedSci - 瑞德西韦 - 2020-02-06
癌症治疗性疫苗及相关生物制品临床试验基本规范(上)
一、前言 本文摘译自2007年1月份刊出的英文综述A Clinical Development Paradigm For Cancer Vaccines and Related Biologics(J Immunother. volume 30,number 1, January 2007)。本篇内容节译自该文的起草背景和摘要部分。 2004年12月至2005年12月期间,
审评五部生物制品室 - 疫苗,生物制品 - 2018-07-13
癌症治疗性疫苗及相关生物制品临床试验基本规范(下)
一、临床试验终点治疗性癌症疫苗的任何临床研究必须考虑疫苗的独特性和参与试验的人群。对细胞毒性药物所设定的有效性测评传统指标仅适用于对应的药物,如果应用于癌症疫苗的有效性评价则需要进行修订。1、患者的筛选用于支持上市许可的任何临床研究,所研究的人群必须支持试验品的适用性。癌症治疗性疫苗的临床研究中,依据PPTs试验所制定的纳入标准应可能使试验人群从治疗中获益。在扩展试验人群时,可以考虑采用生物标
审评五部生物制品室 - 2018-07-13
关于公开征求《国际多中心临床试验指南(试行)》意见的函
各省、自治区、直辖市食品药品监督管理局,各有关单位: 为进一步加强对国际多中心临床试验的指导,保障国际多中心临床试验数据用于注册申报的规范性和质量,保障受试者的权益与安全,我司组织起草了《国际多中心临床试验指南请各省、自治区、直辖市食品药品监督管理局认真组织辖区内相关监管部门、药品研制企业、药物临床试验机构及相关单位研究讨论,于2014年12月1
CFDA - 多中心临床试验指南 - 2014-11-24
为您找到相关结果约500个