FDA批准强生降糖药INVOKAMET用于2型糖尿病一线治疗
FDA已批准扩大糖尿病复方药INVOKAMET(canagliflozin/盐酸二甲双胍)的适应症,纳入2型糖尿病成人患者的一线治疗。此次批准,使INVOKAMET可处方用于尚未接受canagliflozin或二甲双胍的2型糖尿病患者,以及可能从这种双效降糖疗法中受益的2型糖尿病患者。在III期临床中,一线治疗2型糖尿病成人患者时
生物谷 - 降糖药 - 2016-05-26
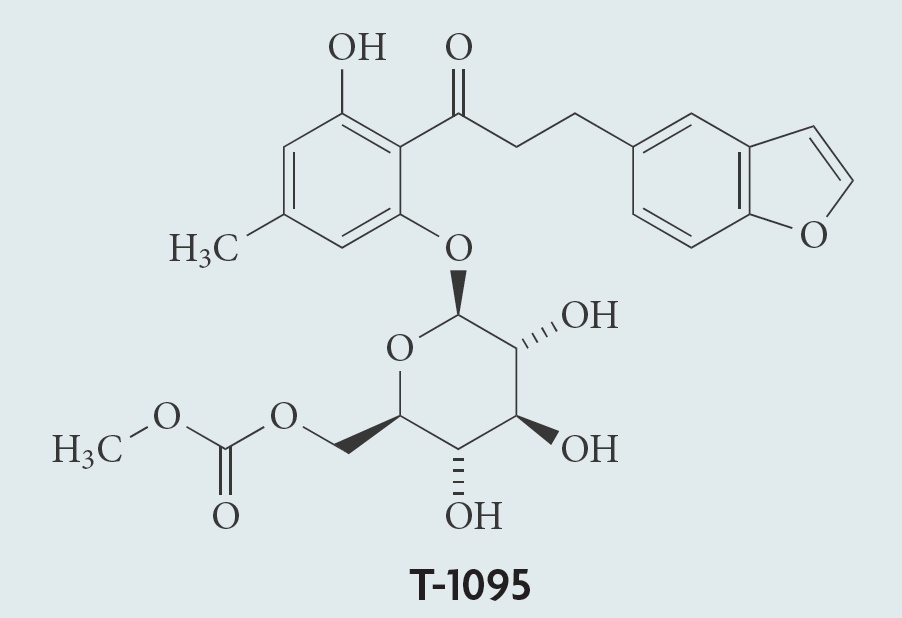
由根皮苷到坎格列净:来源于植物的神奇降糖新药
列净类降糖药物,在糖尿病治疗中大放异彩,是首个明确具有心肾保护的降糖药物。然而,大部分都不知道它的前身——来源于植物有效成份根皮苷。
网络 - 坎格列净,根皮苷 - 2019-09-13
白血病新药Mylotarg终获美FDA认可
辉瑞(Pfizer)公司宣布,其新药Mylotarg(gemtuzumab ozogamicin)得到了美国FDA的批准,用于治疗表达CD33抗原的新诊断急性骨髓性白血病(AML)的成人患者。FDA同时也批准该药物用于治疗2岁及以上的CD33阳性AML患者,这些患者经历复发或对初始治疗没有响应。
健康时报网 - 白血病,Mylotarg,FDA - 2017-09-03
强生就Erdafitinib向美国FDA提交了新药申请
强生制药公司9月19日宣布,该公司已向美国食品和药物管理局(FDA)提交了新药申请(NDA),以寻求批准erdafitinib治疗局部晚期或转移性尿路上皮癌(UC)患者和成纤维细胞生长因子受体(FGFRErdafitinib是一种研究性,每日一次的口服型泛FGFR抑制剂,已于2018年3月获得FDA的突破性疗法认定。
MedSci原创 - Erdafitinib,新药申请,尿路上皮癌 - 2018-09-19
BMJ:FDA新药上市后后续研究情况及特点
研究认为,上市药物的后续研究的重视程度偏低,其描述简单,试验设计特征信息公开不充分,约75%的后续研究进行可注册,约75%的注册研究完成或公布了研究结论
MedSci原创 - FDA,新药,后续研究 - 2018-06-04
特朗普操刀改革FDA,新药审批继续提速
美国候任总统特朗普的行政管理部门已经启动了一个以.gov为后缀的网站,并在该网站上更新了部分特朗普即将推行的医疗和生物制药新政策。首先,网站条文显示,特朗普行政管理部门将同国会一道废除奥巴马医改法案(平价医疗法案,ACA),取而代之的是健康储蓄帐户等一系列解决方案,将调整医疗保险的这个历史性角色还给国家。在废除ACA的层面上,虽然参议员Mitch McConnell和众议院院长Paul Ryan都
MedSci原创 - 新药,审批,FDA,特朗普 - 2016-11-19
FDA依然深陷“停摆期”,新药审评工作暂停
由于民主和共和两党在总统特朗普要求的美墨边境建隔离墙经费问题上分歧严重,美国国会未能就临时拨款法案达成一致,2018年12月22日凌晨起,部分联邦政府机构开始“停摆”,约80万联邦政府雇员被迫无薪工作或被政府强制休假。
医谷综合报道 - FDA,业务暂停,停摆期 - 2019-01-14
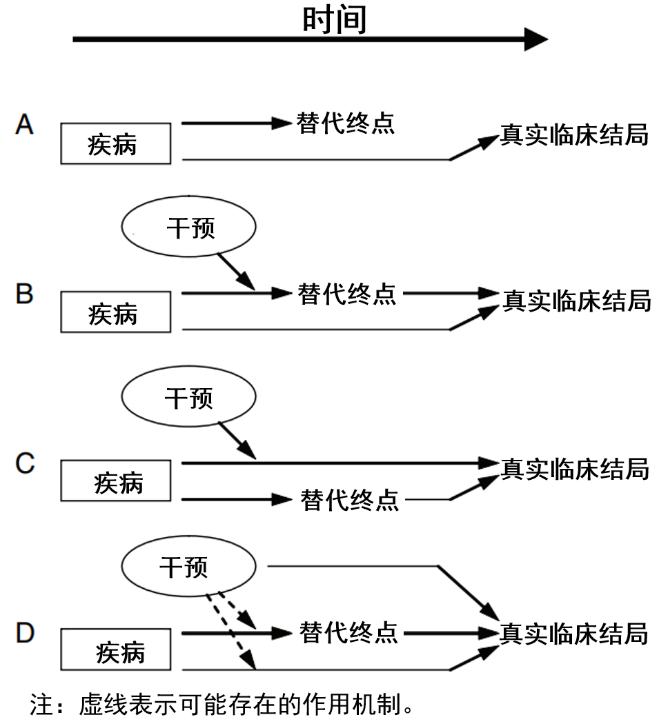
EClinicalMedicine:FDA采用替代终点批准新药上市,值得商榷!
在多种原始研究类型中,随机对照试验(RCT)是证据级别最高的设计。一方面,观察性研究以及某些特定人群的临床试验的数据,常常衍生出多元甚至相反的学术观点。此时高质量的、大规模RCT就成了公允的最佳解决方
MedSci原创 - 替代终点,新药上市 - 2020-05-10
FDA批准降低乳腺癌复发风险的新药
美国食品和药物管理局(FDA)日前批准来那替尼作为早期HER2阳性乳腺癌的扩展辅助治疗。来那替尼是此类癌症患者的首个扩展辅助治疗(初始治疗后进行的进一步降低癌症复发风险的治疗形式)。
环球医学 - FDA,新药,乳腺癌 - 2017-07-18
Celladon心力衰竭新药获FDA快速审评资格
近日,致力于心血管疾病药物研发的生物制药公司Celladon宣布,该公司治疗心力衰竭的药物Mydicar获得了美国FDA的快速审评资格。这意味该公司可以随时向FDA递交或者补充有关该药临床研究的数据,而不必排队等待审查。快速审评通道可以使美国FDA加速了解治疗严重疾病的药品或生物制品有无严重的、或危及生命的不良反应,从而判断是否能满足潜在的医疗需求。快速审评政策的一个重要作用就是加强FDA和研
心力衰竭,新药,FDA - 2012-01-07
FDA:2011财政年度批准的创新性新药
在过去的一年中,美国食品药物管理局批准了35个新药,是在过去十年内仅次于2009年(37个)的批准数量。 报告显示美国快速批准安全和有效药物走在其它各国之前。美国食品药品监督管理局在过去的12个月内批准了35个新药。这是在过去十年内批准的最高数目,仅低于2009年(37个)。许多药物都对患者的治疗有重要进展,包括两个丙肝
FDA,新药 - 2011-11-17
FDA:皮肤基底细胞癌新药Erivedge获批
2012年1月30日,美国食品与药物管理局(FDA)批准Erivedge(vismodegib)用于治疗成人最常见的皮肤癌——基底细胞癌。Erivedge经由优先审查程序获准,是FDA批准的首个治疗转移性基底细胞癌的药物。它通过抑制Hedgehog通路起效,这种通路在大多数基底细胞癌中活跃,但仅在少许正常组织中(
MedSci原创 - 基底细胞癌,肿瘤 - 2012-02-03
FDA批准治疗晚期前列腺癌新药Xtandi
2012年8月31日,美国食品和药物管理局(FDA)批准了Xtandi(enzalutamide)用于治疗晚期转移性或复发的去势抵抗性前列腺癌患者,和为了减少睾酮已进行了药物或手术治疗的患者。 Xtandi通过FDA的优先审查程序获准,适用于抗肿瘤药多西他赛治疗后的前列腺癌患者。 FDA药物评价与研究中心血液和肿瘤学产品办公室主任、医学博士理查德帕兹杜尔表示,Xtandi是被证
医学论坛网 - 前列腺癌,FDA,睾酮 - 2012-09-04
为您找到相关结果约500个