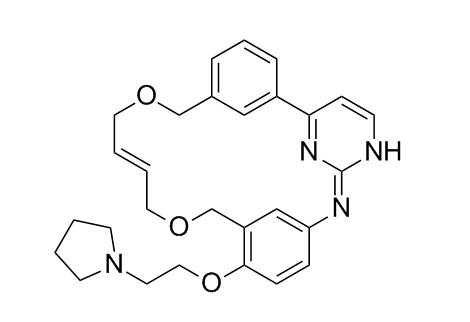
CHMP建议批准阿斯利康和百时美施贵宝降糖新药Xigduo
阿斯利康(AstraZeneca)和百时美施贵宝(BMS)11月22日宣布,降糖药Xigduo(dapagliflozin+盐酸二甲双胍)获得了欧洲药品管理局(EMA)人用医药产品委员会(CHMP)
生物谷 - 新药,FDA - 2013-11-26
辉瑞Xeljanz补充新药申请(sNDA)获FDA批准
辉瑞(Pfizer)11月18日宣布,FDA已批准Xeljanz(tofacitinib citrate)补充新药申请(sNDA),将患者报告结果(Patient-Reported Outcomes
生物谷 - 新药,FDA - 2013-11-20
2013年FDA批准的27个新药汇总
今年FDA批准的新药数量上少于去年,但质量上却高于去年,其中10个有重磅潜力。 1. Nesina:苯甲酸阿格列汀片 阿格列汀(alogliptin)是Takeda研发的新型DPP-4抑制剂,用于治疗II型糖尿病,已获得FDA批准的同类药物还有西他列汀(sitagliptin)、沙格列汀
scifans - FDA,2013,27个新药 - 2013-12-26
FDA推迟审查葛兰素史克GLP-1类降糖药albiglutide
葛兰素史克(GSK)今天宣布,FDA将实验性2型糖尿病药物albiglutide的美国处方药用户收费法(PDUFA)目标日期延长了3个月,至2014年4月15日,以便有足够的时间对葛兰素史克所提交的信息进行全面审查葛兰素史克于2013年1月14日向FDA提交了albiglutide的生物制品许可申请(BLA),并在之后的3月7日向欧洲药品管理局(EMA)提交了albiglutide的上市
生物谷 - 新药,FDA - 2013-08-05
FDA批准强生降糖药INVOKAMET用于2型糖尿病一线治疗
FDA已批准扩大糖尿病复方药INVOKAMET(canagliflozin/盐酸二甲双胍)的适应症,纳入2型糖尿病成人患者的一线治疗。此次批准,使INVOKAMET可处方用于尚未接受canagliflozin或二甲双胍的2型糖尿病患者,以及可能从这种双效降糖疗法中受益的2型糖尿病患者。在III期临床中,一线治疗2型糖尿病成人患者时
生物谷 - 降糖药 - 2016-05-26
乳腺癌新药3期临床疗效显著,已向FDA提交新药申请
今天,总部位于美国洛杉矶的生物技术公司 Puma Biotechnology 宣布了最新补充的积极3期临床试验(ExteNET trial)结果,在该项研究中使用其在研新药来那替尼同时,基于这些良好的3期(ExteNET)结果,Puma 向美国FDA提交了一份有关来那替尼的新药申请(NDA)
药明康德 - 乳腺癌,FDA,临床试验 - 2016-07-24
百时美向FDA提交丙肝新药NDA
百时美施贵宝(BMS)4月7日宣布,已向FDA提交了实验性丙肝药物daclatasvir(DCV)和asunaprevir(ASV)的新药申请(NDA),daclatasvir是一种实验性NS5A复制复合物抑制剂
生物谷 - 新药,FDA - 2014-04-08
FDA批准两款糖尿病新药组合
近日,美国FDA批准了两款2型糖尿病新药组合,这两款药物均为每天注射一次的长效胰岛素与胰高血糖素样肽-1(GLP-1)类似物组合,针对单独使用胰岛素或GLP-1类似物不能有效控制血糖的患者,它们分别来自法国药企赛诺菲
药明康德 - 糖尿病新药 - 2016-11-24
白血病新药Mylotarg终获美FDA认可
辉瑞(Pfizer)公司宣布,其新药Mylotarg(gemtuzumab ozogamicin)得到了美国FDA的批准,用于治疗表达CD33抗原的新诊断急性骨髓性白血病(AML)的成人患者。FDA同时也批准该药物用于治疗2岁及以上的CD33阳性AML患者,这些患者经历复发或对初始治疗没有响应。
健康时报网 - 白血病,Mylotarg,FDA - 2017-09-03
QRxPharma公司向FDA再次提交Moxduo新药申请
澳大利亚QRxPharma公司在美国食品药品监督局(FDA)对其新药申请和数据有效性文件进行指导后再次向FDA提出Moxduo的新药申请。QRxPharma公司的MD兼CEODrJohnHoladay说:“我们有信心我们再次的NDA中的数据文件能够证明我们的产品在呼吸系统安全性,并且我们希望FDA可以考虑到速释型Moxduo作为治疗选择将有利于数百万正在急性痛苦中备受煎熬的病人我们在与FDA
中国医药保健品进出口商会 - 新药,FDA - 2013-12-17
拜耳制药新药Gadavist通过FDA批准
3月14日,美国食品药品管理局(FDA)批准Gadavist(钆布醇)——一个含钆的造影剂,用于患者中枢神经系统的磁共振成像(MRI)检查。据悉,Gadavist是FDA批准的用于中枢神经系统磁共振成像的第六个含钆造影剂(GBCAs),适用于两岁及以上的儿童和成人。
MedSci原创 - FDA,Gadavist,拜耳 - 2012-04-14
2012年3月FDA批准新药概况
2012年3月,FDA批出新分子实体药品2个,新剂型药品3个。2个新分子实体药品分别为预防高危早产儿发生呼吸窘迫综合征的SURFAXIN和治疗慢性肾脏病透析成年患者贫血的OMONTYS。表:2012年3月FDA批准新药 商品名 通用名(中文) 公司 规格 剂型
米内网 - 新药,FDA - 2012-05-10
FDA最新批准的呼吸道新药盘点
2011年8月至2012年3月期间FDA批准的呼吸科新药盘点: XALKORI:治疗ALK阳性的局部晚期或转移的非小细胞肺癌 (NSCLC) XALKORI (通用名:crizotinib capsule(crizotinib)胶囊获得美国食品药品管理局(FDA)批准,这是第一个对间变性淋巴瘤激酶 (ALK)进行靶向治疗的药
MedSci原创 - 呼吸,FDA - 2012-03-12
新药研究如何符合美国FDA的申报要求
北京昭衍新药研究中心美国公司总经理,前FDA官员,龚兆龙先生介绍美国FDA新药申报的相关要求。版权为北京昭衍新药研究中心公司所有,如有转载需要,请联系北京昭衍新药研究中心或生物谷
会议 - 2008-06-21
为您找到相关结果约500个