9价HPV疫苗获优先审评 有望扩大适用年龄
FDA已经授予该sBLA优先审评资格,有望在2018年10月6日之前给出答复。在美国,大多数性活跃的男
药明康德 - 9价HPV疫苗 - 2018-06-20
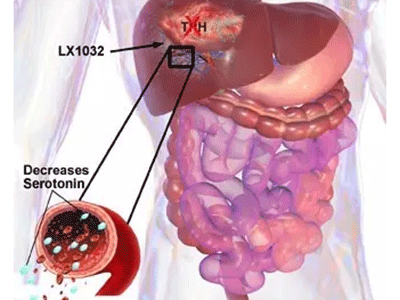
FDA将优先审评类癌综合症新药carcinoid syndrome
致力于研发精准新药用于治疗严重慢性疾病的生物制药公司Lexicon Pharmaceuticals宣布,美国FDA已接受了telotristat etiprate新药申请的优先审评。若通过,telotristat etiprate将是首个被批准用于类癌综合症(carcinoid syndrome)的口服治疗药物。
MedSci原创 - 类癌综合症,FDA - 2016-06-04
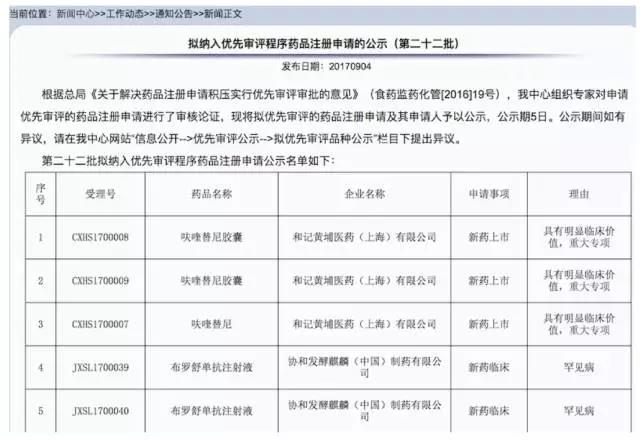
【喜讯】肠癌新药呋喹替尼进入CDE优先审评程序
9月4日,国家食品药品监督管理局药品评审中心(CDE)在官网上发布公告,包括我国原创小分子靶向药物呋喹替尼在内的多个药品进入优先审批程序。
肿瘤资讯 - 呋喹替尼,靶向药物,药品注册 - 2017-09-07
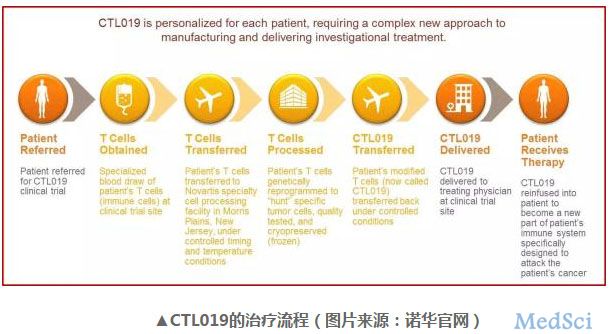
诺华CAR- T疗法今日获美国FDA优先审评资格
3月29日,诺华宣布美国 FDA 已为其 CAR- T 疗法 CTL019(tisagenlecleucel-T)的生物制剂许可申请颁发了优先审评资格。
药明康德 - 诺华,CAR-T疗法,癌症 - 2017-03-30
卫计委:18个重大新药创制优先药品审评名单
为加快重大新药创制科技重大专项(以下简称“新药专项”)创新成果产出进程,根据有关文件规定和专家评审遴选建议,拟推荐法米替尼等18个专项支持的药物品种为优先审评品种。 现将拟推荐的品种予以公示。
国家卫生和计划生育委员会 - 新药,药品审评 - 2015-01-15
CSCO2022 CDE专场|抗肿瘤药物临床研发中最佳给药策略审评考量
CDE仝昕审评员发表了题为“抗肿瘤药物临床研发中最佳给药策略审评考量”的报告,她表示新药上市前应个性化、多维度、综合各种数据制定最佳给药策略。
网络 - CSCO,抗肿瘤药物,CDE - 2022-11-08
类癌综合症新药carcinoid syndrome获FDA优先审评资格
本周,致力于研发精准新药用于治疗严重慢性疾病的生物制药公司Lexicon Pharmaceuticals宣布,美国FDA已接受了telotristat etiprate新药申请的优先审评。若通过,telotristat etiprate将是首个被批准用于类癌综合症(carcinoid syndrome)的口服治疗药物。
药明康德微信号:WuXiAppTecCh - 类癌综合症,类癌瘤,FDA - 2016-06-05
FDA“创新行动计划”促进药品研发与审评
FDA新任局长Scott Gottlieb 博士于2017年7月7日在FDA的官方博客-FDA Voice上发表了题为“ How FDA Plans to Help Consumers Capitalize on Advances in Science”的文章,旨在推行“创新行动计划”,使公众尽快获益于安全有效的新药和新的医疗技术。
CDE网站;凡默谷 - FDA,药品研发,药品评审 - 2017-09-08
诺华ceritinib获FDA优先审评,有望一线用于肺癌治疗
今日,诺华(Novartis)宣布,美国FDA接受了该公司的补充新药申请(sNDA),并批准优先审评扩大使用Zykadia(ceritinib)一线治疗转移性非小细胞肺癌(NSCLC)患者,这些病人的肿瘤通过
MedSci原创 - ceritinib,Zykadia,诺华,优先审评 - 2017-02-24
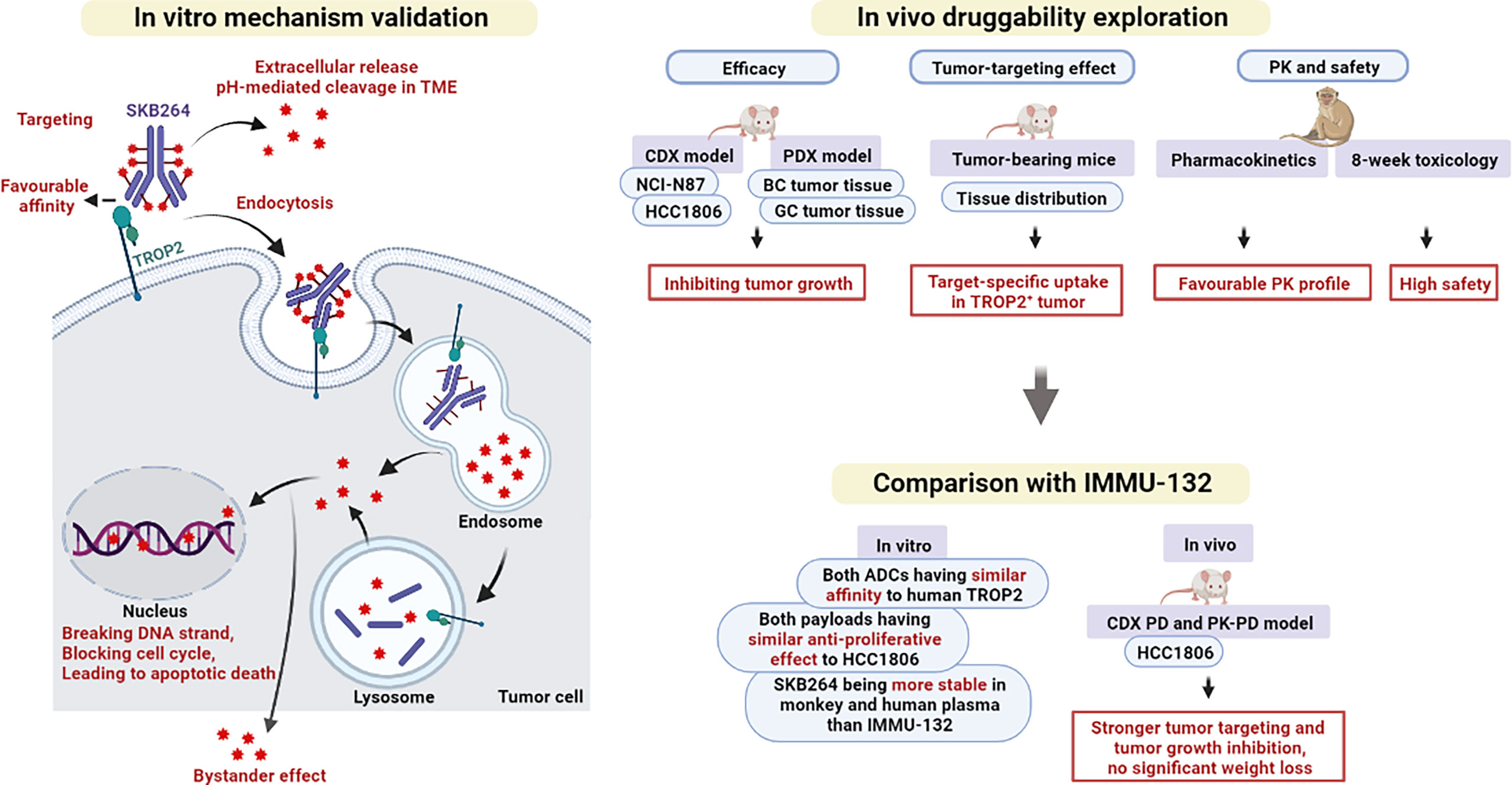
科伦博泰ADC药物SKB264三阴性乳腺癌新适应症拟纳入优先审评!
科伦博泰宣布SKB264对比研究者选择方案用于治疗既往经二线及以上标准治疗的不可手术切除的局部晚期、复发或转移性三阴性乳腺癌患者的随机、对照、开放性、多中心III期临床试验达到了由独立评审委员(IRC
MedSci原创 - 三阴性乳腺癌,ADC药物,SKB264,科伦博泰 - 2023-11-05
FDA优先审评多肽-药物偶联物(PDC)Melflufen治疗难治性多发性骨髓瘤的申请
Melflufen对骨髓瘤细胞株表现出细胞毒活性,且该细胞株对包括烷基化剂在内的其他治疗有抵抗力,并且在临床前研究中还显示出Melflufen对DNA修复和血管生成具有抑制作用。
MedSci原创 - 多发性骨髓瘤,复发/难治性多发性骨髓瘤,Melflufen,新型抗癌肽-药物偶联物Melflufen - 2020-08-31
礼来Verzenio、安进Blincyto被纳入优先审评
日前,国家药品监督管理局药品审评中心(CDE)官网显示,礼来的CDK4/6抑制剂Abemaciclib(Verzenio)和安进的双特异性抗体注射用倍林妥莫双抗(blinatumomab,商品名:Blincyto)拟被纳入优先审评审批品种。
新浪医药新闻 - 抗癌药 - 2019-12-12
从“一致性评价”和“优先审评”中寻医药股机会
医药行业整体估值喜忧参半,目前水平大约在36倍左右,同比下降,可能是受到诸多省份对抗菌药物、中药注射剂、辅助性药品、营养性药品等药品的限用、停用的影响。2018年,随着一些公司提前通过仿制药一致性评价和新药申报进入优先审评,预计行业估值会得到一定提升,大概保持在10%左右的增长。
证券时报网 - 一致性评价,医药股,优先审评 - 2017-12-20
这些药品和疫苗的注册申请拟纳入优先审评程序啦!
国家食品药品监督管理总局药品审评中心2018年4月23日发布“拟纳入优先审评程序药品注册申请的公示(第二十八批)”
国家食品药品监督管理总局药品审评中心 - 优先审评,药品审评,药品注册 - 2018-04-30
CDE发布了《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见
本周五,CDE发布关于《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见的通知,对突破性治疗药物工作程序和优先审评审批工作程序做了说明。突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序是为我国鼓励创新和满足临床急需而设立的四个加快通道。其中,突破性治疗药物程序定位于药品临床试验研制阶段;优先审评审批程序定位于药品上市注册阶段。 这让人不禁联想到美国FDA的四种加快
网络 - CDE,突破性治疗药物 - 2019-11-09
为您找到相关结果约500个